嗅三针治疗对阿茨海默病模型大鼠海马蛋白激酶A活性的影响*
牛文民 刘智斌 杨晓航 王 渊
陕西中医学院针灸系实验研究中心,西安 712046
阿茨海默病(Alzheimer’s disease,AD)是严重危害老年人生命健康和生活质量的中枢神经系统退行性疾病。本研究团队多年来从事嗅三针疗法治疗AD的临床及实验研究,证实该疗法能够有效干预AD病理过程[1-5],本研究通过进一步观察嗅三针疗法对AD大鼠海马组织中蛋白激酶A(PKA)活性的影响,深入探讨嗅三针治疗AD的作用机制。
1 材料与方法
1.1 实验动物
选择成年SD雄性大鼠50只,体重(300±10)g,由第四军医大学实验动物中心提供。
1.2 主要仪器
Morris水迷宫实验系统(北京现代太极电子有限公司);Multiskan MK3全自动酶标仪(美国Bio-rad公司)。
1.3 大鼠模型制作
1.3.1 AD大鼠模型制作 将Aβ1~40肽段溶于灭菌蒸馏水中,浓度为5g/L,淀粉样蛋白Aβ1~40试剂购自北京中杉金桥生物技术公司,用前37℃孵育48 h,使其变为凝聚状态的Aβ。用10%水合氯醛(0.4 ml/100g体重)腹腔注射麻醉大鼠,固定于脑立体定位仪。常规无菌操作,切开皮肤,参照包新民等[6]绘制《大鼠脑立体定向图谱》,选择左侧海马为注射靶区(前囟后3.5mm,中缝左侧旁开2.0mm,硬脑膜下2.8mm)用牙科钻在颅骨对应位置开直径为1mm的2个小孔,暴露硬脑膜,微量进样器自脑表面垂直进针2.8mm,将 Aβ1~40肽段2 μ(10 μg),缓慢(0.5 μl/min)注入,留针5min以保证溶液充分扩散,然后缓慢撤针(3min),缝合切口。手术部位施以适量青霉素抗感染,常规饲养[7]。
1.3.2 AD嗅神经切断大鼠模型制作 参照羡慕等[8]报道的切断嗅神经方法,将AD造模后的大鼠用水合氯醛麻醉后,固定在立体定位仪上。在大鼠颅顶正中切开皮肤,小范围分离暴露前囟。在大鼠颅顶正中线位于前囟前面5mm两侧旁开2mm处,分别钻2个直径为1mm的小孔,深度至暴露嗅球,但不损伤嗅球;使用显微解剖镊提起嗅球前端的硬脑膜,锐性切断嗅神经,尽量避免伤及嗅球,同时明胶海绵压迫止血,伤口处点青、链霉素,缝合伤口。对照组仅于颅顶钻孔后即缝合皮肤,不伤及嗅球及嗅神经。
1.4 动物分组及处理
将大鼠随机分为正常对照组、AD模型组、AD+嗅神经切断模型组、嗅三针组和嗅三针+嗅神经切断组,每组10只。嗅三针组和嗅三针+嗅神经切断组均进行嗅三针治疗,正常对照组、AD模型组和AD嗅神经切断模型组,每日1次,采取与以上两组相同的捉拿固定,但不施加任何干预措施。
嗅三针穴位定位:依据李忠仁教授[9]主编的《实验针灸学》动物选穴标准,选取两侧迎香及印堂穴。迎香穴位于大鼠鼻孔外侧上端,有毛与无毛交界处;印堂穴位于大鼠两眼眶上缘中点连线与正中线交点。操作:选用“华佗牌”不锈钢针,30号0.5寸毫针。于迎香穴向内上方斜刺0.3cm,印堂穴向鼻根部平刺0.3cm;电针仪:G6805电针仪(上海医疗仪器厂);刺激参数:疏密波,频率80~100Hz;刺激强度:以保持针刺局部轻微抖动为度(电流强度:1~3mA,电压:1~3V);时间:留针10min,持续电刺激,每日1次。5 d为1个疗程,休息2d,共进行6个疗程。
1.5 检测指标
1.5.1 Morris水迷宫定位航行实验 治疗结束后,开始水迷宫测试[10]。水迷宫内水深41cm,水温22~26℃。在水池壁标明4个入水点,由此将水池等分为4个象限,任选一象限正中放置平台,没于水下1cm,水面覆盖塑料泡沫。将受试大鼠按顺时针方向依次由E、S、W、N 4个入水点顺序面向池壁放入水中,记录2min内寻找平台的时间(逃避潜伏期)。如果大鼠在2min内找到平台,记录其实际逃避潜伏期及游泳路程;如果大鼠在2min内未找到平台,由测试者将其引上平台并停留10s,逃避潜伏期记录为2min。历时6d,每日1次。以6d找到平台的平均逃避潜伏期和平均游泳路程评价动物的学习记忆能力。
1.5.2 海马组织的PKA活性测定 实验结束后快速将大鼠断头取脑,分离海马,取适量海马组织样品,迅速标号放入EP管投入液氮中,随后置于-70℃冰箱内保存备用。采用生物素双抗体夹心酶联免疫吸附法(ELISA)测定海马中的PKA活性。具体操作过程严格按照PKA酶联免疫检测试剂盒使用说明书进行(试剂盒购自南京建成生物工程研究院)。
1.6 统计学处理
采用SPSS 12.0软件,实验数据用±s表示,采用单因素方差分析、组间均值进行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠Morris水迷宫定位航行实验情况
大鼠6d平均逃避潜伏期和平均游泳路程比较,AD模型组及AD+嗅神经切断组均显著长于正常组(P<0.01);嗅三针组与嗅三针+嗅神经切断组均显著短于 AD模型组(P<0.01,P<0.05);嗅三针组短于嗅三针+嗅神经切断组(P<0.05);AD模型组与AD+嗅神经切断组相比较,其差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠Morris水迷宫定位航行实验结果比较(n=10,±s)
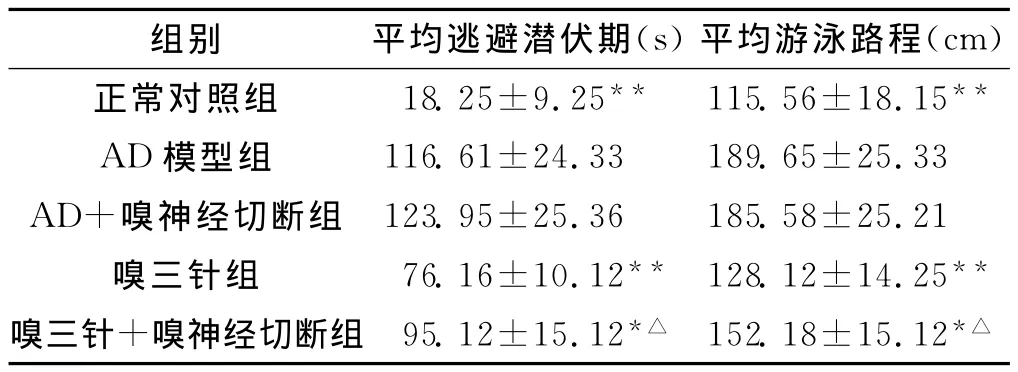
表1 各组大鼠Morris水迷宫定位航行实验结果比较(n=10,±s)
与模型组比较* P<0.05,** P<0.01;与嗅三针组比较△ P<0.05
组别 平均逃避潜伏期(s)平均游泳路程(cm)正常对照组 18.25±9.25** 115.56±18.15** AD模型组 116.61±24.33 189.65±25.33 AD+嗅神经切断组 123.95±25.36 185.58±25.21嗅三针组 76.16±10.12** 128.12±14.25** 嗅三针+嗅神经切断组 95.12±15.12*△ 152.18±15.12*△
2.2 各组大鼠海马组织PKA活性
各组大鼠海马组织PKA活性比较,正常对照组、嗅三针组和嗅三针+嗅神经切断组均明显高于AD模型组(P<0.01);嗅三针组高于嗅三针+嗅神经切断组(P<0.05);AD模型组与AD+嗅神经切断组相比较,其差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠海马组织PKA活性的比较(n=10,ng/L,±s)
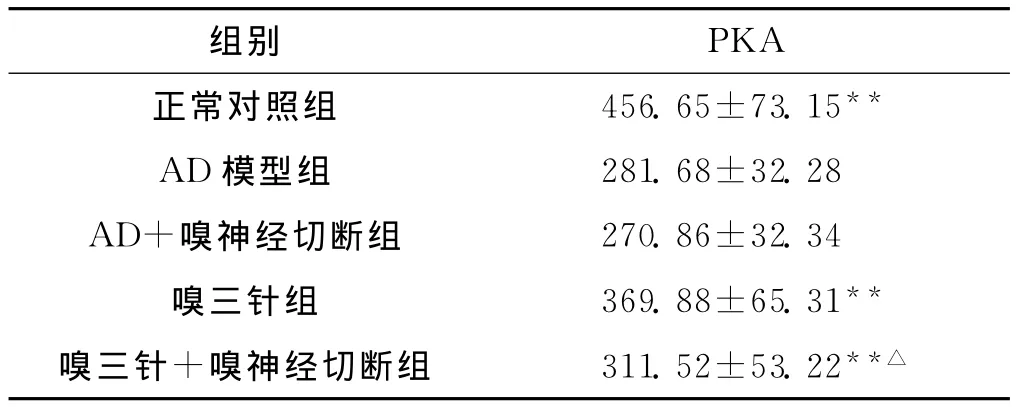
表2 各组大鼠海马组织PKA活性的比较(n=10,ng/L,±s)
与模型组比较** P<0.01;与嗅三针组比较△ P<0.05
PKA正常对照组 456.65±73.15组别**AD模型组 281.68±32.28 AD+嗅神经切断组 270.86±32.34嗅三针组 369.88±65.31** 嗅三针+嗅神经切断组 311.52±53.22**△
3 讨论
蛋白激酶A(protein kinase A,PKA)是第二信使cAMP依赖的蛋白激酶,是细胞内参与信号转导通路上的重要激酶。细胞外刺激信号经细胞膜受体使腺苷酸环化酶活化,从而催化ATP生成cAMP,由此激活PKA,促进PKA进入细胞核发生磷酸化,最终激活cAMP反应成分结合原件(cAMP-response element binding protein,CREB),启动基因的转录,然后产生一系列功能调节活动。现已确认,cAMP/PKA-CREB信号通路在学习与记忆形成机制中发挥着重要作用[11]。
有研究[12]证实,AD 的脑组织中cAMP/PKA/CREB信号通路明显受损,尤其是海马CA1区的PKA活性显著降低,影响了突触可塑性,导致学习记忆特别是长时程记忆形成障碍。有研究[13]表明,针刺治疗能明显提高AD大鼠海马内PKA的活性,从而恢复学习记忆能力。
本研究结果显示,嗅三针能够明显增强AD模型大鼠学习记忆能力,并且能提高AD模型大鼠海马组织中PKA的活性。然而,嗅三针+嗅神经切断组虽然其学习记忆能力也有所增强,且海马组织PKA的活性升高,但其水平不及嗅三针组,两组结果的差异有统计学意义(P<0.05)。这表明嗅三针对于AD大鼠的疗效主要是通过嗅觉传导通路对中枢神经系统产生影响的,这与本团队先前的研究[1-5]结果相一致。
本研究证实了嗅三针疗法对AD具有确切的治疗作用,其作用机制与调节海马组织PKA的活性密切相关,其疗效的发挥有赖于嗅觉传导通路的完整性。
[1]牛文民,刘智斌,杨晓航,等.嗅三针对痴呆大鼠海马胆碱能系统功能影响[J].针灸临床杂志,2008,24(10):38-39.
[2]刘智斌,牛文民,杨晓航,等.嗅三针对老年痴呆大鼠学习记忆功能及海马胆碱乙酰化酶、乙酰胆碱酯酶活性的影响[J].针刺研究,2009,34(1):48-51.
[3]刘智斌,牛文民,杨晓航,等.嗅三针对痴呆大鼠大脑边缘叶胆碱能系统功能的影响[J].中国中医基础医学杂志,2009,15(3):206-207.
[4]刘智斌,牛文民,杨晓航,等.嗅三针对阿尔茨海默病大鼠海马Bcl-2和Bax表达的干预效应[J].针刺研究,2011,36(1):7-11.
[5]杨晓航,刘智斌,牛文民,等.嗅三针对阿尔茨海默病大鼠海马毒覃碱型受体的影响[J].针刺研究,2011,36(2):90-94.
[6]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991.
[7]库宝善.神经精神药理学[M].北京:北京大学医学出版社,2006:479-480.
[8]羡慕,魏永祥,韩德民,等.嗅神经切断术后白血病抑制因子在嗅上皮中的表达[J].中国耳鼻咽喉头颈外科杂志,2005,12(6):377-380.
[9]李忠仁.实验针灸学[M].北京:中国中医药出版社,2004:327-329.
[10]MORRIS RG,GARRUD P,RAWLINS IN,et al.Place navigation impared in rats with hippocampal lessens[J].Nature,1982,297(5868):681-683.
[11]MUNNO DW,PRINCE DJ,SYED NI.Synapse number and synaptic efficacy are reguLated by presynaptic c-AMP and PKA[J].J Neurosci,2003,23(10):4146-4155.
[12]MATSUSHITA M,TOMIZAWA K,MORIWAKI A,et al.A high efficiency protein transduction system demonstrating the role of PKA in long lasting LTP.[J].J Neuro Sci,2001,(21):6000-6007.
[13]沈峰,孙国杰.电针对AD大鼠海马PKA影响的实验研究[J].中华中医药学刊,2013,31(4):731-732.

