红佳酿酵母β-葡萄糖苷酶活性测定及产酶特性
马腾臻,杨学山,张莉,张彦芳,李颍,祝霞,王婧,韩舜愈
1(甘肃农业大学,甘肃 兰州,730070)2(甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州,730070)3(甘肃省葡萄酒产业技术研发中心,甘肃兰州,730070)
香气是葡萄酒的重要感官质量指标之一。萜烯、C13-降异戊二烯衍生物等品种香气化合物决定了葡萄酒的品种典型性和产地风格,这些物质主要以无味的糖苷键合态形式存在,可在酿造过程中通过酶水解或者酸水解作用转变为游离态,从而增强葡萄酒品种香[1-2]。
β-葡萄糖苷酶(β-glucosidase EC 3.2.1.21,βG)可水解糖苷键合态风味前体物,是进行葡萄酒风味修饰的关键酶[3]。葡萄酒中的糖苷酶可来源于葡萄果实、商品酶制剂(多源于丝状真菌)、酵母(酿酒酵母和非酿酒酵母)及乳酸菌[4],酿造过程中酵母来源β-葡萄糖苷酶对键合态香气化合物的释放起着重要作用[5-6],可使发酵后酒的品种风味特征得到有效表达[1]。
β-葡萄糖苷酶活性测定方法主要有电化法、荧光法和分光光度法,其中以对硝基苯基-β-D-吡喃葡萄糖苷(p-NPG)为反应底物的比色法最为普遍,该方法操作简单、快速、灵敏度高、重现性好[7]。但由于不同来源β-葡萄糖苷酶酶学性质有较大差异,使得测定结果受反应时间、温度、pH和底物浓度等条件的影响,不仅降低了数据的准确性,更不利于研究结果间的比较分析。
本试验以甘肃河西走廊地区葡萄酒厂常用,且经前期筛选具有较高β-葡萄糖苷酶活性的红佳酿酵母为试材,通过单因素及正交试验优化酶活测定条件,分析其产酶特性,以期为高产β-葡萄糖苷酶酵母菌株筛选及葡萄酒品种香气调控研究提供理论依据。
1 材料与方法
1.1 材料与试剂
商品酿酒酵母:红佳酿Vintage Red(VR),意大利 Enartis公司;Levuline BRG,Lavin QA23,Lavin ICV D254,Lavin RC212,法国 Lallemand 公司;Fermicru VR5,Fermicru LVCB,荷兰 DSM Food Specialties公司;VL1,法国 Laffort公司;Bayanus(BAY),XR,法国Lamothe-Abiet公司;Elegance(ELE),AWRI 796,澳大利亚Maurivin公司。(注:括号内为文中所用菌株的代码)。
p-NPG(4-Nitrophenyl β-D-glucopyranoside,纯度>98%),美国Sigma公司;蛋白胨,酵母浸粉,北京奥博星生物技术有限责任公司;对硝基苯酚(p-NP),葡萄糖,无水Na2HPO4,柠檬酸,无水Na2CO3等均为国产分析纯。
YPD液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,超纯水,pH 5.0;121℃灭菌20 min。
1.2 主要仪器与设备
CP214电子天平,上海奥豪斯仪器有限公司;HH-S型恒温水浴锅,金坛市恒丰仪器制造有限公司;Genesis 10s紫外可见分光光度计,美国Thermo Scientific公司;GZX-GF101-Ⅱ电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;18100摩尔超纯水机,重庆摩尔水处理设备有限公司;H2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;NRY-200空气恒温摇床,上海南荣实验室设备有限公司;SWCJ-2FD洁净工作台,苏净集团苏州安泰空气技术有限公司;SPX-150-Ⅱ生化培养箱,上海跃进医疗器械有限公司;SYQ-DSX-280B手提式不锈钢压力蒸汽灭菌锅,上海申安医疗器械厂;单道移液器,德国Eppendorf公司;PHS-3C pH计,上海雷磁有限公司。
1.3 方法
1.3.1 菌株活化与培养
按推荐用量(0.2 g/L)称取于4℃保存的红佳酿酵母,接种至50倍体积的YPD液体培养基中,37℃活化20 min。活化后的菌株接种至含有20 mL YPD培养基的50 mL摇瓶中,28℃,180 r/min,培养48 h,每个样品重复2次。
1.3.2 标准曲线绘制
准确称取对硝基苯酚(p-NP)139.0 mg,溶解于蒸馏水并定容至 1 000 mL,分别吸取0.1、0.2、0.3、0.4、0.5、0.6 mL 于 10 mL 容量瓶中,用 1 mol/L Na2CO3溶液定容后混匀,以蒸馏水为空白,于400 nm处测定吸光值并绘制标准曲线。
1.3.3 β-葡萄糖苷酶活性测定条件优化
1.3.3.1 酶活测定
将细胞培养液于 8 000 g,4℃条件下离心10 min,收集上清液。取上清液 100 μL,加入 200 μL p-NPG(5 mmol/L溶于pH 5.0柠檬酸-磷酸氢二钠缓冲溶液中,P-C缓冲液)混匀,50℃反应30 min,立即加入2 mL 1mol/L Na2CO3终止反应并显色,于400 nm下测定吸光值[8]。摩尔消光系数为:ε=18 300 m-1·cm-1[9]。
1.3.3.2 单因素试验设计
以酶活力为评价指标,研究反应时间、反应温度、底物浓度和缓冲液pH等因素在不同水平条件下对酶活力的影响,平行重复3次,单因素试验的不同水平见表1。
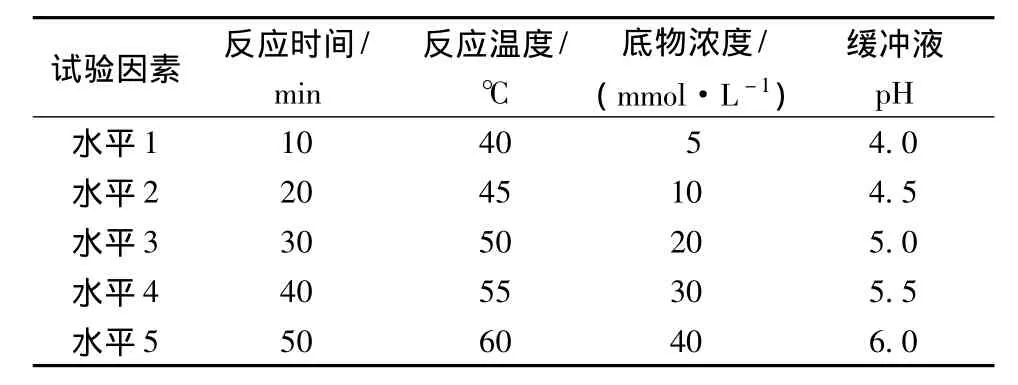
表1 单因素试验选取的不同水平Table 1 Levels of single-factor tests
1.3.3.3 正交试验优化
在单因素试验的基础上,确定正交试验因素和水平,进行L9(34)正交试验,优化测活条件,结果取3次重复的平均值,见表2。
1.3.4 产酶特性研究
1.3.4.1 不同酿酒酵母菌株β-葡萄糖苷酶活性比较
酵母糖苷酶存在于细胞外,完整细胞(也称细胞表面)和细胞内(也有学者认为只有胞外酶和完整细胞酶2种存在形式[10]),但只有胞外酶和完整细胞酶才能水解糖苷键合态香气前体物,胞内酶则不起作用[11]。发酵结束后,酵母细胞在重力作用下沉降,作为酒泥除去,而胞外糖苷酶活性则可维持较长时期[12-13],对增强葡萄酒风味具有重要作用。
为衡量不同酵母产酶能力,以12株常用商品酿酒酵母为研究对象,测定其胞外及完整细胞酶活,操作流程见图1[8]。

图1 样品处理流程图Fig.1 Flow diagram for sample processing
胞外酶:以各菌株加热灭活后的上清液为空白,用经正交试验优化的反应条件进行测定。
完整细胞酶:以经加热灭活的细胞溶液为空白,参照胞外酶方法进行测定。胞外酶与完整细胞酶之和为总酶活[14]。
1.3.4.2 生长及产酶曲线
参照1.3.1中方法培养红佳酿酵母,每4 h取样,测定OD600值和胞外酶酶活,绘制生长及产酶曲线。
1.4 酶活力计算

式中:U为酶活力单位,U/mL;c为对硝基苯酚的浓度;V为反应体系的体积;N为稀释倍数;t为反应时间;0.1为所取上清液或细胞液的体积。
β-葡萄糖苷酶酶活力单位(U)定义为,在上述反应条件下,1 min内底物被释放出1 μmol的p-NP所需要的酶量。
1.5 数据处理方法
所有平均值数据经过IBM SPSS statistics 18软件进行分析,数据以结果±标准差SD表示。
2 结果与分析
2.1 对硝基苯酚标准曲线
以对硝基苯酚浓度为横坐标,吸光值为纵坐标绘制标准曲线,结果如图2所示,得线性回归方程、相关系数分别为:Y=19.882x+0.001 7,R2=0.999 8。
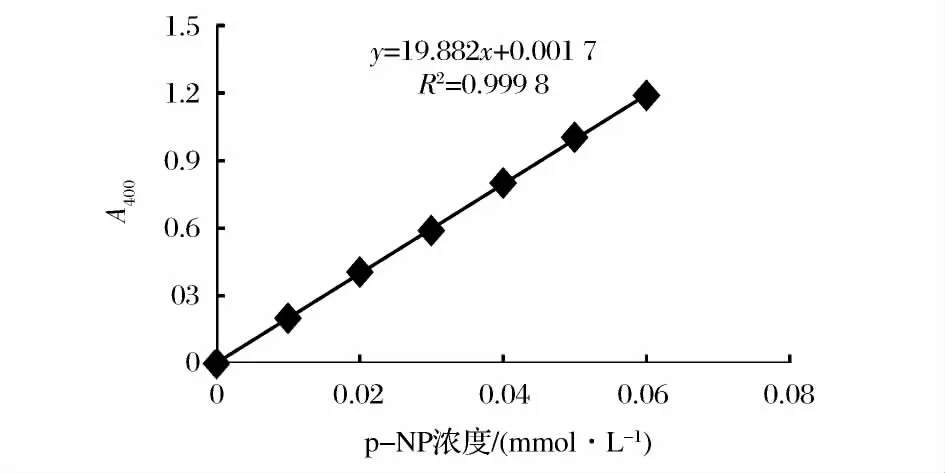
图2 对硝基苯酚标准曲线Fig.2 Calibration curve for p-nitrophenol assay
2.2 单因素试验结果分析
2.2.1 反应时间对酶活性的影响
由图3可以看出,随着反应时间的延长,酶活性先降低,后趋于平缓,但差异不显著。这是由于当反应体系中酶浓度与底物浓度一定时,随反应的进行,反应速率及酶活力会随着底物浓度的降低而降低;而当底物浓度降低至一定程度后,反应速率及酶活力均较低且趋于稳定[15]。目前文献中酵母β-葡萄糖苷酶活性测定时间从 10~180 min 不等[16-18],反应时间过长导致试验周期延长,效率低;而反应时间过短时吸光值较小,不符合比色法的要求。综上所述,选择反应时间为10 min。
2.2.2 反应温度对酶活性的影响
由图4可知,温度对β-葡萄糖苷酶活性有较大影响,随反应温度的升高先增大后减小,50℃时到达最大值。这是因为:一方面,随温度的升高,反应速率随之加快;但当温度过高时,酶的生物活性会受到影响甚至因变性而失去其催化活性[15],因此酵母β-葡萄糖苷酶活性测定温度普遍较低,从25~50℃不等[19-20],后续试验选择反应温度为50℃。
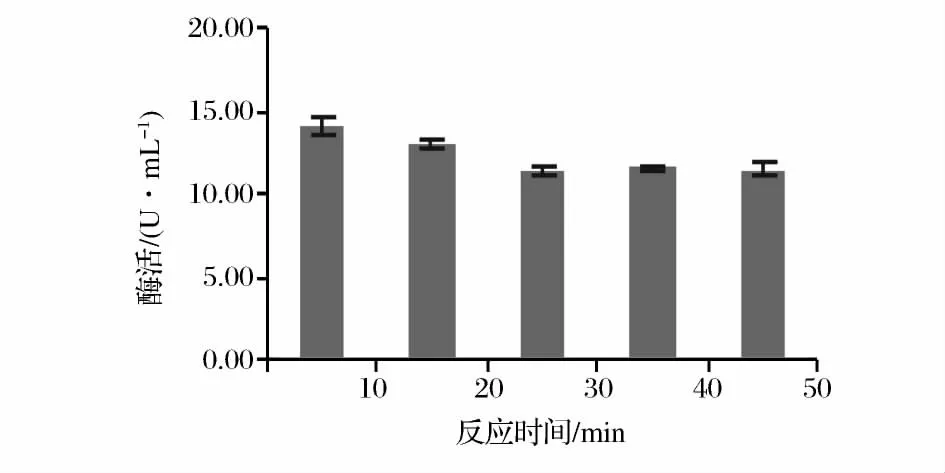
图3 反应时间对βG活性的影响Fig.3 Effects of reaction time on the activity of βG

图4 反应温度对βG活性的影响Fig.4 Effects of temperature on the activity of βG

图5 底物浓度对βG活性的影响Fig.5 Effects of substrate concentration on the activity of βG
2.2.3 底物浓度对酶活性的影响
底物浓度是决定酶催化反应速度的主要因素,与酶浓度共同决定反应速度[15],因此在酶活性测定过程中要求反应底物过量[7]。目前p-NPG法测定β-葡萄糖苷酶活性时底物浓度不尽相同,酵母来源从1~7 mmol/L 不等[17-19];酒球菌来源从 2~ 20 mmol/L不等[13,20];蜂蜜来源可达 30 mmol/L[21]。本试验以稀释2倍的粗酶液为研究对象,研究底物浓度对酶活力的影响,结果表明酶活力随底物浓度的增加而增大,当底物浓度较高时,增幅趋于平缓(图5),其中30 mmol/L和40 mmol/L p-NPG对酶活力影响不显著。考虑到 p-NPG价格较为昂贵,因此选择30 mmol/L的底物浓度进行后续试验。

图6 缓冲液pH对βG活性的影响Fig.6 Effects of pH value on the activity of βG
2.2.4 缓冲液pH对酶活性的影响
以不同pH值缓冲液稀释2倍的粗酶液为研究对象,考察反应pH对酶活性的影响。如图6所示,反应pH对酶活性有较大影响,且随pH值的增大先增大后减小,pH值为5.0时达到最大值。这是因为每种酶都有其各自的最适pH,在最适pH时酶催化反应速度达到最大,当pH过高或过低时都可引起酶的变性失活。大部分β-葡萄糖苷酶均为酸性蛋白,最适pH值在酸性范围内[7],酵母β-葡萄糖苷酶测定pH 值从4~ 6 不等[17-18,24],因此后续试验选择缓冲溶液pH为5.0。
2.3 正交试验
由表2可知,各因素对酶活性的影响程度为:B>C>A,即反应pH>底物浓度>反应温度。由k值得出最优组合A2B3C3,即40 mmo/L p-NPG溶于 pH 5.5的柠檬酸-磷酸氢二钠缓冲溶液中,50℃反应10 min。
用SPSS18.0统计软件对试验结果进行方差分析,其结果见表3。
由表3可知,缓冲液pH和底物浓度对酶活性均有显著影响,反应温度的影响则不显著。由于L9(34)正交试验得到的最优组合未在正交表中出现,所以需对正交试验得到的最优组合进行验证试验。在50℃,缓冲液pH值为5.5,底物浓度为40 mmol/L条件下反应10 min,重复5次,测得酶活力值为(47.58±0.58)U/mL,高于正交表中的试验组,因此经方差分析所确定的是最佳测活参数。此外,5次测定结果的相对标准偏差(RSD)为1.21%(n=5),说明该方法具有较好的重现性。

表2 正交试验设计及结果Table 2 Design and results of orthogonal test

表3 方差分析结果Table 3 Results of variance analysis
2.4 不同酿酒酵母菌株β-葡萄糖苷酶活性比较
由表4可知,上述12株商品酿酒酵母均具有β-葡萄糖苷酶活性,但各菌株酶活力大小及分布情况有较大差异。红佳酿(VR)、VL1、RC212和 QA23胞外酶活较高;LVCB和D254完整细胞酶活较高;796、LVCB、VR、VL1、RC212、D254 总酶活较高。其中,红佳酿酵母胞外酶活最高,且总酶活与商业高产菌株VL1 和 RC212[11,16]差异不显著,表明红佳酿酵母具有较好的产β-葡萄糖苷酶能力。
2.5 红佳酿酵母生长及产酶曲线
由图7可知,4~16h为红佳酿酵母的对数生长期,16h后即为稳定期,这可能是由于商品活性干酵母发酵特性好,生长繁殖较为迅速。随生长时间的延长,β-葡萄糖苷酶活性先增大,28 h后趋于平缓,36 h时达到最大值,这与Villena等人报道的Debaryomyces pseudopolymorphus酵母在YPC培养基中的产酶情况相似[5]。此外,该菌株β-葡萄糖苷酶的生物合成在细胞的生长阶段开始,当细胞生长进入稳定期后,还可以延续合成一段较长时间,属于延续合成型[15],不同于乳酸菌的同步合成型[22]。

表4 各菌株所产β-葡萄糖苷酶活性比较(U/mL)Table 4 βG activity comparison of different strains(U/mL)
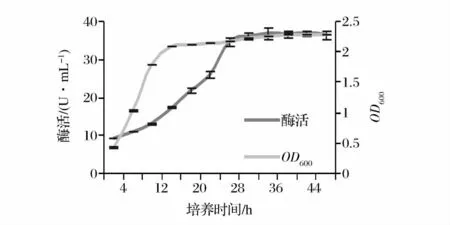
图7 红佳酿酵母生长及产酶曲线Fig.7 Grow and βG biosynthesis curve of VR
3 结论
通过单因素及正交试验研究了反应时间、反应温度、底物浓度和缓冲液pH等条件对β-葡萄糖苷酶活性的影响,发现反应温度、缓冲液pH和底物浓度对酶活影响较大,确定了最佳测活参数为:pH 5.5柠檬酸-磷酸氢二钠缓冲体系,40 mmol/L p-NPG,50℃反应10 min。
产酶特性研究结果表明红佳酿酵母所产β-葡萄糖苷酶活性较强,与其他11株商品酿酒酵母菌株相比其胞外酶活最高,总酶活也较高;生长及产酶曲线研究发现该菌株在培养16h时即达到稳定期,但直至36 h时酶活才达到最大值,证实该菌株β-葡萄糖苷酶的合成属于延续合成型。
[1]张明霞,吴玉文,段长青.葡萄与葡萄酒香气物质研究进展[J].中国农业科学,2008,41(7):2 098-2 104.
[2]Styger G,Prior B,Bauer F.Wine flavor and aroma[J].Journal of Industrial Microbiology& Biotechnology,2011,38(9):1 145-1 159.
[3]康文怀,徐岩,赵光鳌.葡萄酒风味修饰研究进展[J].食品与生物技术学报,2009,28(4):438 -443.
[4]Palmeri R,Spagna G.β-Glucosidase in cellular and acellular form for winemaking application[J].Enzyme and Microbial Technology,2007,40(3):382-389.
[5]Villena M,Iranzo J,Perez A.β-Glucosidase activity in wine yeasts:application in enology[J].Enzyme and Microbial Technology,2007,40(3):420 -425.
[6]Lepe J A,Morata A.New trends in yeast selection for winemaking[J].Trends in Food Science & Technology,2012,23(1):39-50.
[7]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J]. 食品与生物技术学报,2007,26(2):107 -114.
[8]王玉霞.阿氏丝孢酵母(Trichosporon asahii)β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D].无锡:江南大学,2012.
[9]Blondin B,Ratomahenina R,Arnaud A,et al.Purification and properties of the β-glucosidase of a yeast capable of fermenting cellobiose to ethanol:Dekkera intermedia van der walt[J].European Journal of Applied Microbiology and Biotechnology,1983,17(1):1-6.
[10]李颖,关国华.微生物生理学[M].北京:科学出版社,2013:98-144,250-301.
[11]张方方,江璐,刘延琳.两株商业酿酒酵母β-葡萄糖苷酶的研究[J].食品科学,2014,35(3):148-152.
[12]Rowe J,Harbertson J,Osborne J,et al.Systematic identification of yeast proteins extracted into model wine during aging on the yeast lees[J].Journal of Agricultural and Food Chemistry,2010,58(4):2 337-2 346.
[13]Capaldo A,Walker M E,Ford C M,et al.β-Glucoside metabolism in Oenococcus oeni:Cloning and characterization of the phospho-β-glucosidase bglD[J].Food Chemistry,2011,125(2):476-482.
[14]Sabel A,Martens S,Petri A,et al.Wickerhamomyces anomalus AS1:a new strain with potential to improve wine aroma[J].Annals of Microbiology,2014,64(2):483-491.
[15]郭勇编著.酶工程(第3版).北京:科学出版社,2009:5-10.
[16]李庆华.产β-葡萄糖苷酶菌株的筛选及酶活的研究[D].杨凌:西北农林科技大学,2009.
[17]Alfenas G,Lage L,Almeida M,et al.Hydrolysis of soybean isoflavones by Debaryomyces hansenii UFV-1 immobilised cells and free β-glucosidase[J].Food Chemistry,2014,146:429-436.
[18]Pandit N,Pandit A.Exploration of a cheaper carbon source for extracellular β-glucosidase synthesis from Debaryomyces pseudopolymorphus NRRLYB-4229[J].Applied Biochemistry and Biotechnology,2014,172(7):3 606-3 620.
[19]Hernandez P,Cersosimo M,Loscos N,et al.The development of varietal aroma from non-floral grapes by yeasts of different genera [J].Food Chemistry,2008,107(3):1 064-1 077.
[20]杨芮,吕珍,文彦.酒类酒球菌中β-葡萄糖苷酶性质研究[J]. 食品科学,2013,34(23):206-211.
[21]易松强,郑火青,张翠平,等.蜂蜜中β-葡萄糖苷酶活性测定及其来源分析[J].食品科学,2010,31(19):241-244.
[22]万振堂,杨丽杰.产胞外β-葡萄糖苷酶乳酸菌的筛选及其酶学性质的初步研究[J].食品与发酵工业,2009,35(4):28 -32.
[23]Hernandez L F,Espinosa J C,Fernandez M,et al.β-Glucosidase activity in a Saccharomyces cerevisiae wine strain[J].International Journal of Food Microbiology,2003,80(2):171-176.

