用β-淀粉酶制备蜡质大米糊精及其性质研究*
雷俊华,高群玉
(华南理工大学轻工与食品学院,广东广州,510640)
蜡质大米淀粉又称为糯米淀粉,与其他谷物淀粉相比具有一些特殊的性质,比如颗粒非常小(通常3~8 μm),粒度分布均匀,呈多角形[1]。相比马铃薯淀粉、甘薯淀粉、玉米淀粉、小麦淀粉,蜡质大米淀粉更容易被β-淀粉酶降解[2]。不同淀粉颗粒的大小和形状,酶解会有不同的效果,这些差异会导致不同的水解速率和应用性质[2]。
β-淀粉酶作为外切酶,不能水解α-l,6葡萄糖苷键,也不能越过分支点继续水解,但可以从淀粉的非还原端依次切开相隔的α-1,4糖苷键,得到麦芽糖单位,促使淀粉链长缩短[3]。水解达到62%~65%得到的不能继续水解的残留物被称为β-极限糊精。在国内,有关β-极限糊精的研究很少,赵燕等研究过β-淀粉酶水解玉米淀粉制备β-极限糊精并研究过其物理性质[4-5]。在国外,Ammeraal等从 Dull waxy starch中制得β-极限糊精,并研究了它的一些性质和用途[6]。Van der Veen J 等人[7],采用 β-淀粉酶作用于淀粉,得到β-极限糊精,它是一种改性淀粉聚合体,在水中不溶胀,有很好的黏合性,可充当黏合剂。在医药行业中,β-极限糊精可作麻醉药的缓释材料;因其具有润滑作用,会减弱疏松度的影响,可改善片剂的稳定性;在食品行业中,β-极限糊精可作橡胶糖的增稠剂、饮料的悬浊剂、脂肪替代品等。β-极限糊精水解程度大,产物得率低,不利于工业化生产,为了更好地利用糊精的优良性质,研究不同水解程度糊精的制备与性质具有现实意义。
本实验主要采用β-淀粉酶在一定条件下处理蜡质大米淀粉,对所得不同水解率糊精的颗粒形貌、淀粉-碘吸附结合物的吸收曲线、相对分子量溶胀性质、透明度等性质进行研究,为其应用提供理论依据。
1 材料与方法
1.1 材料与仪器
蜡质大米淀粉,江苏宝宝集团;大麦 β-淀粉酶(6 500 U/mL),日本天野酶制品株式会社;PHS-3C pH计,上海三信仪表厂;JJ500型电子天平,常熟市双节测试仪器厂;AM90L-H实验室数显电动搅拌机;HH-2数显恒温水浴锅,江苏金坛市富华仪器有限公司;TDL-5A离心机,上海菲恰尔分析仪器有限公司;722SP可见分光光度计,上海棱光技术有限公司;扫描电子显微镜,日立台式扫描电子显微镜Tm3000;i5紫外可见分光光度计,济南海能仪器有限公司;1260型高效液相色谱仪,美国安捷伦科技有限公司。
1.2 糊精的制备
称取20 g(干基)蜡质大米淀粉,用0.1 mol/L pH为5.2的醋酸-醋酸钠缓冲液制备成20%的淀粉乳,于95℃水浴下加热糊化30 min,并不停搅拌。糊化完全后降温至56℃,加入大麦β-淀粉酶(65 U/g),酶解,在95℃灭酶30 min。反应结束后,加入100 mL无水乙醇,以4 000 r/min离心15 min,重复2次。将所得沉淀物置于45℃的烘箱中,烘干,磨粉过100目筛即得样品。将水解 1、3、7、15、20 h 所得的糊精分别标记为β-1、β-3、β-7、β-15和β-20。
1.3 酶解淀粉水解率的测定
在上述反应过程中间隔不同时间,取1 mL反应液,加入无水乙醇,然后以4 000 r/min离心15 min,取1 mL上清液加入3 mL DNS试剂充分混匀后沸水浴中加热煮沸15 min。流水中冷却后加入21 mL蒸馏水,混匀,以空白对照550 nm测吸光度。通过标准曲线得到麦芽糖的含量。

1.4 淀粉颗粒形态观察
将待测样品置于105℃的烘箱中干燥4~5 h。在红外灯下用双面胶将淀粉样品固定在样品台上。进行喷金处理并将样品保存于干燥器中。观测并拍摄蜡质大米原淀粉及其糊精的颗粒形貌。
1.5 淀粉样品的碘吸附及波长扫描
称取0.08 g样品于20 mL二甲基亚砜中,加热溶解后取1 mL样品溶液转移至100 mL蒸馏水中,混匀,静置。取出3 mL,并加入75 μL 0.2%的碘液,摇匀后立即倒入比色皿中。扫描范围为450~615 nm,扫描间隔为1 nm,扫描速度为慢速,得到淀粉-碘吸附结合物的吸收曲线。
1.6 相对分子质量分布
用HPLC对样品相对分子质量进行测定,色谱柱为Shodex KS-806(8 mm×300 mm),检测器为示差检测器。样品配制成3 g/L的溶液,过0.45 μm的膜,以超纯水为流动相,进样量20 μL,流速为0.8 mL/min,柱温70℃,检测器温度为50℃。
1.7 溶解度和膨胀度的测定
在离心管中配制质量浓度为2%的淀粉乳50 mL,然后将其分别置于35、45、55、65、75、85 ℃下加热30 min,期间振荡若干次。待其冷却至室温后置于离心机中以4 000 r/min离心15 min,将上清液于105℃烘至恒重,称其质量为C,离心管中膨胀淀粉的重量为D,计算溶解度和膨胀度:
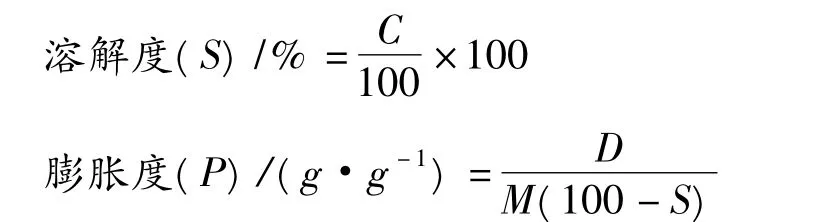
式中:C—被溶解的淀粉质量,g;M—干基质量,g;D—沉淀物质量,g。
1.8 透明度
准确称取1.0 g样品,加蒸馏水配成1 g/mL的淀粉乳,于沸水中加热糊化15 min,冷却至室温。用紫外分光光度计,以蒸馏水为空白对照在波长650 nm处测糊精的透光率。
1.9 数据处理分析
各组实验数据均为3次重复测定之后的平均值,并用Origin 8.0作图。
2 结果与分析
2.1 酶解淀粉的水解率
如图1所示,随着酶解时间的延长,淀粉水解率增加,且在水解前期曲线快速上升,然后上升速度变缓并达到最高水解率56.7%。这是因为,β-淀粉酶从淀粉分子的非还原性末端断开相隔的α-1,4糖苷键,水解前期酶活力较大,随着时间的不断增加,水解淀粉的速度较快,能够水解出更多的麦芽糖,因此水解率随之增加。随着时间的继续增加,底物减少,且生成的高浓度麦芽糖会抑制β-淀粉酶的水解作用,因此水解速率降低,直至达到淀粉水解的极限。于轩[8]用β-淀粉酶对马铃薯淀粉、豌豆淀粉、普通玉米淀粉、木薯淀粉、大米淀粉、蜡质玉米淀粉等不同来源的淀粉进行水解,并测定它们的水解率,与本实验有相同的趋势。

图1 酶解时间和水解率的关系Fig.1 Effect of the enzymatic hydrolysis time on hydrolysis rate
2.2 淀粉的颗粒形态观察
利用扫描电子显微镜对淀粉样品的形貌进行研究分析,考察蜡质大米淀粉在酶解前后淀粉颗粒的表面微观结构的变化情况,结果如图2所示。蜡质大米淀粉呈多角形,经酶解处理后,形状和颗粒大小都发生了显著变化,不再具有原淀粉的颗粒结构,均呈现出不规则的碎片状,主要原因有2个,制备糊精时是先将淀粉在95℃高温糊化,破坏了淀粉的完整结构;β-淀粉酶的水解作用,切断了支链淀粉的侧链部分,且不同的水解程度,切断的程度也不相同,水解程度越大碎片越多。

图2 蜡质大米原淀粉及酶处理淀粉的扫描电镜图片Fig.2 Scanning electron micrographs of native and β-amylase treated starches
2.3 淀粉样品的碘吸附曲线
碘液与淀粉显色原理是碘分子可以钻入支链淀粉螺旋空隙当中,并借助范德华力与直链淀粉联系在一起,从而形成络合物。这种络合物能比较均匀地吸收除蓝光以外的其他可见光,从而使淀粉变为深蓝色,并且最大峰出现的波长越小,淀粉的链越短,所以淀粉-碘吸附曲线可以在一定程度上反映出淀粉的内部链结构[9]。
从图3可以看出,与原淀粉相比,经过酶解的样品与碘的吸附能力(吸光度值)均有不同的降低,且最大吸收波长向低值偏移。酶解样品的吸附曲线变化基本一致,都在500~550 nm出现了最大吸收峰。原淀粉、β-1、β-3和β-7样品的最大吸收波长均向左偏移,β-15与β-20的最大吸收波长接近,可能是水解到15 h时基本达到水解极限,继续水解对样品的影响不大。Xinyu[10]对β-淀粉酶水解的淀粉进行碘吸附,得出淀粉链长的缩短会减弱碘分子的吸附能力的结论,解释了随着水解时间的增加,淀粉样品的吸光度值越低。王琳[11]等认为最大波长偏移与淀粉的平均链长有关系,平均链长越短,最大波长向低值偏移。

图3 淀粉-碘吸附结合物吸收曲线Fig.3 Wavelength scanning profiles of starch samples binding iodine
2.4 相对分子质量分布
图7显示了GPC法测定不同水解程度的蜡质大米糊精酶样品的分子质量分布,都表现为高低分子质量峰的双峰分布分别指定为峰1和峰2。酶解后的产物,峰1代表的大分子部分的含量逐渐减小,峰2代表的小分子部分的逐渐增多。蔡晶[12]用酸法水解玉米淀粉得出这样的结论,随着酸解时间的增加,高分子部分越少,低分子部分增加,分子质量分布也逐渐变窄。

图4 酶处理淀粉的相对分子质量分布Fig.4 Relative molecular mass distribution of β-amylase treated starches
酶解初始阶段,酶与大量支链淀粉非还原尾端结合,作用点多,因此分子量降低的较快;随着酶解时间的增加,当作用位点接近淀粉支叉位置的α-1,6键时,酶解缓慢。由图7所示,水解时间从1~20 h,分子质量降低的速率变缓,最后酶解趋于稳定,尤其是水解15 h和水解20 h时两曲线趋于重合。
2.5 淀粉溶解度和膨胀度的测定
从图5可以看出,随着温度的增加,蜡质大米淀粉和不同水解程度的糊精溶解度逐渐增加;在同一个温度下,随着水解程度的增加,糊精的溶解度增加,糊精的溶解度明显高于蜡质大米原淀粉。淀粉颗粒由于具有双螺旋结晶结构,难以在冷水中分散溶解;在热水中淀粉颗粒会发生膨胀和糊化,但由于淀粉分子量较大,在离心时容易发生沉淀,因此其溶解度较低[13]。而糊精是蜡质大米淀粉糊化后经淀粉酶降解的产物,糊化过程破坏了淀粉的结晶结构,加上淀粉酶的水解作用,淀粉分子质量降低,所得的糊精具有高度的枝杈结构,亲水的能力加强,所以其溶解度较高。

图5 原淀粉和酶处理淀粉的溶解度Fig.5 Solubility of native and β-amylase treated starches
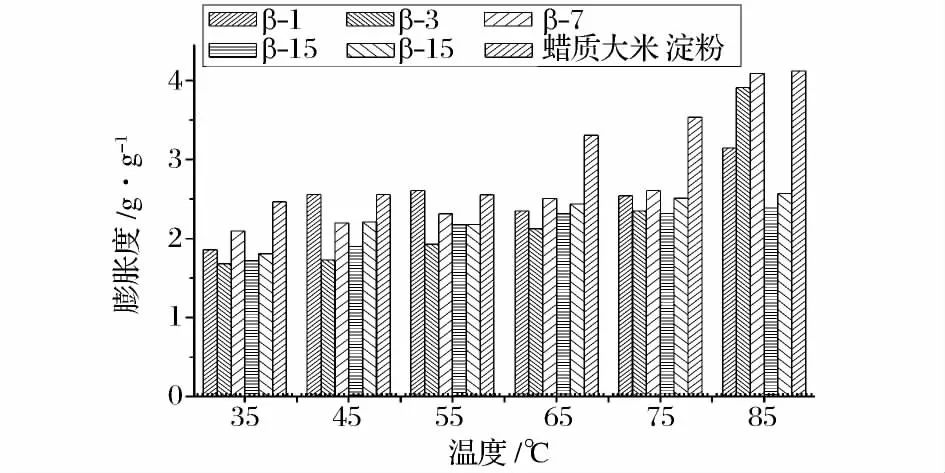
图6 原淀粉和酶处理淀粉的膨胀度Fig.6 Swelling power of native and β-amylase treated starches
由图6可知随着温度的增加蜡质大米淀粉和不同水解程度的糊精膨胀度有增高趋势;在同一个温度下,糊精的膨胀度低于蜡质大米原淀粉。随温度升高,淀粉颗粒膨胀变大吸收的水分逐渐增加直至完全破裂。糊精的颗粒结构已经被破坏吸收水分能力相对降低。
2.6 透明度
透明度是淀粉糊化后所表现出的重要外在特征之一,对淀粉类产品的外观及用途有直接的影响[14]。透明度的大小反映了淀粉颗粒在水中的溶胀、分散程度,分散程度越大越均匀,光线透过量就越大,透明度就越大;透明度的大小还可以反映出淀粉的凝沉性质,淀粉的凝沉性越大,则淀粉在水中的分散程度就越低,透明度就越小。本实验制备的酶解淀粉与原淀粉分别分散于蒸馏水中的透明度测定结果,如图7所示。
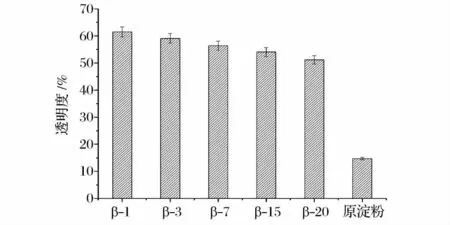
图7 蜡质大米原淀粉和酶处理淀粉的透明度Fig.7 The transparency of native and β-amylase treated starch
如图7可知,酶处理后的淀粉样品的透明度均高于原淀粉,蜡质大米淀粉的透明度为14.7%,酶解后最大透明度为61.5%,且水解程度越大透明度越低。是因为原淀粉分子质量大糊化后易凝沉分散程度低且不均匀,因此原淀粉的透明度最低;邵兰兰等[5]认为原淀粉糊化后易回生形成凝胶束,光线照入糊液时有反射和散射现象产生,因此原淀粉的透明度低;制备的玉米极限精糊由于聚合度低,凝沉性弱,因此透明度高。本实验中水解程度越大的糊精透明度越低,可能是因为糊化后糊精分子发生缔合,糊精分子越小越容易发生缔合阻碍光线穿过糊液,因此透明度随着水解程度增大而降低。
3 结论
以蜡质大米淀粉为原料,对不同酶解时间所得样品的相关性质进行研究。当β-淀粉酶加酶量为65 U/g,反应时间为20 h时,水解率达到最大为56.7%;扫描电镜结果显示酶解后的样品变成不规则碎片不再具有颗粒结构;随着酶解程度的增大,淀粉-碘吸附物的最大吸收峰位置的偏移增大,直链淀粉含量降低均低于原淀粉;水解时间的增加,糊精的相对分子质量逐渐减少;随着温度的升高,原淀粉的溶解度和膨胀度均增加,处理后的样品溶解度高于原淀粉,膨胀度低于原淀粉,同一温度下,随着酶解率的增加溶解度逐渐增加。随着酶解率的增加,样品的透明度下降但远高于原淀粉的透明度。经过β-淀粉酶处理的蜡质大米淀粉在颗粒形貌、淀粉-碘吸附结合物最大吸收峰位置的变化、分子质量变化、溶解度、膨胀度和透明度上都有其特殊的性质,为糊精的应用提供了理论基础。
[1]张力田.变性淀粉[M].广州:华南理工大学出版社,1992:1-6.
[2]Paul T Callaghan,John Lelievre,James A Lewis.A comparison of the size and shape of β-limit dextrin and amylopectin using pulsed field-gradient nuclear magnetic resonance and analytical ultracentrifugation [J].Carbohydrate Research,1987,162(1):33-40.
[3]赵凯.淀粉非化学改性技术[M].北京:化学工业出版社,2009:68-69.
[4]赵燕,李建科,霍树春,等.酶法制备的玉米全淀粉β-极限糊精性质初步研究[J].食品科学,2007,28(9):258-261.
[5]邵兰兰,赵燕,涂勇刚,等.酶法制备的蜡质玉米淀粉β-限制糊精的性质[J].食品科学,2011,32(19):28-32.
[6]Ammeraal R,Friedman R.Beta-limit Dextrin from Dull Waxy Starch:US,5482560[P].1996.
[7]Van der Veen J,Te Wierik GH,Van der Wal L,et al.Controlled release of theophylline monohydrate from amylodextrin tablets:In vitro observations[J].Pharmaceutical Research,1994,11(4):499-502.
[8]于轩.不同来源淀粉的分子结构对其酶解性能影响的研究[D].无锡:江南大学,2013.
[9]Waduge R N,Xu S,Seetharaman K.Iodine absorption properties and its effection the crystallinity of developing wheat starch granules[J].Carbohydrate Polymers,2010,82(3):786-794.
[10]SHEN X Y.ISBN:9781124530000,2011,Amylopectin Fine Structure:Mechanism of the Long Chain Function[S].Purdue University,2010.
[11]高群玉,王琳.双酶协同制备玉米淀粉慢消化淀粉及其性质研究[J].现代食品科技,2013,29(10):2 425-2 430.
[12]蔡晶.高温酸法水解制备低分子量淀粉[J].亚太传统医药,2010,6(10):42-44.
[13]Jasmien W,Sara V G,Julie K W,et al.Pasting properties of blends of potato,rice and maize starches[J].Food Hydrocolloids,2014,41:298-308.
[14]杜先锋,许时缨,王璋.淀粉糊的透明度及其影响因素的研究[J].农业工程学报,2002,18(1):129-131.

