耐高糖酵母的筛选鉴定及其产多元醇分析*
齐向辉,王旭,林静,朱婧斐,罗艳,孙文敬
(江苏大学食品与生物工程学院,江苏镇江,212013)
耐高渗酵母是一类能够在自然或人为高渗透压环境下正常生长繁殖的微生物,分为耐糖酵母和耐盐酵母。近年来,微生物相关研究领域已逐渐转向极端微生物,其中耐高糖酵母已经引起了人们的热切关注。起初,耐高糖酵母的存在仅仅被作为引起高糖食品腐败的标志,后来Spencer[1]等人发现:在好氧条件下,耐高渗酵母发酵糖类物质能够产生多种多元醇。随后,各国研究者开始了对耐高糖酵母的深入研究,主要包括该类菌的好氧发酵和代谢机理。较不耐高渗酵母而言,耐高渗酵母具有活跃的HMP代谢途径,能够通过胞内累积相容性物质来适应不同程度的高渗环境[2]。研究发现,酵母的耐高渗生长能力与其产多元醇的类别之间存在一定的关联[3],据此可以依据所需目标发酵产物设置不同的发酵环境。另外,在食品工业和生物工程方面,耐高渗酵母的应用愈加广泛:(1)在高渗环境中,耐高渗酵母能够产生D-阿拉伯糖醇,或赤藓糖醇[4]等功能性多元醇物质[5]。Onishi[6]等人报道了从葡萄糖到木糖醇的三步微生物发酵法,其中D-阿拉伯糖醇是关键中间产物,并提出以葡萄糖为发酵底物生产 D-阿拉伯醇是可行的。自此,生物发酵法生产 D-阿拉伯醇受到国内外学者的广泛关注,并进行了诸多相关研究。(2)由于很多种属的酵母都能在高渗环境下胞内累积甘油,所以耐高渗酵母也可以作为生产甘油的优良工程菌[7]。(3)选择耐高渗酵母作为生产菌株,可以很好的抑制生产过程中的杂菌污染。(4)固定化耐高渗酵母可以生产乙醇,目前利用此法生产乙醇的效率已经有了很大的提高。菌种是发酵工程的灵魂,鉴于耐高渗酵母所产多元醇多数为功能性糖醇,也可将此类酵母称为功能性微生物。
本文通过对采自天然高糖环境的样品进行高糖(40%)富集培养,从中筛选到了99株耐高糖酵母菌株,并对随机挑选的40株(源自不同花蜜样品)实验菌株发酵葡萄糖产生多元醇的种类进行了初步分析,其中分离到的产D-阿拉伯糖醇和甘油的酵母居多。最后,根据形态学观察、生理生化实验及ITS序列测定对不同典型菌落的酵母菌株进行了鉴定。
1 材料与方法
1.1 材料
天然蜂蜜样品,样品A:枣花蜜;样品B:油菜花蜜;样品C:荆条花蜜;样品D:野百花蜜。其中样品A,B,C采自江苏省镇江市养蜂园。样品D采自湖北房县荒山上的天然蜂巢。
富集筛选培养基(g/L):400葡萄糖,10酵母粉,10胰蛋白胨(平板培养基另加20琼脂粉);保藏培养基(g/L):50葡萄糖,10酵母粉,10胰蛋白胨,20琼脂粉;YPD培养基(g/L):10酵母粉,10胰蛋白胨,20葡萄糖;发酵培养基(g/L):200葡萄糖,10酵母粉,10胰蛋白胨。
1.2 方法
1.2.1 耐高渗酵母的分离与筛选
将不同蜂蜜样品分别称取1.0 g,加入到含有20 mL富集培养基的250 mL三角瓶中,涡旋均匀后,30℃,200 r/min,摇瓶培养3 d。将富集培养物梯度稀释后,分别吸取200 μL涂布到含富集培养基的培养皿中,于30℃培养箱中培养,挑选生长良好的单菌落划线分离纯化,斜面保存于4℃冰箱。
1.2.2 耐高渗酵母产多元醇的种类分析
各自挑选10株源自不同花蜜样品的耐高糖酵母,将其分别接种于含有20 mL发酵培养基的250 mL三角瓶中,30℃,200 r/min,摇瓶培养3 d。通过薄层层析法对发酵液中的多元醇产物进行初步定性和粗定量检测。根据葡萄糖和D-阿拉伯糖醇的Rf值和分离效果,分析普通硅胶玻璃板、铝制硅胶板和微晶纤维素板的层析情况,优化并确认层析板规格和层析条件。样品处理方法如下:取不同菌株的发酵液各1 mL,10 000 r/min离心10 min,取1 μL上清点样于微晶纤维素板上,层析时间为80 min,重复层析3~4次,层析结束后自然晾干,层析图谱的显色采用饱和硝酸银-丙酮和氢氧化钠-乙醇溶液,具体可参照文献[8]。
1.2.3 酵母菌株的鉴定
1.2.3.1 菌落形态及生理生化特征
从筛选到的菌株中挑选不同形态的典型单菌落,分别转接于YPD液体培养基中,摇瓶培养,在40倍显微镜下观察不同时期菌体细胞的形态特征。实验菌株的菌落形态及生理生化特征鉴定方法参照文献[9]。
1.2.3.2 耐高渗酵母的分子特征
挑取选出的不同形态的典型单菌落于1 mL无菌水中,采用反复冻融法使细胞破壁,从而提取酵母菌的DNA,并以此作为PCR模板。采用真菌的通用引物,ITS1:5’-TCCGTAGGTGAACCTGCGG-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’。PCR 程序条件为:95℃预变性5 min,94℃变性1 min,54℃退火1 min,72℃延伸40s,反应32个循环,最后72℃延伸10 min。PCR扩增产物经琼脂糖凝胶电泳检测后送测,测序工作由南京金斯瑞生物有限公司完成。在NCBI核酸序列数据库中通过BLAST进行同源序列对比,选择相似性在98%以上酵母菌菌株的相关序列进行分析,利用MEGA 4.1软件,采用 Neighbor-Joining法进行分子系统学分析,构建系统发育树,分析所筛菌株与已知酵母菌的亲缘关系。
1.2.4 气相色谱法测定D-阿拉伯糖醇产量
根据层析图谱分析,初步筛选葡萄糖残量低且D-阿拉伯糖醇产量相对较高的菌株,将其转接至发酵培养基中进行摇瓶培养,培养条件为:30℃,200 r/min,摇瓶振荡培养96 h。随后将不同菌株的发酵液离心取上清分别倾倒入培养皿中置于-80℃冰箱冷冻3 h,再置于冷冻干燥机冷冻48 h,之后对发酵液中的固形物进行糖精乙酸酯衍生化,具体方法如下:称取菌株的发酵固形物100.0 mg于不同的Ep管(2 mL)中,各自加入10.0 mg盐酸羟胺和1.0 mL吡啶,90℃水浴反应30 min,取出冷却至室温,再各自加入1.0 mL乙酸酐,90℃水浴反应30 min,取出冷却至室温,再经氯仿萃取出有机相,待进样。选用Sigma公司的D-阿拉伯糖醇作为标样,梯度(10.0~60.0 mg)稀释测样,绘制标准曲线,其糖精乙酸酯衍生物的制备方法同上。气相色谱分析条件:色谱柱Agilent HP-5(30 m×0.25 mm ×1 μm);柱温:起始温度180 ℃,保持30 min,10℃/min升温至280℃,保持2 min;进样口:200℃;检测器:FID,温度:250℃;载气:高纯氮气,流速20 mL/min;氢气流速30 mL/min,空气流速300 mL/min,分流比:50∶1;进样量1 μL。
2 结果
2.1 耐高渗酵母的分离筛选
经过葡萄糖含量为400 g/L的高糖培养基富集培养,从不同来源的天然蜂蜜样品中分离出99株生长良好的耐高渗酵母菌株。经形态学初步鉴定,发现这些菌株可归为3种菌落形态,菌落一较大,偏黄,半透明,光滑湿润,色泽均一;菌落二较小,凸起,奶油色,不透明,光滑;菌落三为白色,不光滑,表面略有褶皱。其中,来自枣花蜜、油菜花蜜和荆条花蜜的酵母菌落形态单一,而来自野百花蜜中的酵母菌落呈现以上3种形态,具有一定的酵母多样性。
2.2 耐高渗酵母发酵葡萄糖产多元醇的初步分析
在层析板规格的选择方面,实验结果表明:微晶纤维素板对于多元醇类物质具有最好的分离效果,确立了一种以微晶纤维素板为层析介质,可用于对发酵液成分进行初步定性和粗定量检测分析的薄层层析方法。在层析展开剂选择及优化方面,经过多种羟基类有机溶剂的不同比例配比,结合分离度和Rf值情况,试验最终选用展开剂及其配比为:乙酸乙酯∶吡啶∶冰乙酸∶水 =16∶10∶2∶3,重复层析 3~4 次,层析效果比较好(部分层析图谱见图1)。在确定了层析条件的基础上,从分离得到的99株源自不同花蜜样品的菌株中随机挑选40株(具有3种不同菌落形态)耐高渗酵母,进行摇瓶实验。采用优化的层析条件对发酵液进行层析试验和图谱分析。
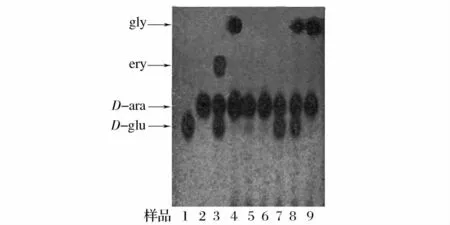
图1 发酵液中多元醇的TLC结果(部分图谱)Fig.1 The analysis result of fermentation broth by TLC
由图1可以明显看到,葡萄糖、D-阿拉伯糖醇、赤藓糖醇和甘油的迁移率Rf值相差明显,在此层析条件下,可将底物葡萄糖和产物D-阿拉伯糖醇两者分离开来,该层析方法完全可以用于D-阿拉伯糖醇产生菌初筛过程中糖醇类产物的定性检测。自不同样品中分离的耐高渗酵母产多元醇的结果归纳如表1所示。
由表1可知,源自花蜜样品的酵母属产醇类别比较单一。在所分离到的耐高渗酵母中,产甘油的菌株来自不同花蜜样品;产赤藓糖醇的菌株大多数来自野百花蜜样品;产D-阿拉伯糖醇的菌株大部分是自荆条花蜜样品中分离而来。

表1 来自不同花蜜样品的耐高渗酵母摇瓶发酵产多元醇的情况Table 1 The variety of polyol in the fermentation broth by flask-shaking of 40 strains isolated from different samples
2.3 菌株的鉴定
2.3.1 酵母菌的形态学和生理生化特征
由于筛选到的产多元醇耐高渗酵母在平板上明显分布3种形态的菌落,并结合TLC筛选的图谱情况,各挑选1个典型特征的酵母单菌落,将其命名为JM-1,JM-2,JM-3。所选3株酵母菌落和细胞主要形态特征如图2和图3所示,发酵糖类和同化碳氮源的鉴定结果如表2所示。由这些图表可知,菌株JM-1,JM-2,JM-3在G1固体培养基上,30℃培养3 d后菌落特征虽然各有差异,但它们均有酵母菌的一些共有特征,如:菌落均为圆形,边缘整齐,中间凸起,较黏稠,易挑起,色泽均一;借助光学显微镜进一步观察菌株JM-1,JM-2,JM-3在G1液体培养基中生长的细胞特征发现:菌体细胞呈圆形或椭圆形,出芽生殖,生长到稳定期时出现类似于液泡组织,体积变大,具有典型的酵母菌细胞特征。

图2 平板上3种不同的典型菌落形态Fig.2 Three typical colony morphology of strain JM-1,JM-2,JM-3
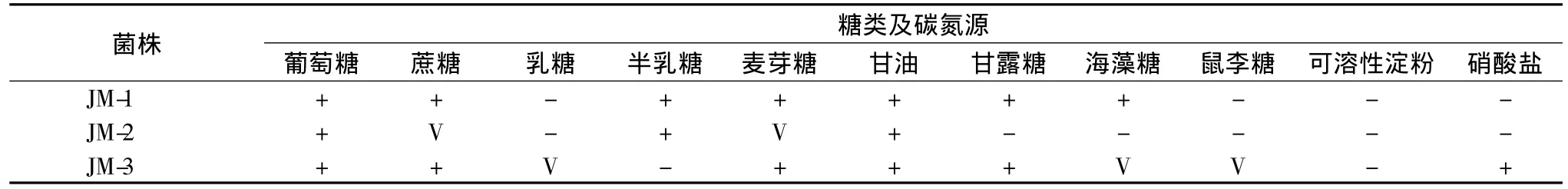
表2 发酵糖类及同化碳氮源等生理生化鉴定结果Table 2 The results of carbohydrate fermentation and assimilation carbon and nitrogen source

图3 菌株JM-1,JM-2,JM-3在G1液体培养基中摇床培养16h的细胞形态Fig.3 The cellular morphology of strain JM-1,JM-2,JM-3
2.3.2 耐高渗酵母的分子生物学特征鉴定
真菌ITS区域核酸序列的相似性,已经成为公认的确定酵母菌分类地位的重要分子生物学依据。本实验以反复冻融法提取的酵母DNA为模板,以真菌通用引物ITS1和ITS4为引物,通过PCR扩增出的片段经琼脂糖凝胶电泳,结果如图4所示。
克隆所得到的菌株JM-1,JM-2,JM-3的ITS序列长度分别约为500、700、350bp,测序后确定长度分别为510,683,365bp,与电泳图谱一致,试验结果可信。经NCBI中BLAST序列比对,根据同源序列搜索结果,选择相似性在98%以上的酵母菌菌株的相关序列进行分析。得到结果为:JM-1号菌株与Lodderomyces elongisporus的遗传距离最近,且核苷酸序列相似性高达 100%,JM-2号菌株与 Zygosaccharomyces rouxii的遗传距离最近,核苷酸序列相似性高达100%,JM-3号菌株与Starmerella sp.序列相似性达到99%。菌株JM-1,JM-2,JM-3的系统发育树构建如图5所示,可以清楚显示出实验菌株与NCBI中一些参考酵母菌株的亲缘关系。综合菌落外观形态,细胞形态,生理生化实验 (与文献[9]中相应酵母菌属的描述一致)及其分子生物学特征均表明,测序菌株JM-1,JM-2,JM-3的分类地位分别属于Lodde1romyces elongisporus,Zygosaccharomyces rouxii,Starmerella sp.。

图4 典型酵母菌株JM-1,JM-2,JM-3的 PCR产物Fig.4 PCR products of three strains

图5 菌株JM-1,JM-2,JM-3同源树的构建Fig.5 Phylogenetic tree of strain JM-1,strain JM-2 and strain JM-3
2.4 产D-阿拉伯糖醇菌株产量的测定
根据层析图谱结果,本实验筛选出1株葡萄糖残量低且D-阿拉伯糖醇产率相对较高的菌株Z.rouxii JM-12,将该菌株作为发酵出发菌株,利用气相色谱法对D-阿拉伯糖醇产量进行初步定量。以D-阿拉伯糖醇标品进样量(mg)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,得到回归方程:y=115 584x+96.877,R2=0.999 3,表明 D-阿拉伯糖醇在 10~60 mg范围内与峰面积的比值呈良好的线性关系。并且精密度试验结果RSD=1.59%(n=3),重复性试验结果RSD=0.63%(n=3),表明所用仪器精密度和重现性均良好。
图6-A给出了D-阿拉伯糖醇和D-葡萄糖的混合标品的糖精乙酸酯衍生物的色谱图,其中D-阿拉伯糖醇的出峰时间为4.236 min,D-葡萄糖的出峰时间为5.124 min。菌株Z.rouxii JM-12的发酵液样品经过处理在同样的色谱分析条件下进样,得到的图谱如图6-B所示,根据相同的保留时间可知:发酵产物D-阿拉伯糖醇衍生物的峰面积为4 191.3,带入回归方程可得到D-阿拉伯糖醇的进样量为35.4 mg,经换算后可得菌株Z.rouxii JM-12转化200 g/L D-葡萄糖得到D-阿拉伯糖醇的产量为(61.33+0.49)g/L,即0.31 g/g D-葡萄糖。
3 讨论与结论
本试验建立了一种简单的分离耐高渗酵母的方法,即直接从天然高糖环境取样,经高糖富集培养,涂布高糖培养基筛选分离出多株耐高渗酵母,表现为3种菌落形态特征,经ITS序列鉴定,结果分别属于Lodderomyces elongisporus,Zygosaccharomyces rouxii,Starmerella sp.。有研究表明[10],真菌的 ITS 序列在研究关系相近的属间和种间的区别中十分有价值,如今的真菌系统发育和分类方法已经普遍以ITS序列间的差异为理论基础,采用多聚酶链式反应(PCR)技术实现,同时,对ITS序列进行的深入分析对于相关分子生物学的发展起到一定的推动作用。

图6 气相色谱图Fig.6 Result of gas chromatography
通过实验菌株发酵葡萄糖的试验,得到多株产D-阿拉伯糖醇的酵母。在此试验过程中,大多数发酵液底物和羟基类产物比较容易分离,然而葡萄糖和D-阿拉伯糖醇的结构和物理特性比较相似,较难分离开来,所以本实验以葡萄糖和D-阿拉伯糖醇的Rf值之比作为分离效果的参考标准,根据二者的物理相似相容性,设计了多种羟基类有机溶剂的不同比例配比的组合层析剂,并最终确立了一种简单有效的可初步用于筛选D-阿拉伯糖醇产生菌的定性和粗定量检测的层析方法。
鉴于D-阿拉伯糖醇重要的应用价值和需求潜力以及当前制备的高成本,寻求发酵性能优良的生产菌株是研究高效工业生产的前提。Badal[11]等人已经报道过鲁氏接合酵母属产D-阿拉伯糖醇的相关研究,并且D-拉伯糖醇的产率能够达到0.48 g/g葡萄糖,深化了从自然高糖环境筛选产D-阿拉伯糖醇耐高渗酵母的意义。本研究也筛选出了1株性能优良的菌株 Z.rouxii JM-12,其 D-阿拉伯糖醇产量可达61.3 g/L,即0.31 g/g葡萄糖,具有一定的开发应用价值。据此,作者将通过进一步筛选和优化发酵条件,希望得到1株高产D-阿拉伯糖醇的耐高渗酵母,为实现发酵法生产D-阿拉伯糖醇的技术路线奠定基础。另外,作者将继续研究产不同类别糖醇的耐高渗酵母在高渗环境下的生长能力的差异和积累某种多元醇的抗压能力的相关度,从而进一步解释酵母的耐高渗代谢机制。
[1]Spencer J F T,Sallans H R.Production of polyhydric alcohols by osmophilic yeasts[J].Canadian Journal of Microbiology,1956,2(2):72-79.
[2]Moran J W,Witter J R.Effect of sugars on D-arabitol production and glucose metabolism in Sacch-aromyces rouxii[J].J Bacteriol,1979,138(3):823 -831.
[3]Cortassa S,Aon M A.Flux of carbon phosphorylation and redox intermediates during growth of Saccharomyces cerevisiae on different carbon sources[J].Biotechnol Bioeng,1995,47(2):193-208.
[4]Ruth Sánchez-Fresneda,Juan-Carlos Argüelles.Specific stress-induced storage of trehalose,glycerol and D-arabitol in response to oxidative and osmotic stress in Candida albicans[J].Biochemical and Biophysical Research Communications,2013,430(4):1 334–1 339.
[5]Hajny Gloria.D-arabitol production by Endomycopsis chodati[J].Applied Microbiolog.1964,12(1):87 -92.
[6]Onishi H,Suzuki T.Microbial production of xylitol from glucose[J].Applied Microbiology,1969,18(6):1 031-1 035.
[7]徐虹,周基化,欧阳平凯.赤藓糖醇产生菌的筛选[J].南京化工大学学报,1995,17(sup.):14 -17.
[8]Trevelyan W E,P rocter D P.Detection of sugars on paper chromatograms[J].Nature,1950,166(4219):444 -445.
[9]Barnett J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[10]唐玲,闫云君.酵母的分子生物学鉴定[J].生物技术通报,2008,5(5):84 -87.
[11]Badal C S,Yoshikiyo S,Michael A C.Production of D-arabitol by a newly isolated Zygosaccharomyces rouxii[J].Microbiol Biotechnol,2007,34(7):519 -523.

