X射线衍射法在天然气水合物研究中的应用
刘昌岭,孟庆国
(国土资源部天然气水合物重点实验室,青岛海洋地质研究所,山东青岛266071)
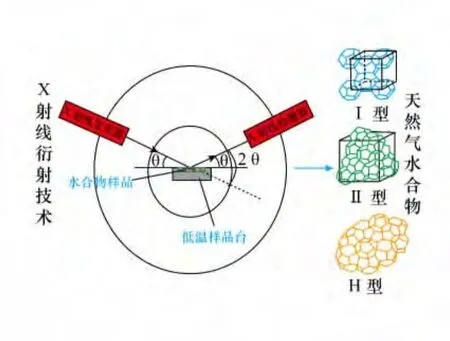
天然气水合物广泛地存在于海底300 m水深以下及陆地冻土区,据估计其储量为全球化石燃料的2倍[1],具有重要的战略意义和巨大的经济价值。天然气水合物的性质与其赋存环境和形成条件有关,沉积物的组成及其孔隙的大小对水合物的生成与累积起着十分关键的作用,而环境温度、压力及流体组分的变化则可导致水合物组成的异质现象以及水合物结构的变化[2]。随着人们对天然气水合物研究的不断深入,各种先进的实验分析技术(如核磁共振、拉曼光谱及X射线衍射等)相继被应用于这一领域[3-6]。天然气水合物是一种非化学计量的笼型水合物,它包含不同的笼型结构,可以容纳不同的客体分子,这些分子分布在大小不同的孔穴中。天然气水合物的微观结构及其晶胞参数等问题是天然气水合物研究的基础科学问题。因此,研究笼型结构及其变化规律,对天然气水合物形成机理、微观动力学等方面的研究具有重要意义。
X射线衍射(XRD)是20世纪发展并逐步完善的新技术,主要包括粉末多晶衍射技术和单晶衍射技术,可进行物相分析(单一物相或混合物相的鉴定或验证)和晶体结构分析(空间群、晶胞参数等)。晶体产生X衍射现象是由于晶体具有周期结构,使入射到晶体上的电磁辐射的方向和强度发生了改变。衍射的方向和强度取决于晶体的对称、空间点阵的类型、晶胞参数和晶胞中所有原子的分布。因此,通过研究衍射数据可以确定晶体的对称、空间点阵的类型和晶胞参数,并进一步确定晶体结构。目前,XRD技术已成为研究晶体物质和某些非晶态物质微观结构的有效方法,在化学、物理学、生物学、材料学、冶金学、矿物学、医药学等方面发挥着重要的作用。
天然气水合物具有晶体结构,经X光照射能产生衍射效应,因此,XRD技术已被广泛应用到天然气水合物研究中。由于水合物自身的不稳定性,其测试过程必须在常压低温(最低温度77 K)或高压下进行。一般来说,对于天然的或人工合成的水合物样品,可以在常压低温条件下进行测量,包括测定其水合物的结构与组成[7-17]、水分子形成的晶格中氧原子位置[18-20]及不同结构水合物的热膨胀系数[7,12,21-24]等。而在特定的实验条件下,如采用特制的小型高压反应釜进行高压环境中的XRD原位观测,则可以开展天然气水合物生成分解的动力学研究[25-32]。因此,XRD技术不仅能获取天然气水合物的结构类型及晶格参数等重要信息,还能观测天然气水合物生成分解的微观动力学过程。目前,国外在水合物研究中应用XRD技术已相对成熟,而国内尚未见报道。本文针对这种现状,对XRD技术在水合物研究中的应用进展进行综述,着重介绍其在水合物结构特征研究、生成/分解动力学过程原位观测及野外水合物样品鉴定方面的应用,为开展天然气水合物的相关研究提供借鉴。
1 天然气水合物基本结构特征
天然气水合物是一种由气体分子(包括烃类和CO2、H2S等非烃类气体)和水分子在低温高压环境下形成的一种形态似冰非化学计量的笼型水合物(图1),其中水分子通过氢键作用形成具有一定尺寸大小的孔穴,构成晶格主体,较小的气体分子作为客体被包容在孔穴中,气体分子和水之间的作用力为范德华力。
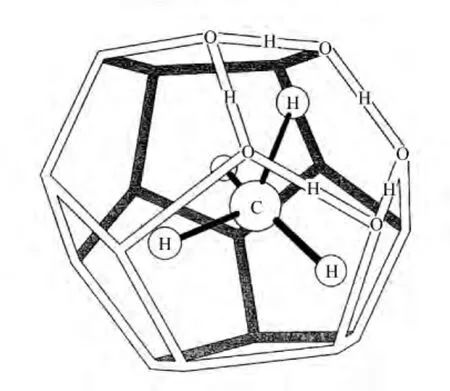
图1 天然气水合物晶体结构模型[33]Fig.1 The crystal structure model of natural gas hydrate[33]
天然气水合物晶体结构主要有三种:Ⅰ型(立方晶体结构)、Ⅱ型(菱形晶体结构)和H型(六方晶体结构)[33]。Ⅰ型和Ⅱ型结构水合物早在二十世纪五十年代就被发现[34-35],而 H型水合物直到1987年才被发现[36]。Ⅰ型结构水合物单位晶胞由2个十二面体(512)和6个十四面体(51262)组成,包含46个水分子,空间群为Pm3n。Ⅱ型结构水合物单位晶胞由6个512和8个51264组成,包含136个水分子,空间群为Fd3m。H型结构水合物单位晶胞由3个512、2个不规则的十二面体(435663)和1个二十面体(51268)组成,是一种二元水合物,即在稳定的H型结构水合物的大小孔穴中容纳两种客体分子,包含 34 个水分子,空间群为 P6/mmm[13,32]。每个孔穴内最多可包容一个客体分子[33],故Ⅰ型结构典型的分子式为:2[512]·6[51262]·46H2O,表示小孔穴中2个、大孔穴中6个客体分子。相似地,Ⅱ型结构分子式为:16[512]·8[51262]·136H2O;H 型结构分子式为:3[512]·2[435663]·8[51268]·34H2O。
生成何种结构类型的水合物,主要取决于客体分子的种类和分子大小,如 CH4、C2H6、CO2、H2S 等小分子生成Ⅰ型水合物,C3H8、C4H10等大分子以及N2、O2、Ar、Kr等小分子则生成Ⅱ型结构水合物。H型水合物不能由单一气体分子生成,而是需要大小不同的两种客体分子(如二甲基丁烷、甲基环己烷、甲基叔丁基醚等大分子与甲烷之类的小分子),其中大分子占据着51268孔穴,小分子占据着435663和512孔穴。图2给出了三种不同类型的水合物晶体结构与组成,其相应的晶体结构参数对照见表1。
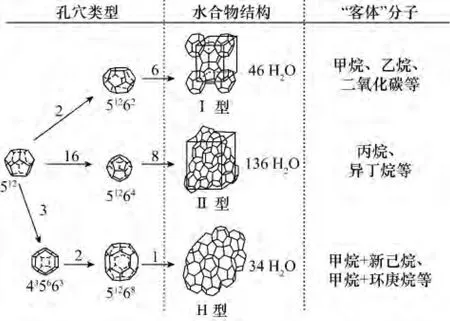
图2 三种类型水合物单体晶体结构图[33]Fig.2 The crystal structures of three common hydrate units[33]
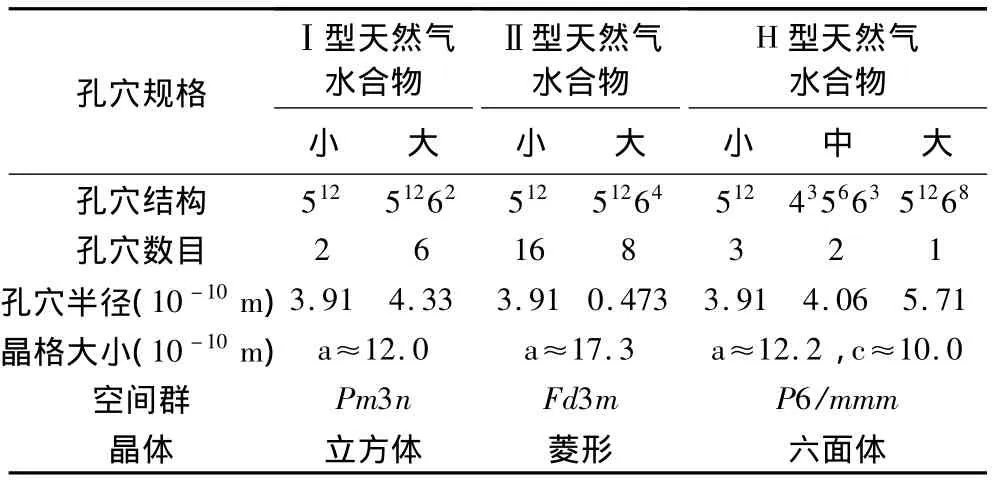
表1 三种类型天然气水合物晶体结构参数[33]Table 1 The crystal structure parameters of three types of gas hydrate [33]
2 X射线衍射研究天然气水合物晶体结构特征
2.1 水合物晶格参数测量
与常规的XRD测试不同,测量水合物样品时须保持一定的温度、压力条件,以确保测量过程中水合物能保持稳定。通常,常规XRD仪器需配置低温室,通过精确控制液氮或冷氮气的流量保持一定的低温,水合物样品需在液氮中研磨成粉末放在低温室样品台上,或者装入一个直径2 mm的石英毛细管中(壁厚 0.01 mm)[32,37],通过 X 光系统的测角器从θ=0°~50°转动扫描,可得到水合物的衍射谱图,通过计算可得到水合物晶体的晶格参数。
粉晶XRD简易高效,晶胞参数能准确测定,但得到的是宏观平均信息,而且细节结构尤其是轻原子不能准确确定。单晶XRD的精度高,能解析出晶体结构的完整信息,包括晶胞参数与原子坐标。对未知物而言,单晶XRD是最权威的结构鉴定手段。单晶XRD技术的关键是获得单晶样品,即结晶体内部的微粒在三维空间呈有规律、周期性地排列,或者说晶体的整体在三维方向上由同一空间格子构成,整个晶体中质点在空间的排列为长程有序。因此,如果能获得高质量的天然气水合物单晶晶体,则可采用单晶XRD技术进行测定,不仅可获得水合物晶体参数,还可得到水合物的绝对孔穴占有率,即可得到水合物的组成。Udachin等[7]采用重水(D2O)与CO2气体在173 K合成了CO2水合物单晶晶体,用单晶XRD技术测定了晶体结构与组成,高精度的衍射数据得到了前所未有的高质量水合物结构模型,确定了CO2分子可以占据水合物的大小两个孔穴,但在孔穴中的位置略有不同。计算了孔穴绝对占有率,得到晶体结构和分子组成为:CO2·6.20D2O。随后,他们又采用单晶 XRD技术对几个典型的Ⅰ型、Ⅱ型、H型水合物进行了系统研究,清楚确定了客体分子的位置,得到了不同类型的水合物的晶格结构、孔穴占有率及组成[10]。图3是由乙烷生成的Ⅰ型水合物,立方体晶体,空间群Pm3n,晶胞参数a=11.956×10-10m。乙烷分子在大小孔穴中都存在,但小孔穴的占有率很低(5%),观测到乙烷分子的C—C键和大孔穴赤道面的倾角为23°。图4为典型的H型水合物,由甲基环己烷与甲烷分子混合生成,前者在大孔穴而甲烷分子在两个小孔穴中。空间群P6/mmm,晶胞参数 a=12.217×10-10m,c=10.053×10-10m。甲烷在两个小孔穴的占有率可达80%。图5为典型的Ⅱ型水合物,由苯与氙分子生成的,分别占据晶胞的大、小孔穴。立方体晶体,空间群Fd3m,晶胞参数 a=17.363×10-10m。
近来Muromachi等[38]采用单晶衍射技术测试四丁基溴化膦(TBPB)半笼型水合物晶体结构,该晶体属斜方晶系,空间群为Pmma,晶胞参数a=21.065×10-10m,b=12.657×10-10m 和 c=11.992×10-10m,其化学式可表示为TBPB·38H2O。
2.2 水合物晶格参数的变化及影响因素研究
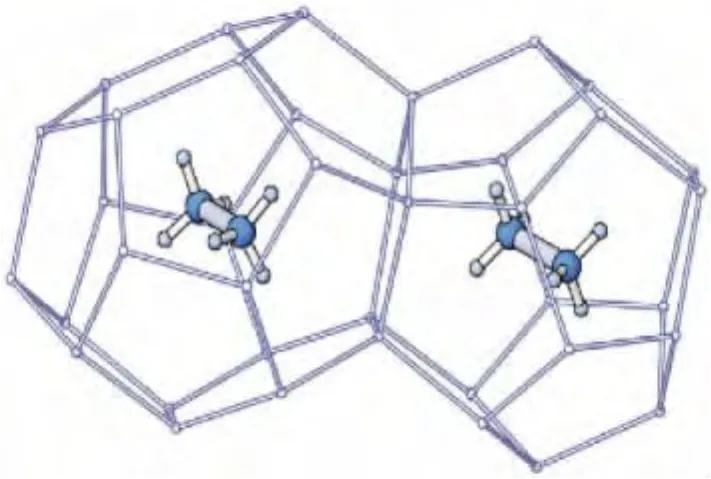
图3 立方结构的Ⅰ型水合物,乙烷分子在大小孔穴中[10]Fig.3 The cubic structureⅠhydrate with ethane molecules in the small and large cages[10]
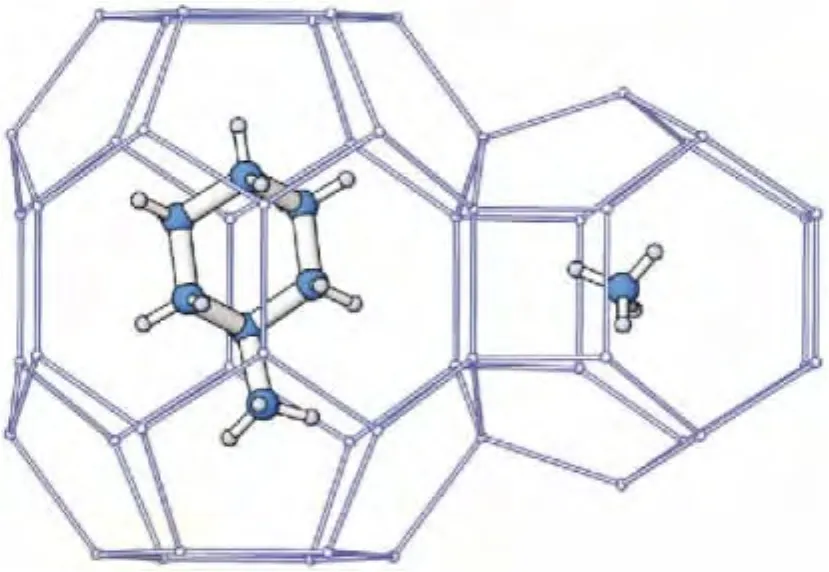
图4 H型水合物,甲基环己烷分子和甲烷分子分别在大孔穴和小孔穴中[10]Fig.4 The structure H hydrate with methylcyclohexane in the large cavity and methane in the small cavity[10]
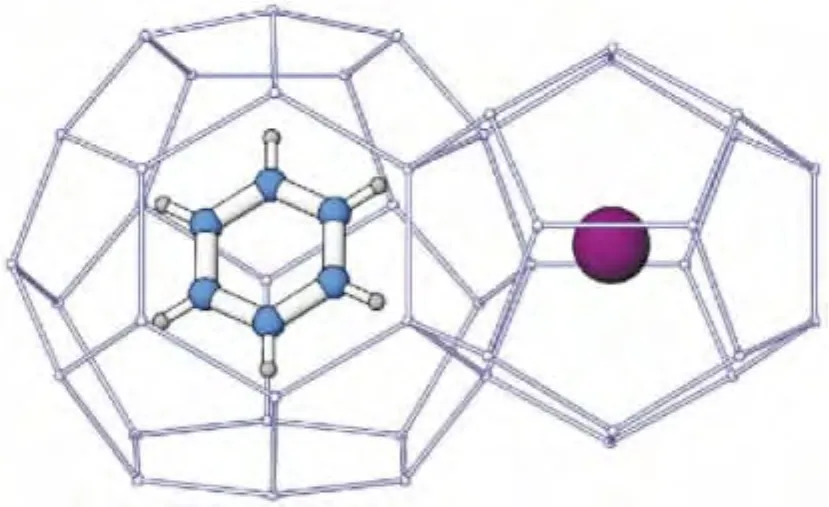
图5 立方结构的Ⅱ型水合物,苯分子在大孔穴而氙分子在小孔穴中[10]Fig.5 The cubic structureⅡhydrate with benzene molecule in the large cavity and the Xe atom in the small cavity[10]
天然气水合物的晶格参数对其生成条件较敏感,不是恒定不变的。一般来说,压力对晶格参数影响不大,在等温条件下晶格参数即使发生微小变化,也需要很大的压力变化[12]。而温度的变化可引起晶格参数的较大变化,即水合物晶体的晶格具有热膨胀性。Udachin等[7]采用单晶XRD技术测定了123~223 K之间CO2水合物晶格参数的变化,得到的热膨胀值与中子衍射一致,且符合一个多项式函数。掌握水合物的晶体结构及热膨胀特性对我们了解客体分子与水分子及客体分子之间的相互作用十分重要。例如,晶体的非谐性增大可引起较大的膨胀系数[21],甲烷水合物比六角冰有较大的热膨胀系数是由于甲烷分子与水分子之间的相互作用[39]。了解水合物的密度及热学性质可有助于很好地理解水合物储层的测井数据[40]。
由于不同结构类型的水合物晶体的孔穴中可填充不同大小、体积的客体分子,受孔穴大小的限制,这些客体分子无序转动及随机占有合适的孔穴,形成了非化学计量的笼型水合物。那么,单位晶体的大小与包容在晶体孔穴内的分子大小是否有关?或者说客体分子的大小与体积对晶格参数有何影响?这些成为了困扰研究人员多年的问题。尽管人们做了一些实验,但由于在不同的实验条件下得到的实验数据存在误差,没有统一的标准进行校正,难以得到直接的证据。Udachin等[10]在相同实验条件下对一系列的Ⅱ型水合物的单晶晶格参数进行了测定,结果见表2。从表2中可以看出,Ⅱ型水合物晶格参数与客体分子的直径(范德华直径Dmax)及体积大小都有一定的关系,总的趋势是晶格参数随着分子半径略有增加,但不完全一致,显然还有其他因素影响着水合物晶格参数,需要进一步研究。例如,在含有以氧原子作为客体分子的水合物中,水分子与其他水合物中水分子的动力学特性有明显的不同[41]。
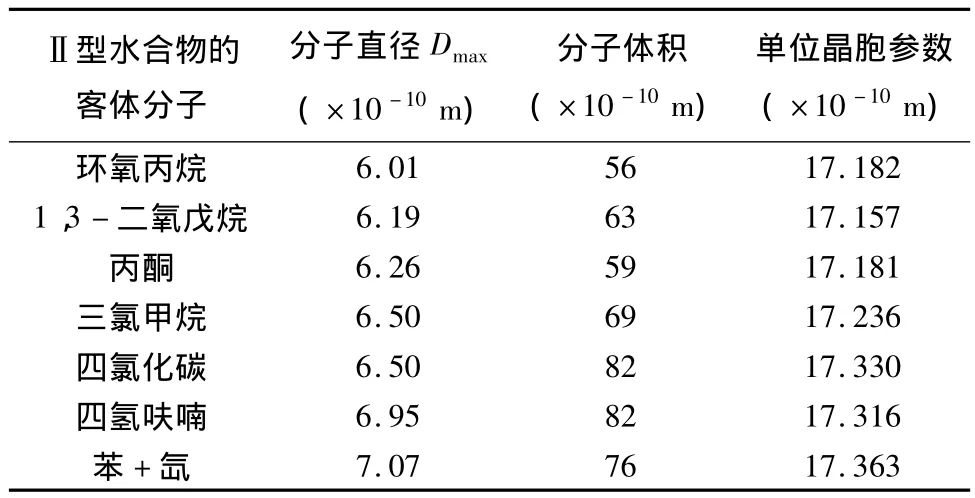
表2 客体分子的大小和体积及在-100℃形成的Ⅱ型水合物晶胞参数[10]Table 2 Sizes and volumes of the guests and the lattice parameters of structure Ⅱ hydrate at-100℃[10]
Takeya等[13]采用粉晶XRD研究了客体分子对H型水合物晶格常数和稳定性的影响,分析了含甲烷分子的各种H型水合物单位晶格参数及结合能的变化规律。结果表明,客体分子的体积增大可导致单位晶胞的增大,客体大分子的官能团及构型影响着H型水合物的稳定性,由于客体分子与水分子之间的相互作用,大孔穴(51268)与小孔穴(512)容易在a轴方向增加长度,而在c轴方向却基本不变。
另外,在以混合气为客体分子的水合物晶体中,由于动力学效应引起气体组分的变化也可导致晶格膨胀[23,42]。研究发现[12-13],不同的客体分子对晶格参数的影响不同,CH4-CO2水合物的晶格随混合气成分变化基本不发生膨胀,而CH4-C2H6水合物的晶格参数随着甲烷含量的变化而有所改变,对水合物形成的热力学条件有一定的影响。Shin等[43]近期采用粉晶XRD研究发现液相体系下NH4F水合物的晶格参数随NH4F浓度升高而变小。
2.3 混合气水合物的结构特征研究
笼型水合物的结构常根据客体分子的大小来进行分类,然而,对混合气生成的水合物结构类型的判断则没有依据。对混合气来说,生成的水合物的相平衡条件及结构都与气体的组成密切相关。例如,尽管CH4和C2H6分子都单独生成Ⅰ型水合物,但CH4-C2H6混合气则既可生成Ⅰ型,也可生成Ⅱ型水合物,或者生成两者的混合物[8,11-12,44-47];在低压下,甲烷与丙烷的混合气生成Ⅱ型水合物,丙烷分子只占据大孔穴,而甲烷分子既可占据大孔穴又可占据小孔穴。从分子大小来看,CO2(约5.1×10-10m)和C2H6(约5.5 ×10-10m)相差不大,但其对混合气水合物结构的影响却有明显不同,两者共存也可生成Ⅱ型水合物。故在纯体系中,客体分子的大小与生成何种类型水合物之间的关系在混合体系中并不适用[49-50]。
XRD技术由于可以准确地测量天然气水合物晶体的晶格参数从而判定水合物的结构类型,因此,在对由混合气生成的水合物结构类型的判别上XRD技术具有不可替代的作用。一方面,可将不同比例的混合气生成的水合物样品进行XRD测量,判定生成的水合物的结构类型[51-54];另一方面,可研制适合XRD原位观测的小型高压装置,实现对混合气生成水合物的微观生长过程进行原位观测,从而识别不同反应阶段生成的水合物的结构类型[55]。
Takeya等[11]在 263 K 下测量了 CH4-C2H6混合气水合物的X射线衍射峰(图6)。结果表明,随着混合气中C2H6含量的变化,生成的水合物类型也发生相应的变化。例如,混合气中 C2H6含量由0.5%增加到0.8%、3.7%、18.6%和29.7%时,水合物对应的类型分别为:Ⅰ型、(Ⅰ+Ⅱ)型、Ⅱ型、(Ⅰ+Ⅱ)型和Ⅰ型。在混合气组成保持恒定的情况下,水合物生长过程的原位观测表明,Ⅰ型和Ⅱ型
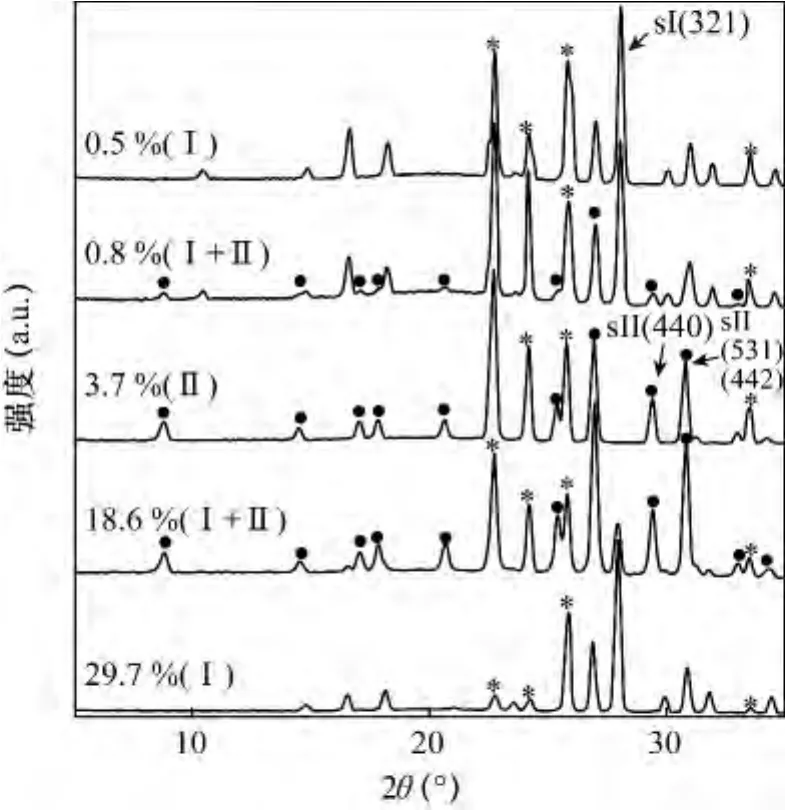
图6 不同乙烷含量时,CH4-C2H6混合气水合物的X射线衍射图谱[11]Fig.6 The XRD patterns of the CH4-C2H6binary gas hydrates with different C2H6ratios[11]
水合物的共同存在是由于亚稳态水合物结构的出现引起的。C2H6比例为18.6%是一个敏感值,可能形成介于Ⅰ型和Ⅱ型的亚稳态结构,需要进一步研究。对混合气体水合物结构及水合物相的转换进行研究有重要的理论与实际意义[33]。研究表明[49-50],在一定条件下,甲烷及二氧化碳水合物可相互转化,即甲烷水合物可被CO2分子置换成为CO2水合物。因此,可利用水合物的方法将大气中的CO2分离出来,然后利用CO2置换出海底水合物中的甲烷,同时将CO2以水合物的形式封闭在海底,减少大气中的CO2的含量[20,56]。
3 X射线衍射研究水合物生成分解动力学与“自保护效应”
3.1 水合物生成分解动力学过程研究
天然气水合物的热力学与动力学研究,是天然气水合物研究的两个重要的方面。热力学条件决定能否生成水合物,而动力学条件则决定着水合物何时生成及生成速度。开展水合物的生成与分解动力学研究,对控制水合物在特定的时间与空间生成与分解有重要的意义。对水合物动力学研究,多采用分子模拟手段,获得不同条件下的数学模型,从而计算相应的动力学参数。天然气水合物在生成与分解动力学过程其晶体结构会发生相应的变化,采用先进的实验技术可以直接观测到这种变化。由于XRD对晶体体积的变化很敏感,故可用于原位观测水合物的生成与分解动力学微观过程。通常情况下,原位观测需要有透明的高压反应釜,采用XRD测定水合物的生成与分解过程中衍射峰的变化,通过冰与水合物晶体的衍射峰强度比研究水合物的生成与分解的动力学过程。研究表明[26,28],在由CO2分子与冰生成CO2水合物的过程中,水合物峰强度增大而冰峰强度减小。冰转变为CO2水合物经过两个步骤:首先在冰的表面快速形成一层CO2水合物,然后随着CO2和H2O分子向水合物层内的扩散,CO2水合物慢慢生长。Takeya等[26]建立了一个固相扩散模型,指出CO2水合物的生长速率主要由CO2和H2O分子在水合物层的扩散速率决定着。由冰到水合物的转换机理十分复杂,还需要更多的实验数据来解释[57]。
Uchida等[58]采用XRD研究了甲烷-丙烷水合物的生成过程。实验温度274 K,压力7 MPa,丙烷初始浓度在4%~8%。实验发现,整个反应过程分为两个阶段进行:前一小时反应很快,压力迅速下降,并保持了暂时的稳定;然后又出现了快速的压力下降的阶段。XRD测试结果表明,第一阶段生成了Ⅱ型甲烷-丙烷混合水合物,第二阶段生成了Ⅰ型甲烷水合物。
由于X射线衍射峰相对强度与样品中晶体体积含量成比例关系,因此根据强度的变化率可以测量晶体体积的转化率。半导体固体检测器(SSD)是一种具有极高能量分辨本领的射线强度检测器,能用来测量X射线的能量和波长。能量色散型X射线衍射仪是一种以SSD为基础的一种新型衍射仪,使用连续波长的X射线照射样品,在一个固定的角度位置测量衍射线的波长谱,从而计算各衍射晶面的间距 d值。Takeya等[32,37]采用时间分辨、能量色散XRD原位观测了甲烷水合物的分解率及其转化成六角形(Ih)冰的转化率(图7)。谱图是在温度198 K获得的,不同的晶面也标在图7上。其中带*号的为Ih冰晶面峰,小箭头指示的(2 2 2)和(3 2 0)为甲烷水合物晶面峰。在一个大气压下,实验温度从168 K升到198 K,通过对Ih冰的衍射峰强度的动态观测,发现甲烷水合物的分解由第一阶段的快速过程和第二阶段的慢速分解过程所构成。在第一阶段(持续时间为几十分钟),Ih冰衍射峰出现并快速增强,CH4水合物衍射峰的强度减小,水合物分解较快,并在甲烷水合物表层逐渐形成一圈薄层的Ih型冰;在第二阶段,随着水合物被冰完全圈闭,由于甲烷必须穿透冰层才能扩散出来,因而水合物分解变慢。第二阶段水合物的分解速率决定了水合物稳定存在的时间。在189 K和168 K下,测定的甲烷的扩散系数分别为2.2×10-11m2/s和9.6×10-12m2/s。

图7 XRD原位观测从甲烷水合物到Ih冰的转化过程[37]Fig.7 In situ X-ray diffraction profiles during the transformation of CH4-hydrate to ice Ih[37]
3.2 水合物“自保护效应”机理研究
在低温条件下(低于冰点),水合物在分解过程中生成了气体和水,水在水合物表层形成了一层冰膜,冰膜对内层水合物有封闭作用,使水合物在非平衡条件下具有高稳定性,防止水合物进一步分解,这种现象叫作“自保护效应”[59]。
研究表明[60],将甲烷水合物与冰在大气压下温度为267 K可保存2年,这就是水合物“自保护效应”的作用。Stern等[41]进一步研究表明甲烷水合物的“自保护效应”不需要太低的温度,仅仅是在冰点附近。采用时间分辨XRD测定甲烷水合物晶体的分解过程,可理解水合物的分解和自保护机理。Takeya等[32,37]用XRD原位观测甲烷水合物在等压条件下从148 K到253 K的分解过程,由衍射峰强度可以判断甲烷水合物晶体转换成冰分为两步,这与观测到的冰生成 CO2水合物的过程十分相似[26,28]。甲烷水合物自保护效应可解释为:水合物分解使其表层形成一层冰壳,可阻止甲烷气的释放而延迟水合物分解;水合物分解速率由气体分子在多孔冰或冰粒间的扩散速率所决定,在168 K时扩散速率为9.6×10-12m2/s。因此,水合物自保护效应强烈地依赖于部分水合物分解时形成的冰层的物理性质,不仅仅是冰层的厚度,还包含冰颗粒的大小、冰层的宏观结构。最近的实验表明,甲烷分子在冰中的扩散速率,还受到水合物分解过程中热流及其他一些冰和水合物未知性质的影响,这些都应该解释为“自保护效应”[61-63]。
Takeya等[64]研究了甲烷水合物自保护效应与水合物粒径的关系。在大气压下,将不同粒径甲烷水合物从135 K升温至263 K(升温速率1 K/min),在此过程中利用XRD测定水合物的分解率。结果表明,对于粒径小于250 μm的水合物,水合物均在210 K左右分解。但是,当水合物粒径大于250 μm后,水合物需要更高的温度才能分解。例如,对于1000~1400 μm粒径的水合物,20%左右的水合物几乎在263 K时还可以保持不分解,这与水合物的自保护效应有关。然而,实验发现有些水合物,如CH4+C2H6混合气生成的Ⅱ型水合物的“自保护效应”不够明显,具体原因尚不清楚,这可能与生成的水合物颗粒过细有关。总之,天然气水合物的“自保护效应”机理及影响规律十分复杂,有待于进一步研究[57]。
4 X射线衍射应用于野外水合物样品鉴定
由于天然气水合物具有重要的战略意义和巨大的经济价值,世界上许多达国家相继投入巨资进行天然气水合物的调查与钻探。目前,已在太平洋、大西洋、印度洋、南北极近海、内陆海及陆地冻土带等地区发现了天然气水合物,其中在多个地区钻获了水合物样品。这些样品都需要在实验室内经过一系列实验分析与测试,了解其物理化学特性,可为进一步深入研究该区的天然气水合物成矿机理、进行资源综合评价提供基础数据。
目前,由于取样技术的提高,在天然气水合物钻探过程中多采用保压取心装置,可以保证钻获的沉积物岩心中天然气水合物样品的相对完整性。对大多数已获得的天然水合物样品来说,可以分离、富集得到足够量的水合物来进行XRD、拉曼光谱等几种不同技术的测定,以获取这些水合物的结构特征及一些物性参数[15,65-69]。通常情况下,野外钻获的天然气水合物样品主要以分散状、结核状或脉状赋存在沉积物中,块状水合物样品并不多见。这些样品需要在液氮中进行处理、分选,研磨成粉末,然后采用粉晶XRD进行测定。样品槽中放入的粉末样品表面必须平整,否则会影响测试结果。通过对样品测定的XRD谱图进行分析,鉴定水合物的笼型结构类型,明确不同条件下生成的天然气水合物的结构特征,可以从微观角度阐明控制天然气水合物笼型结构形成的主要因素和机理。
国外学者采用XRD技术已对加拿大麦肯齐三角洲 Mallik 5L-38 的样品[70]、水合物脊样品[69],温哥华岛海岸的样品[16,71],贝加尔湖的样品[72-73]、墨西哥湾水合物样品[74-75]和日本南开海槽水合物样品[76-77]进行了结构测定。Lu 等[78]报道了阿拉斯加北坡陆地冻土区钻获的天然气水合物的性质,是一种Ⅰ型结构的水合物。Takeya等[23]研究了南极深层冰心中空气水合物的晶格常数,首次测定了N2、O2小分子生成的Ⅱ型水合物的热膨胀系数。在200 K时,晶格常数为17.20×10-10m,热膨胀系数为34×10-6~53×10-6K-1,晶格常数比四氢呋喃Ⅱ型水合物小0.3%,但热膨胀系数基本一致。
对鄂霍次克海水合物的研究表明[24],4个站位获得的水合物主要成分为甲烷(96%~98%)和少量的二氧化碳,为Ⅰ型结构,晶格参数在113 K时为11.85×10-10m,与纯甲烷水合物很接近,说明水合物客体中混有少量的二氧化碳不会影响其晶格参数。此外,还在83~173 K测定了水合物的热膨胀,得到了水合物晶体在273 K的密度为0.92 g/cm3,其结果对天然气水合物的应用非常重要。
Lu等[79]首次在自然界中发现了H型水合物的存在。经过对Ih冰峰的校正,通过与标准的水合物谱峰对比,发现了Ⅱ型和H型水合物的存在(图8)。图8中的a.u为任意单位,经计算得到Ⅱ型的晶格参数为:a=(17.246±0.002)×10-10m;H型的晶格参数为:a=(12.19±0.009)×10-10m和c=(10.06±0.009)×10-10m。经分析,该地区天然气水合物的复杂结构与该地区复杂气体来源有关。
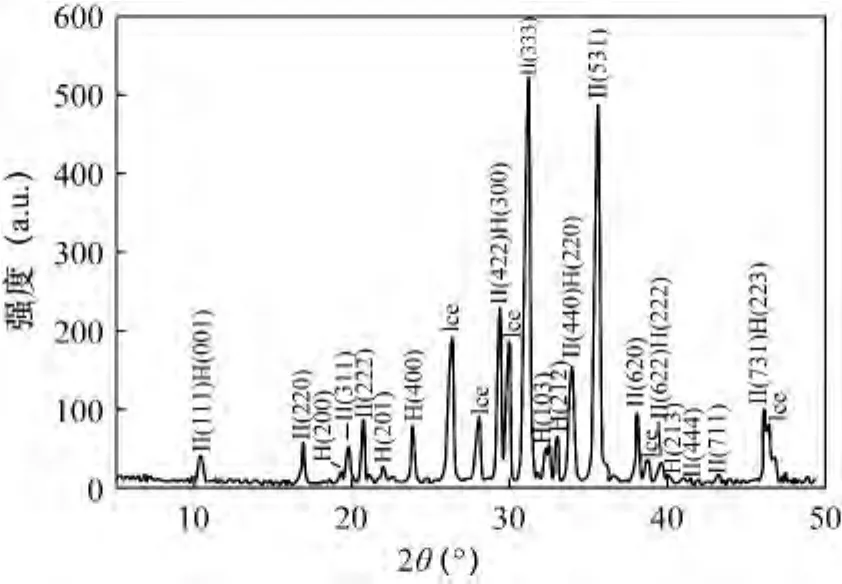
图8 温哥华近海天然气水合物的XRD图谱[68]Fig.8 The X-ray diffraction pattern of the gas hydrate from offshore Vancouver island[68]
5 结语
XRD技术是获取天然气水合物结构信息强有利的工具,是鉴别水合物类型的最有效的技术手段。首先,XRD技术可直接测定水合物晶体的晶格参数,通过与三种典型的水合物晶体的晶格参数对比,即可判定水合物晶体的结构类型。另外,通过测定不同条件下生成的水合物晶体参数的变化,可研究水合物的结构转换及其影响规律。实验结果表明混合气体的组成、客体分子体积及直径及温度等都对水合物晶体参数及结构产生影响。其次,通过在高压环境下的XRD原位技术研究水合物生成/分解动力学过程,结果表明水合物生成/分解主要分两个阶段,即在气液(固)表面的快速生成/分解过程及气体分子在液(固)体内部的扩散过程。
XRD技术是海洋或冻土区钻获的天然气水合物样品鉴定并获得结构信息的有利工具,该技术已在国外水合物研究中得到了广泛应用,而我国才刚刚起步。将XRD技术应用到天然气水合物的研究中,通过对水合物晶体结构鉴定、结构转化、晶胞参数测定、热膨胀及水合物生成以及分解动力学等方面的深入研究,有助于解决天然气水合物研究领域中的基本科学问题,如水合物的笼型结构及其变化规律等。
目前,XRD技术主要用于天然气水合物样品的结构测量上,XRD原位观测技术仍不成熟,尚有很大的发展空间。可以预见未来一段时间,研制有效的、适合XRD技术原位观测的高压反应装置,以及开展与其他测试技术(如核磁共振、红外光谱、X-CT等)联合分析以准确计算其水合物的晶腔填充率,将是该技术面临的问题和挑战。这些问题的解决,将使XRD技术成为天然气水合物相关的理论研究强有力的技术支撑。
[1]Milkov A V.Global estimates of hydrate-bound gas in marine sediments:How much is really out there[J].Earth-Science Reviews,2004,66(3):183-197.
[2]Lu H,Ripmeester J A.A laboratory protocol for the analysis of natural gas hydrates[C]//6th International Conference on Gas Hydrates, Vancouver, British Columbia,CANADA,2008.
[3]Rojas Y,Lou X.Instrumental analysis of gas hydrates properties [J].Asia-Pacific JournalofChemical Engineering,2010,5(2):310-323.
[4]夏宁,刘昌岭,业渝光,孟庆国,林学辉,贺行良.显微激光拉曼光谱测定天然气水合物的方法研究[J].岩矿测试,2011,30(4):416-422.
[5]刘昌岭,孟庆国,业渝光.固体核磁共振技术在气体水合物研究中的应用[J].波谱学杂志,2012,29(3):465-474.
[6]刘昌岭,业渝光,孟庆国.显微激光拉曼光谱测定甲烷水合物的水合指数[J].光谱学与光谱分析,2010,30(4):963-966.
[7]Udachin K A,Ratcliffe C I,Ripmeester J A.Structure,composition,and thermal expansion of CO2hydrate from single crystal X-ray diffraction measurements[J].The Journal of Physical Chemistry B,2001,105(19):4200-4204.
[8]Uchida T,Takeya S,Kamata Y,Ikeda I Y,Nagao J,Ebinuma T,Narita H,Zatsepina O,Buffett B A.Spectroscopic observations and thermodynamic calculations on clathrate hydrates of mixed gas containing methane and ethane:Determination of structure,composition and cage occupancy[J].The Journal of Physical Chemistry B,2002,106(48):12426-12431.
[9]Uchida T,Takeya S,Kamata Y,Ohmura R,Narita H.Spectroscopic measurements on binary,ternary,and quaternary mixed-gas molecules in clathrate structures[J].Industrial & Engineering Chemistry Research,2007,46(14):5080-5087.
[10]Udachin K A,Ratcliffe C I,Ripmeester J A.Single crystal diffraction studies of structureⅠ,Ⅱ and H hydrates:Structure,cage occupancy and composition[J].Journal of Supramolecular Chemistry,2002,2(4):405-408.
[11]Takeya S,Kamata Y,Uchida T,Nagao J,Ebinuma T,Narita H,Hori A,Hondoh T.Coexistence of structureⅠandⅡhydrates formed from a mixture of methane and ethane gases [J].Canadian Journal of Physics,2003,81(1-2):479-484.
[12]Takeya S,Uchida T,Kamata Y,Nagao J,Kida M,Minami H,Sakagami H,Hachikubo A,Takahashi N,Shoji H,Khlystov O,Grachev M,Soloviev V.Lattice expansion of clathrate hydrates of methane mixtures and natural gas[J].Angewandte Chemie,2005,117(42):7088-7091.
[13]Takeya S,Hori A,Uchida T,Ohmura R.Crystal lattice size and stability of type H clathrate hydrates with various large-molecule guestsubstances[J].The Journal of Physical Chemistry B,2006,110(26):12943-12947.
[14]Susilo R,Ripmeester J A,Englezos P.Characterization of gas hydrates with PXRD,DSC,NMR,and Raman spectroscopy[J].Chemical Engineering Science,2007,62(15):3930-3939.
[15]Davidson D W,Garg S K,Gough S R,Handa Y P,Ratcliffe C I,Ripmeester J A,Tse J S.Laboratory analysis of a naturally occurring gas hydrate from sediment of the Gulf of Mexico[J].Geochimica et Cosmochimica Acta,1986,50(4):619-623.
[16]Lu H L,Moudrakovski I,Riedel M,Spence G,Dutrisac R,Ripmeester J,Wright F,Dallimore S.Occurrence and structuralcharacterization ofgas hydrates associated with a cold vent field,offshore VancouverIsland [J].Journal of Geophysical Research:Solid Earth,2005,110(B10):10-18.
[17]Lee J W,Kim D Y,Lee H.Phase behavior and structure transition of the mixed methane and nitrogen hydrates[J].Korean Journal of Chemical Engineering,2006,23(2):299-302.
[18]Jeffrey G A,McMullan R K.The clathrate hydrates[J].Progress in Inorganic Chemistry,2007,8:43-108.
[19]Klapproth A,Goreshnik E,Staykova D,Klein H,Kuhs W F.Structural studies of gas hydrates[J].Canadian Journal of Physics,2003,81(1-2):503-518.
[20]Seo Y T,Lee H.Structure and guest distribution of the mixed carbon dioxide and nitrogen hydrates as revealed by X-ray diffraction and13C NMR spectroscopy[J].The Journal of Physical Chemistry B,2004,108(2):530-534.
[21]Tse J S,McKinnon W R,Marchi M.Thermal expansion of structure Ⅰ ethylene oxide hydrate[J].Journal of Physical Chemistry,1987,91(15):4188-4193.
[22]Tse J S.Dynamical properties and stability of clathrate hydrates[J].Annals of the New York Academy of Sciences,1994,715(1):187-206.
[23]Takeya S,Nagaya H,Matsuyama T,Hondoh T,Lipenkov V Y.Lattice constants and thermal expansion coefficient of air clathrate hydrate in deep ice cores from Vostok,Antarctica[J].TheJournalofPhysical Chemistry B,2000,104(4):668-670.
[24]Takeya S,Kida M,Minami H,Sakagamib H,Hachikubob A,Takahashib N,Shojib H,Solovievc V,Wallmannd K,Biebowe N,Obzhirovf A,Salomatinf A,Poortg J.Structure and thermal expansion of natural gas clathrate hydrates[J].Chemical Engineering Science,2006,61(8):2670-2674.
[25]Koh C A,Savidge J L,Tang C C.Time-resolved in-situ experiments on the crystallization of natural gas hydrates[J].The Journal of Physical Chemistry,1996,100(16):6412-6414.
[26]Takeya S,Hondoh T,Uchida T.In situ observation of CO2hydrate by X-ray diffraction[J].Annals of the New York Academy of Sciences,2000,912(1):973-982.
[27]Huo Z,Hester K,Sloan E D,Miller K T.Methane hydrate nonstoichiometry and phase diagram[J].AIChE Journal,2003,49(5):1300-1306.
[28]Uchida T,Takeya S,Wilson L D,Tulk C A,Ripmeester J A,Nagao J,Ebinuma T,Narita H.Measurements of physical properties of gas hydrates and in situ observations of formation and decomposition processes via Raman spectroscopy and X-ray diffraction[J].Canadian Journal of Physics,2003,81(1-2):351-357.
[29]Uchida T,Ohmura R,Ikeda I Y,Nagao J,Takeya S,Hori A.Phase equilibrium measurements and crystallographic analyses on structure-H type gas hydrate formed from theCH4-CO2-neohexane-water system[J].The Journal of Physical Chemistry B,2006,110(10):4583-4588.
[30]Feklistov V V,Timchenko A K,Ancharov A I,Sheromov M A,Manakov A Y.A chamber for X-ray diffractometry of gas hydrates samples for pressures of up to 700 atm[J].Instruments and Experimental Techniques,2005,48(6):826-828.
[31]Kurnosov A,Dubrovinsky L,Kuznetsov A,Dmitriev V.High-pressure/high-temperature behavior of the methane-ammonia-water system up to 3 GPa[J].Zeitschrift Fur Naturforschung B,2006,61(12):1573-1576.
[32]Takeya S,Shimada W,Kamata Y,Ebinuma T,Uchida T, NagaoJ, Narita H.In situ X-ray diffraction measurements of the self-preservation effect of CH4hydrate[J].The Journal of Physical Chemistry A,2001,105(42):9756-9759.
[33]Sloan E D.Fundamental principles and applications of natural gas hydrates[J].Nature,2003,426(6964):353-363.
[34]Claussen W F.A second water structure for insert gas hydrates[J].Journal of Chemical Physics,1951,19:1425-1426.
[35]Claussen W F.Suggested structures of water in inert gas hydrates[J].Journal of Chemical Physics,1951,19:662.
[36]Ripmeester J A,John S T,Ratcliffe C I,Powell B M.A new clathrate hydrate structure[J].Nature,1987,325(6100):135-136.
[37]Takeya S,Ebinuma T,Uchida T,Nagao J,Narita H.Self-preservation effect and dissociation rates of CH4hydrate[J].Journal of Crystal Growth,2002,237:379-382.
[38]Muromachi S,Takeya S,Yamamoto Y,Ohmura R.Characterization of tetra-n-butylphosphonium bromide semiclathrate hydrate by crystal structure analysis[J].CrystEngComm,2014,16:2056-2060.
[39]Shpakov V P,Tse J S,Tulk C A,Kvammec B,Belosludov V R.Elastic modulicalculation and instability in structureⅠmethane clathrate hydrate[J].Chemical Physics Letters,1998,282(2):107-114.
[40]Collett T S,Lee M W.Reservoir characterization of marine and permafrost associated gas hydrate accumulations with downhole well logs[J].Annals of the New York Academy of Sciences,2000,912(1):51-64.
[41]Stern L A,Circone S,Kirby S H,Durham W B.Anomalous preservation of pure methane hydrate at 1 atm[J].The Journal of Physical Chemistry B,2001,105(9):1756-1762.
[42]Ikeda-Fukazawa T,Hondoh T,Fukumura T,Fukazawa H,Mae S.Variation in N2/O2ratio of occluded air in Dome Fuji Antarctic ice[J].Journal of Geophysical Research:Atmospheres(1984—2012),2001,106(D16):17799-17810.
[43]Shin K,Moudrakovski I L,Davari M D,Alavi S,Ratcliffe C I,Ripmeester J A.Crystal engineering the clathrate hydrate lattice with NH4F [J].CrystEngComm,2014,Advance Article.DOI:10.1039/C3CE41661E.
[44]Hendriks E M,Edmonds B,Moorwood R A S,Szczepanski R.Hydrate structure stability in simple and mixed hydrates[J].Fluid Phase Equilibria,1996,117(1):193-200.
[45]Subramanian S,Kini R A,Dec S F,Sloan E D.EvidenceofstructureⅡ hydrateformationfrom methane+ethane mixtures[J].Chemical Engineering Science,2000,55(11):1981-1999.
[46]Subramanian S,Ballard A L,Kini R A,Dec S F,Sloan E D.Structural transitions in methane+ethane gas hydrates—part Ⅰ:Upper transition point and applications[J].Chemical Engineering Science,2000,55(23):5763-5771.
[47]Ballard A L,Sloan E D.Optimizing thermodynamic parameters to match methane and ethane structural transition in natural gas hydrate equilibria[J].Annals of the New York Academy of Sciences,2000,912(1):702-712.
[48]Schicks J M,Naumann R,Erzinger J,Hester K C,Koh C A,Sloan E D.Phase transitions in mixed gas hydrates:Experimental observations versus calculated data[J].The Journal of Physical Chemistry B,2006,110(23):11468-11474.
[49]Schicks J M,Ripmeester J A.The coexistence of two differentmethane hydrate phases undermoderate pressure and temperature conditions:Kinetic versus thermodynamic products[J].Angewandte Chemie International Edition,2004,43(25):3310-3313.
[50]Staykova D K,Kuhs W F,Salamatin A N,Hansen T.Formation of porous gas hydrates from ice powders:Diffraction experiments and multistage model[J].The Journal of Physical Chemistry B,2003,107(37):10299-10311.
[51]Matsumoto Y,Grim R G,Khan N M,Sugahara T,Ohgaki K, Sloan E D, Koh C A, Sum A K.Investigating the thermodynamic stabilities of hydrogen and methane binary gas hydrates[J].The Journal of Physical Chemistry C,2014,118(7):3783-3788.
[52]Kondo W,Ohtsuka K,Ohmura R,Takeya S,Mori Y H.Clathrate-hydrate formation from a hydrocarbon gas mixture:Compositional evolution of formed hydrate during an isobaric semi-batch hydrate-forming operation[J].Applied Energy,2014,113:864-871.
[53]Luzi M,Schicks J M,Naumann R,Erzinger J.Systematic kinetic studies on mixed gas hydrates by Raman spectroscopy and powder X-ray diffraction[J].The Journal of Chemical Thermodynamics,2012,48:28-35.
[54]Lee H H,Ahn S H,Nam B U,Kim B S,Lee G W,MoonD, ShinH J, HanK W, YoonJH.Thermodynamic stability,spectroscopic identification,and gas storage capacity of CO2-CH4-N2mixture gas hydrates:Implications for landfill gas hydrates[J].Environmental Science & Technology,2012,46(7):4184-4190.
[55]Seo Y,An S,Park J W,Kim B S,Komai T,Yoon J H.Occupation and release behavior of guest molecules in CH4,CO2,N2and acetone mixture hydrates:An in situ study by Raman spectroscopy[J].Industrial & Engineering Chemistry Research,2014,53(14):6179 6184.
[56]Lee H,Seo Y,Seo Y T,Moudrakovski I L,Ripmeester J A.Recovering methane from solid methane hydrate with carbon dioxide [J].Angewandte Chemie International Edition,2003,42(41):5048-5051.
[57]Kuhs W F,Klapproth A,Gotthardt F,Techmer K,Heinrichs T.The formation of meso-and macroporous gas hydrates[J].Geophysical Research Letters,2000,27(18):2929-2932.
[58]Uchida T,Moriwaki M,Takeya S,Ikeda I Y,Ohmura R,Nagao J,Minagawa H,Ebinuma T,Narita H,Gohara K,Mae S.Two-step formation of methane propane mixed gas hydrates in a batch-type reactor[J].AIChE Journal,2004,50(2):518-523.
[59]Yakushev V S,Istomin V A.Gas-hydrates self preservation effect[J].Physics and Chemistry of Ice,1992:136-140.
[60]Stern I A,Kirky S H,Durham W B.Peculiarities of methane clathrate hydrate formation and solid-state deformation,including possible superheating of water ice[J].Science-AAAS-Weekly Paper Edition,1996,273(5283):1843-1847.
[61]Stern L A,Circone S,Kirby S H,Durham W B.Temperature,pressure,and compositional effects on anomalous or“self”preservation of gas hydrates[J].Canadian Journal of Physics,2003,81(1-2):271-283.
[62]Circone S,Stern L A,Kirby S H.The role of water in gas hydrate dissociation[J].The Journal of Physical Chemistry B,2004,108(18):5747-5755.
[63]Komai T,Kang S P,Yoon J H,Yamamoto Y,Kawamura T,Ohtake M.In situ Raman spectroscopy investigation of the dissociation of methane hydrate at temperatures just below the ice point[J].The Journal of Physical Chemistry B,2004,108(23):8062-8068.
[64]Takeya S,Uchida T,Nagao J,Ohmura R,Shimada W,Kamata Y,Ebinuma T,Narita H.Particle size effect of CH4hydrate for self-preservation[J].Chemical Engineering Science,2005,60(5):1383-1387.
[65]Gutt C,Asmussen B,Press W,Merkl C,Casalta H,Greinert J,Bohrmann G,Tse J S,H ller A.Quantum rotations in natural methane-clathrates from the Pacific sea-floor[J].EPL(Europhysics Letters),1999,48(3):269.
[66]Tulk C A,Ratcliffe C I,Ripmeester J A.Chemical and physical analysisofnaturalgashydratefrom the JAPEX/JNOC/GSC Mallik 2L-38 gas hydrate research well[J].Bulletin-Geological Survey of Canada,1999:251-262.
[67]Yousuf M,Qadri S B,Knies D L,Grabowski K S,Coffin R B,Pohlman J W.Novel results on structural investigations of natural minerals of clathrate hydrates[J].Applied Physics A,2004,78(6):925-939.
[68]Chazallon B,Focsa C,Charlou J L,Bourry C,Donval J.A comparative Raman spectroscopic study of natural gas hydrates collected at different geological sites[J].Chemical Geology,2007,244(1):175-185.
[69]Kim D Y,Uhm T W,Lee H,Lee Y J,Ryu B J,Kimet J H.Compositional and structural identification of natural gas hydrates collected at Site 1249 on Ocean Drilling Program Leg 204[J].Korean Journal of Chemical Engineering,2005,22(4):569-572.
[70]Ripmeester J A,Lu H,Moudrakovski I L,Dutrisac R,Wilson L D,Wright F,Dallimore S R.Structure and composition of gas hydrate in sediment recovered from the JAPEX/JNOC/GSC et al.Mallik 5L-38 gas hydrate production research well,determined by X-ray diffraction and Raman and solid-state nuclear magnetic resonance spectroscopy[J].Bulletin-Geological Survey of Canada,2005,585:106.
[71]Udachin K A,Lu H,Enright G D,Ratcliffe C I,Ripmeester J A,Chapman N R,Riedel M,Spence G.Single crystals of naturally occurring gas hydrates:The structures of methane and mixed hydrocarbon hydrates[J].Angewandte Chemie International Edition,2007,46(43):8220-8222.
[72]Kida M,Hachikubo A,Sakagami H,Minami H,Krylov A,Yamashita S,Takahashi N,Shoji H,Khlystov O,Poort J,Narita H.Natural gas hydrates with locally different cage occupancies and hydration numbers in Lake Baikal[J].Geochemistry,Geophysics,Geosystems,2009,10(5):1-8.
[73]Khlystov O,Batist M D,Shoji H,Hachikubo A,Nishio S,Naudts L,Poort J,Khabuev A,Belousov O,Manakov A.Gas hydrate of Lake Baikal:Discovery and varieties[J].Journal of Asian Earth Sciences,2013,62:162-166.
[74]Klapp S A,Bohrmann G,Kuhs W F,Murshed M M,Pape T,Klein H,Techmer K S,Heeschena K U,Abegg F.Microstructures of structureⅠandⅡgas hydrates from the Gulf of Mexico[J].Marine and Petroleum Geology,2010,27(1):116-125.
[75]Klapp S A,Murshed M M,Pape T,Klein H,Bohrmann G,Brewer P G,Kuhs W F.Mixed gas hydrate structures at the Chapopote Knoll,southern Gulf of Mexico[J].Earth and Planetary Science Letters,2010,299(1):207-217.
[76]Kida M,Jin Y,Watanabe M,Konno Y,Yoneda J,Egawa K,Ito T,Nakatsuka Y,Suzuki K,Nagao J.Characteristics of hydrate-bound gases from the Eastern Nankai Trough[C]//AGU Fall Meeting Abstracts San Francisc:The Smithsonian/NASA Astrophysics Data System,2013:1605.
[77]Miyakawa A,Saito S,Yamada Y,Tomaru H,Kinoshita M,Tsuji T.Gas hydrate saturation at Site C0002,IODP Expeditions 314 and 315, in the Kumano Basin,Nankai trough[J].Island Arc,2014,Advance Article.DOI:10.1111/iar.12064.
[78]Lu H,Lorenson T D,Moudrakovski I L,Ripmeester J A,Collett T S,Hunter R B,Ratcliffe C I.The characteristics of gas hydrates recovered from the Mount Elbert Gas Hydrate Stratigraphic Test Well,Alaska North Slope[J].Marine and Petroleum Geology,2011,28(2):411-418.
[79]Lu H,Seo Y,Lee J,Moudrakovski I,Ripmeester J A,Chapman N R,Coffin R B,Gardner G,Pohlman J.Complex gas hydrate from the Cascadia margin[J].Nature,2007,445(7125):303-306.

