细粒棘球蚴(Echinococcus granulosus)CO1与ND1基因序列分析
于晶峰,谭 伟,李 滨,刘晓松,常建华,杨晓野,王 瑞,杨莲茹,李秀霞
2.内蒙古农牧业科学院兽医研究所,呼和浩特 010031;
3.内蒙古医科大学基础医学院,呼和浩特 010110
细粒棘球蚴病,又名包虫病,是世界广泛分布的人兽共患性寄生虫病[1-2],对感染动物的肉产量、肉品质、产奶量及后代繁殖均有严重影响[3],更重要的是该病对人类的健康也构成了严重的威胁[4-7],因此一直倍受国内外学者的关注。近年来,相关学者已在基因水平上对细粒棘球蚴的虫株的遗传变异进行了研究。
据报道,虫株的遗传变异可能会影响到生理周期模式、宿主的特异性、感染性、抗原性、传播动力学、治疗药物的敏感性、致病性、诊断结果、流行病学和防控措施[8]。因此,确定虫株对制定棘球蚴病的预防和控制策略具有十分重要的意义。细粒棘球绦虫虫株的鉴定比较复杂,以往主要是以其成虫和幼虫的形态学特征,结合生物学、生物化学、同工酶分析和流行病学等方面的资料,作为虫株鉴别的依据。虽然形态学和生物学特征可为细粒棘球绦虫虫株鉴定提供很有价值的资料,但是由于受宿主和环境多种因素的影响,并不能反映不同虫株之间基因水平上的差异。近年来分子生物学技术的飞速发展,极大地促进了人们对细粒棘球绦虫虫株基因型鉴定的研究。众所周知,线粒体DNA(mtDNA)具有进化率快、重组率低、独立进化和基因组精简等特点[9-10],可作为重要的分子标记,用于生物种群的遗传变异研究,尤其适于种以下水平的分类研究[11]。细粒棘球绦虫的线粒体基因组共编码2个核糖体RNA(12S、16S)、22 个 tRNA、1 个 细 胞 色 素 b(Cytb)、3 个 细 胞 色 素 氧 化 酶 亚 基 (CO1、CO2、CO3)、NADH氧化还原酶6个亚基的基因(ND1、ND2、ND3、ND4、ND4L、ND6)和 ATP酶一个亚基的基因(ATPase6)[12]。其中编码呼吸链的细胞色素c氧化酶和NADH氧化还原酶普遍存在于原核生物和真核生物细胞的线粒体中,是线粒体基因组中进化速率较慢的,可用以比较其在进化上的相互关系[13]。
鉴于以上因素,本研究以内蒙古锡林郭勒盟西乌旗地区检获的羊株和锡林浩特市地区检获的人株细粒棘球蚴作为研究对象,对其CO1与ND1基因的部分序列分别进行分析,并将两种序列与Gen-Bank中已报道的细粒棘球蚴CO1和ND1基因相应序列进行比对,目的在于明确这些地区不同动物宿主间细粒棘球蚴种株的基因型和遗传变异情况及不同地理株之间的基因差异,这对了解家畜和人细粒棘球蚴病的感染来源以及不同宿主间的传播链并制定不同地区细粒棘球蚴病的具体防控措施,具有重要参考意义。
1 材料和方法
1.1 材料
1.1.1 试验样品 细粒棘球蚴包囊采自于内蒙古锡林郭勒盟西乌旗绵羊和锡林浩特市某医院细粒棘球蚴病患者。将采集的样本用注射器将囊液吸出,离心1min使囊液与原头蚴分离,-20。C条件下保存。
1.1.2 菌种、载体及主要试剂 大肠杆菌DH5α感受态细胞、DNA提取试剂盒(DNeasy Blood &Tissue Kit)和DNA凝胶回收试剂盒(AxyPrep DNA Gel Extraction Kit),购自北京市天根生化科技有限公司;Premix Taq、pMD19-T 载体、DL2000DNA Marker、氨苄青霉素(Amp)、5-溴-4-氯-3-吲哚-β-D半 乳 糖 苷 (X-gal)、异 丙 基-β-D-硫 代 半 乳 糖 苷(IPTG)、10×Loading Buffer,均购自大连宝生物工程有限公司;核酸染料,购自北京市赛百盛基因技术有限公司。
1.2 方法
1.2.1 总DNA提取 取实验室保存的细粒棘球蚴原头蚴,按照动物基因组DNA提取试剂盒说明书,提取基因组DNA,并置于-20。C冰箱中保存备用。
1.2.2 CO1与ND1基因扩增 以细粒棘球蚴DNA 为 模 板,用 上 游 引 物 5′-TTGTTAGGTGGTTTGTCTGA-3′和下游引物5′-GGCCATCATCAAATAAACAT-3′,扩增 CO1 基因部 分 序 列,PCR反应体系为50μL,内含Permix Taq 25μL,上下游引物各1.5μL,模板5μL,加dH2O补足至50 μL。同时,设置不加DNA模板的阴性对照。PCR扩增条件为:94。C预变性5min后,进入循环;即95。C变性1min,45。C退火45s,72。C延伸70s,共进行35个循环;最后72。C延伸10min。
同样以细粒棘球蚴DNA为模板,用上游引物5′-GGTGGTTGTTTTTGGGTTAG-3′和下游引物5′-GTTTGCTATTGTTAATTAA-3′,扩 增 ND1基因部分序列。PCR反应体系为同上,同时设阴性对照。PCR条件为:94。C预变性5min,95。C变性1min,50。C退火50s,72。C延伸70s,共进行35个循环,循环结束后以72。C继续延伸10min。
1.2.3 PCR产物纯化、克隆与测序 利用胶回收试剂盒对PCR扩增产物的目的片段进行胶回收,将回收的CO1基因与ND1基因PCR扩增产物分别与pMD19-T载体连接。然后,将链接产物分别转化至DH5α感受态细胞中,再分别涂布于LB固体培养基(含有 Amp、IPTG、X-gal)表面,37。C恒温培养12h~16h,后置4。C冰箱显色1h~2h。挑取数个白色菌落接种于含有Amp的LB液体培养基中,37。C、180r/min振荡培养过夜,菌液经PCR鉴定后,将阳性菌液送至中美泰和公司测序。
2 结 果
2.1 CO1与ND1基因PCR扩增 细粒棘球蚴CO1和ND1基因分别经1%琼脂糖电泳后,在约936bp、895bp处呈现特异性条带,与目的片段大小基本一致,且无非特异性扩增条带产生,扩增结果见图1、图2。
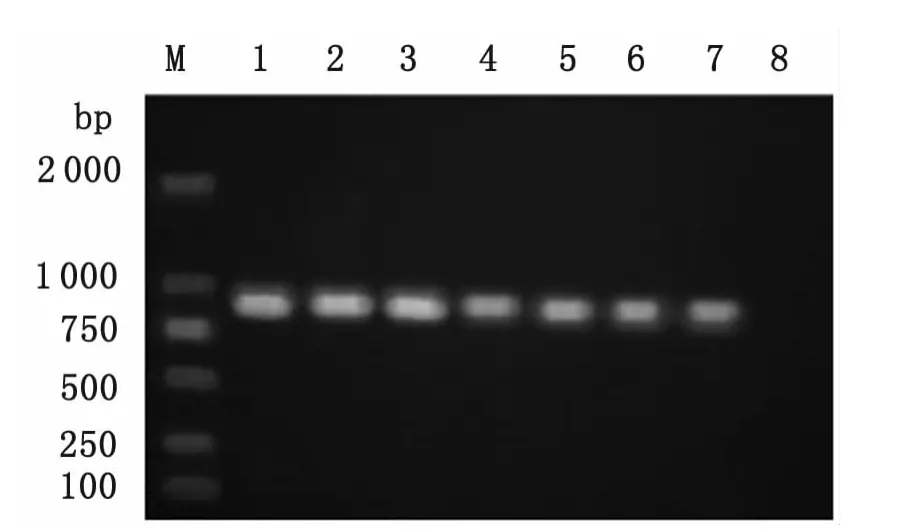
图1 细粒棘球蚴CO1基因PCR产物电泳结果Fig.1 Electrophoresis results of PCR products of CO1gene fromEchinococcus granulosus
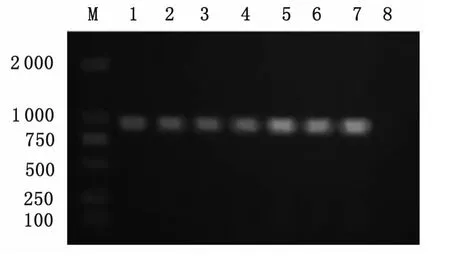
图2 细粒棘球蚴ND1基因PCR产物电泳结果Fig.2 Agarose gel electrophoresis of PCR products of ND1 gene fromEchinococcus granulosus
2.2 CO1与ND1基因测序结果 西乌旗羊株细粒棘球蚴CO1基因与锡林浩特市人株细粒棘球蚴CO1基因片段大小均为936bp,其A、T、G、C含量分别为15.71%、24.89%、48.72%、10.68%和15.60%、25.11%、47.54%、11.75%。
西乌旗羊株细粒棘球蚴ND1基因与锡林浩特市人株细粒棘球蚴ND1基因片段大小均为895bp其 A、T、G、C 含量分别为 19.44%、25.92%、46.59%、8.04% 和 19.44%、25.92%、46.82%、7.82%。
2.3 CO1基因序列比对结果 比对结果显示:西乌旗羊株细粒棘球蚴CO1基因与锡林浩特市人株细粒棘球蚴CO1基因分别同GenBank中已登录的新疆羊株细粒棘球蚴的CO1基因序列相比,相应区域同源性分别存在6个和13个变异位点,突变类型均为转换,即G与A置换和T与C置换;同源性分别为99.3%、98.6%(图3)。

图3 不同地理样本间CO1基因序列同源性比较Fig.3 Homology of CO1gene sequences from different areas
2.4 ND1序列比对结果 利用DNAStar5.0中的MegAlign工具对ND1基因的序列进行分析,结果显示:西乌旗羊株细粒棘球蚴的ND1基因序列与国内外已报道的G1型ND1基因序列完全相同;锡林浩特人株细粒棘球蚴的ND1基因序列与G1型ND1基因序列存在2个变异位点,全部为T与C转换;西乌旗羊株细粒棘球蚴和锡林浩特人株细粒棘球蚴均为G1基因型。
3 讨 论
现有研究表明,动物mtDNA按照严格的母性遗传方式传代,分子量小,拷贝数多,基因的碱基替代率比单拷贝的核DNA基因组快5~10倍,进化速率很快,其中CO1基因和ND1基因相当保守,表现为不同程度的种内遗传差异和种间差异。因此,CO1基因和ND1基因可用于动物性寄生虫的鉴 定 和 不 同 地 理 株 的 区 分[14-15]。 李 明 伟 等(2005)[16]对犬弓首蛔虫的CO1基因部分序列进行了测序,结果表明不同地方虫株的CO1基因表现出一定的差异性。刘国华等(2009)用不同地区的泡状带绦虫的CO1基因序列与GenBank中报道的泡状带绦虫的CO1基因序列进行了对比,结果发现二者CO1基因序列无差异[17]。本研究对西乌旗羊株细粒棘球蚴和锡林浩特人株细粒棘球蚴CO1基因进行了测序,并将两株细粒棘球蚴CO1基因与新疆株细粒棘球蚴的CO1基因进行了比较。从序列对比结果可看出,西乌旗羊株细粒棘球蚴和锡林浩特人株细粒棘球蚴的CO1基因与新疆株细粒棘球蚴的CO1基因同源性很高,分别为99.3%、98.6%。
细粒棘球绦虫对中间宿主有广泛的适应性,但在长期进化演变的过程中,虫体与宿主之间在相互适应中也发生着变异。以往以形态学特征为主的虫株鉴定依据受到多种因素(如宿主和环境)的影响,并不能完全反映其基因水平的差异;而基于DNA序列的分析可直接鉴定生物体的不同种、亚种及地理株,能避免宿主和环境等因素的影响[18],ND基因是常用的分型基因。国内外学者根据基因型的差异,将细粒棘球绦虫分为10个基因型,即G1~G10。不同基因型虫株对人的感染性和致病性有差别,G1、G2、G3、G5、G6、G7、G8、G9均可感染人,其他基因型虫株对人的致病性有待进一步研究。不同基因型虫株间的核苷酸都有不同程度的差异,如G2和G3与G1间的核苷酸差异很小,被称为细粒棘球绦虫的狭义种;G4与其它虫株间的核苷酸差异在10%,G5与其它虫株间的核苷酸差异在6%以上;G6、G7、G8、G9、G10与 G1间的核苷酸差异超过10%。杨俊克(2004)[19]对我国三省区(青海省、甘肃省和新疆维吾尔族自治区)细粒棘球蚴基因变异的情况进行了分析,由检测结果可知,各地区分离株ND1基因的变异率为0.1%~0.7%,均属于G1基因型。本研究对内蒙古两地区的细粒棘球蚴虫株进行了测序,经DNAStar5.0软件分析可知,两地区细粒棘球蚴均为G1型,以上数据表明,这些地区人的细粒棘区病有可能通过绵羊—犬—人方式进行传播流行,需要加以注意和防控。
综上所述,本次研究所得的西乌旗羊株细粒棘球蚴和锡林浩特市人株细粒棘球蚴的CO1基因与新疆株细粒棘球蚴的CO1基因相比均有变异位点,突变类型为转换,即不同地理株细粒棘球蚴CO1基因的部分序列略有不同;但在ND1基因方面,与新疆株相比,西乌旗羊株细粒棘球蚴ND1基因序列无变异位点,而锡林浩特市人株细粒棘球蚴ND1基因序列存在2个变异位点,全部为T与C转换。上述研究结果,为确定细粒棘球绦虫在内蒙古某些地区的流行虫株基因型及其可能的传播链情况提供了重要依据。
[1]Dakkak A.Echinococcosis/hydatidosis:a severe threat in Mediterranean countries[J].Vet Parasitological,2010,174(1-2):2-11.
[2]Romig T,Dinkel A,Mackenstedt U.The present situation of echinococcosis in Europe[J].Parasitol Int,2006,55(Suppl):S187-191
[3]Jenkines DJ.Echinococcus in Australia,widespread and doing well[J].Parasitol Int,2006,55(Suppl 1):S 203-206.
[4]Qian YM,Ma JX,Wang YD.Investigation on cystic echinococcosis fo sheep from Xinghai region[J].Qinghai Agr Anim Husb,2008,38(7):612-615.(in Chinese)铁永梅,马建霞,王永殿.兴海地区绵羊棘球蚴病调查[J].青海农牧业,2010,1:16
[5]Xu ZJ,Zhang CY,Tan YH,et al.Prevalence of hydatid disease in Heilongjiang Province[J].Chin J Parasitol Parasit Dis,2004,22(2):93.(in Chinese)徐之杰,张崇友,镡云辉,等.黑龙江省棘球蚴病流行概况[J].中国寄生虫学和寄生虫病,2004,22(2):93
[6]Hu QP,Angqing ZM.Hydatid infection among yak from Baiyu town of Jiuzhi county[J].Chin Qinghai J Anim Vet Sci,2008,38(5):17.(in Chinese)胡青攀,昂青卓玛.久治县白玉乡牦牛棘球蚴感染情况调查[J].青海畜牧兽医杂志,2008,38(5):17
[7]Tu BX,Zhang WL,Zhang WB,et al.Investigation onEchinococcusgranulosusinfection in camel from Alashan of Inner Mongolia[J].Endem Dis Bull,2003,18(2):99.(in Chinese)图布新,张文林,张文彬,等.内蒙古阿拉善左旗骆驼中细粒棘球蚴感染的调查[J].地方病通报,2003,18(2):99
[8]McManus DP,Thompson RC.Molecular epidemiology of cystic echinococcosis[J].Parasitology,2003,127(1):37-51.
[9]Ishida N,Hasegawa T,Takeda K,et al.Polymorphic sequence in the D-loop region of equine mitochondrial DNA[J].Animal Genetics,1994,25:215-221.
[10]Saccone C,Gissi C,Lanave C,et al.Evolution of the mitochondrial genetic system:an overview[J].Gene,2000,261(1):153-159.
[11]Feagin JE.Mitochondrial genome diversity in Parasites[J].Parasitology,2000,30:371-390.
[12]Boore JL.Animal mitochondrial genomes[J].Nucleic Acids Research,1999,27:1767-1780.
[13]Irwin DW,Kocher TD,Wilson AC,et al.Evolution of the cytochrome b gene of mam-mals[J].J Mol Evol,1991,32:128-144.
[14]Herweredenl V,Blair D,Agatsuma T.Multiple lineages of the mitochondrial gene NADH dehydrogenase subunit 1(ND1)in parasitic helminths:implications for molecular evolutionary studies of facultatively anaerobic eukaryotes[J].J Mol Evol,2000,51(4):339-352.
[15]Anderson TJ,Blouin MS,Beech RN.Population biology of parasitic nematodes:applications of genetic markers[J].Adv Parasitol,1998,41:219-283.
[16]Li MW,Lin RQ,Zhou FC,et al.Study on DNA polymorphism in mitochondrial cox1within and amongToxocaraspecies[J].Chin J Vet Sci Technol,2005,35(5):386-390.(in Chinese)李明伟,林瑞庆,邹丰才,等.弓首蛔虫线粒体cox1基因的多态性研究[J].中国兽医科技,2005,35(5):386-390.
[17]Liu GH,Dai RS,Zhao GH,et al.Cloning and sequence analysis of mitochondrial cytochrome c oxidase subunit 1fromTaenia hydatigenaisolates from Changsha and Xiangxi in Hunan province[J].J Trop Med,2009,9(2):117-120.(in Chinese)刘国华,戴荣四,赵光辉,等.湖南长沙及湘西泡状带绦虫分离株线粒体cox1基因的克隆及序列分析[J].热带医学杂志,2009,9(2):117-120.
[18]Brown GG,Gadaleta G,Pepe G,et al.Structural conservation and variation in the D-loop containing region of vertebrate mitochondrial DNA[J].J Mol Biol,1986,192:503-511.
[19]Yang JK.Analysis of genetic variation ofEchinococcusgranulosuscollected from three provinces in China[J].Chin J Vet Sci Technol,2004,34(9):13.(in Chinese)杨俊克.我国三省区细粒棘球绦虫基因的变异分析[J].中国兽医科技,2004,34(9):13.

