氩氦刀消融兔胆囊侧肝脏病理学观察
湛 晓 牛立志 曾健滢 梁 冰 周 亮 方 刚 李书英 邓春娟 邓春梅
姚 飞 汪 媛 金 利 张 波 杨惠霏 周序珑 李家亮 刘建国 徐克成
中国是原发性肝癌高发的国家,肝癌病死率占 恶性肿瘤的第二位[1]。原发性肝癌手术切除是目前肝癌患者获得长期生存乃至根治的主要方法之一,但能获得手术切除的肝癌患者不足20%。对于不可切除的原发性肝癌,化疗成为最主要的治疗手段,但由于其可能的副作用,其疗效仍然有限。近年来,微创外科与肿瘤局部治疗的兴起为肝癌的治疗开辟了新的方向。如射频消融[2],微波消融[3]与冷冻消融[4]都分别成为不能手术切除肝癌患者的选择之一。其中氩氦刀冷冻技术因其具有创伤小、安全性高等特点已在晚期肝癌治疗中较多应用[5-6]。有报道称肝癌冷冻治疗的不良反应总发生率为15%~20%[7-8],一般为寒战、发热、肝区疼痛与血清酶升高等[9],但对胆囊周边肝肿瘤进行冷冻是否引起胆囊漏尚未明确。有鉴于此,本次研究在白兔肝脏靠近胆囊0.5 cm处进行氩氦刀消融,观察术后7 d肝脏消融区与胆囊的形态改变及病理学改变,以研究冷冻胆囊侧肝肿瘤的安全性及有效性。
材料与方法
一、材料
1.实验动物
普通级新西兰兔3只,雌性,体重范围2.5~3.0 kg,由南方医科大学实验动物中心提供,动物生产许可证号[SCXK(粤)2011-0015],动物合格证号 [粤监证字44002100000654]。
2.主要实验器械与试剂
CryocareTM氩氦刀系统 (美国Endocare公司),包括主机与宽1.4 mm的冷冻探针;监护仪(荷兰Philips公司,型号M8001A),盐酸氯胺酮注射液购自福建古田药业有限公司 (批号为H35020148)。硫酸阿托品注射液购自徐州莱恩药业 (批号为1211112)。
二、方法
1.术前准备及麻醉
动物禁食24 h,禁水12 h。术前在实验兔腿部肌肉注射阿托品(0.02 mg/kg)及盐酸氯胺酮注射液(44 mg/kg)诱导麻醉后,家兔仰卧位固定,在剑突后缘至耻骨前缘备皮,术中在后腿肌肉注射氯胺酮注射液(44 mg/kg)以维持麻醉。
2.氩氦刀消融步骤
麻醉后开腹,暴露肝左上叶,直视下将冷冻探针插入肝脏0.5 cm,使与胆囊壁距离为0.5 cm,设置100%氩气,启动系统,先冷冻2 min,再复温2 min,重复一次冷冻-复温循环,术程共8 min,消融结束后拔出探针即完成氩氦刀消融术。于消融区两端各置一缝线作为标记后结束手术,将脏器回纳腹腔,常规闭腹,待实验兔苏醒后自由饮食,护理期间不给予药物。
3.术中与术后观察
术中观察冷冻消融时肝脏及胆囊表面形态变化,用游标卡尺测量并记录组织表面消融区域最大半径。术后第7天对实验兔实行安乐死,观察肝脏与胆囊冷冻消融区域及周边脏器形态变化。
4.病理检查
取组织标本于福尔马林中固定24 h以上,石蜡包埋,梯度酒精脱水,二甲苯透明,连续切片,厚度5 μm,常规苏木精-伊红染色,封片后镜下观察。
三、统计学处理
实验数据以Graphpad Prism 5(GraphPad,USA)软件进行分析。结果表示为±s,采用t检验。P<0.05表示差异显著。
结 果
一、术中与术后消融区形态观察
1.术中肝脏及胆囊形态变化
冷冻消融结束后可见肝脏与同一侧胆囊形成一白色椭圆形冰球,触感坚硬,边缘清晰。周围组织形态及颜色无异常(图1a)。
2.术后消融区域及周边脏器形态变化
消融7 d后肝脏膈面原消融区可见一个类圆形黄色坏死灶,表面最大径为(2.55±0.78)cm,外周有一圈淡粉红色的分隔带,与周围组织分界明显(图1b);肝脏脏面形成一个类圆形黄色坏死灶(图1c);表面最大径为(2.25±0.35)cm。
1/3实验兔出现胆囊穿孔,直径为1.5 cm (图1d)。 粘连情况:实验兔腹壁(2/3)、膈肌(1/3)、肠系膜(1/3)和结肠(1/3)与肝脏膈面消融区发生小片段浅度粘连。胃壁(1/3)与胆囊脏面消融灶区表面发生严重粘连。
二、病理组织学观察
1.肝脏消融区7 d后组织学观察
广泛肝组织坏死。肝组织结构不完整,肝小叶轮廓隐约可见,肝索和肝板崩解断裂呈空网状,肝窦局部充血、局部有大量退变炎性细胞浸润和少量崩解红细胞。核溶解(图2)。
2.术后7 d胆囊组织学观察
1/3实验兔胆囊壁全层坏死,肌层崩解,黏膜消失,坏死区见大量均一红染物质(图3)。
三、实验室结果观察
血清AST及ALT水平均在术后显著升高。其中AST呈一过性升高,在术后第7d恢复至正常水平(表 1)。
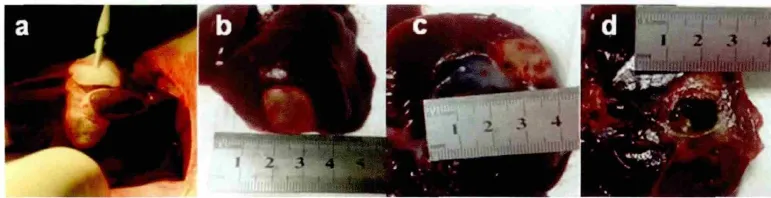
图1 兔肝氩氦刀消融术观察(a.距胆囊边缘0.5 cm插入氩氦刀探针,冷冻术中胆囊周边肝脏消融区出现椭圆形白色冰球;b.消融7 d后肝脏膈面坏死灶;c.消融7 d后肝脏脏面坏死灶;d.胆囊穿孔)

图2 兔肝冷冻消融7天后组织学观察[a.炎细胞反应带:坏死区内可见大量中性粒细胞和淋巴细胞浸润;b.肝组织坏死区:可见凝固性坏死肝组织;c.出血充血区:坏死区内可见少量红细胞;d.肉芽组织:可见较多成纤维细胞增生;e.肝脏组织:肝细胞索排列较整齐,肝窦内可见较多淋巴细胞浸润(HE染色,400×)]
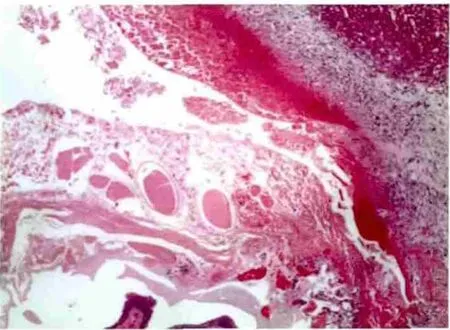
图3 肝冷冻术后7 d胆囊坏死 (HE染色,40×)

表1 兔冷冻胆囊侧肝脏术前后血清转氨酶水平变化 (x± s,U/L)
讨 论
目前,临床上用于实体肿瘤消融的氩氦刀冷冻系统,主要为美国Endocare公司1998年生产的CryocareTM和以色列Galil medical公司2000年生产的Cryo-HitTM氩氦冷冻系统。上述两种氩氦刀冷冻系统原理基本相同,都是利用高压氩气在超导刀尖端快速膨胀时要吸收周围的热量 (焦耳-汤姆逊原理),使周围组织温度迅速下降,通过温度降低与复温,产生直接细胞损伤与间接细胞损伤,引发肿瘤细胞死亡。同时,由于流动血流的温热效应,该技术也可运用于邻近下腔静脉、门静脉等大血管的肿瘤,优势显著。然而,该技术也存在不可忽视的不良反应。如拔针后疼痛出血、肝实质破裂、胸腔渗液、血小板降低、腹腔出血,肝衰竭和急性肾衰竭以及冷休克[9-10]。有文献报道称胆漏发生率为5%~10%,但由于肝脏组织因其血供较为丰富,局部微环境差异较大,而且不同的消融程序对于消融效果影响不同,需要基础实验数据予以支持。
在本次实验中,我们用1.4 mm的冷冻探针,启用100%的氩气对靠近胆囊0.5 cm的肝组织进行冷冻2 min,结果发现胆囊发生穿孔(1/3)。光镜示胆囊壁全层坏死,肌层崩解,黏膜消失,这可能是由于胆管、胆囊没有“热池”效应,以致冷冻过程中被冻伤、冻死。因此,对邻近胆管和胆囊的肿瘤进行冷冻治疗,尤其在合并远端胆管梗阻者,应特别注意预防胆管、胆囊的损伤,以防严重并发症的发生。本研究中,病理结果显示消融中心区广泛肝组织坏死。肝组织结构不完整,肝小叶轮廓隐约可见,肝索和肝板崩解断裂呈空网状,肝窦局部充血、局部有大量退变炎性细胞浸润和少量崩解红细胞。核溶解。且消融区与周边组织分界清晰,表明本次冷冻有效消融胆囊周边肝组织,另外,术后血清AST与ALT的急剧升高也提示了肝细胞冷冻坏死后,细胞内酶释放。该结果与现有的研究结果具有一致性。
总之,本次研究结果显示,消融部位肝脏组织完全坏死,消融灶和周围组织分界明显,但可能发生胆囊漏。因此,对于靠近胆囊的肝脏肿瘤来说,需要做好术前评估,谨慎利用氩氦刀进行治疗,减少胆漏等严重并发症的发生。同时,还需要对该技术进一步研究,从而明确氩氦刀治疗肝癌的适应范围与临床应用价值。
1 Jemal A,Murray T,Ward E,et al.Cancer statistics,2005.CA Cancer J Clin,2005,55(1):10-30.
2 Cucchetti A,Piscaglia F,Cescon M,et al.Systematic review of surgical resection vs radiofrequency ablation for hepatocellular carcinoma.World J Gastroenterol,2013,19(26):4106-4118.
3 Itoh S,Ikeda Y,Kawanaka H,et al.Efficacy of surgical microwave therapy in patients with unresectable hepatocellular carcinoma.Ann Surg Oncol,2011,18(13):3650-3656.
4 Mu F,Niu L,Li H,et al.Percutaneous comprehensive cryoablation for metastatic hepatocellular cancer.Cryobiology,2013,66(1):76-80.
5 Adam R,Majno P,Castaing D,et al.Treatment of irresectable liver tumours by percutaneous cryosurgery.Br J Surg,1998,85(11):1493-1494.
6 Kuang M,Lu M.D,Xie XY,et al.Liver cancer:increased microwave delivery to ablation zone with cooled-shaft antenna--experimental and clinical studies.Radiology,2007,242(3):914-924.
7 Seifert JK,Morris DL.World survey on the complications of hepatic and prostate cryotherapy.World J Surg,1999,23(2):109-113;discussion 113-104.
8 Sarantou T,Bilchik A,Ramming KP.Complications of hepatic cryosurgery.Semin Surg Oncol,1998,14(2):156-162.
9 牛立志,王静,周亮,等.冷冻治疗320例肝癌的并发症分析及处理.中国肿瘤临床与康复,2010,17(6):508-510
10 Pistorius GA,Alexander C,Krisch CM,et al.Local platelet trapping as the cause of thrombocytopenia after hepatic cryotherapy.World J Surg,2005,29(5):657-660;discussion 661.

