氯沙坦对百草枯急性染毒大鼠肺组织氧化损伤的影响
郭 芳,孙应彪,李 盛,苏 莉,刘志飞,赵 迟
(1.兰州大学公共卫生学院,甘肃兰州 730000;2.兰州市疾病预防控制中心,甘肃兰州 730030)
百草枯(paraquat,PQ)属有机杂环类接触性脱叶剂及除草剂,对人畜均有较强毒性,因缺乏特效解毒剂及有效降低毒物毒性的治疗手段,PQ急性中毒是临床常见除草剂急性中毒之一,病死率高达50% ~80%[1]。氧化应激是目前公认的 PQ中毒机制。研究发现,NF-κB作为一个氧化应激敏感型转录因子可被PQ中毒后产生的大量的活性氧(reactive oxygen species,ROS)激活,使机体处于氧化应激状态,活化后的NF-κB还可进一步引起炎症反应和肺组织纤维化的发生[2]。
肾素-血管紧张素(angiotensin,Ang)系统广泛存在于肾、心、肺和肝等组织,能够独自合成AngⅡ,AngⅡ是机体组织纤维化调节器,能够通过AngⅡ1型受体(AngⅡ type 1 receptor,AT1R)的激活诱导肺成纤维细胞的扩散和肺间质胶原蛋白沉积[3-4]。在正常大鼠肺组织中,存在大量 AT1R[5],AngⅡ与AT1R结合可引起肺成纤维细胞的扩散进而引起肺部严重损伤和肺纤维化。氯沙坦作为AT1R拮抗剂,可保护由高氧引起的小鼠肺损伤并抑制肺部纤维化的发生[6]。本研究通过建立PQ急性肺损伤大鼠模型,观察氯沙坦对PQ所致肺组织形态、氧化应激和NF-κB基因表达水平异常变化的干预作用,为临床PQ急性中毒治疗提供新的思路。
1 材料与方法
1.1 实验动物
选择SPF级成年雄性SD大鼠32只,体质量180~220 g,甘肃省中医学院实验动物中心,动物合格证号 SCXK[甘]2011-0001-0001011。
1.2 试剂和仪器
PQ,美国Sigma公司;氯沙坦钾片,杭州默沙东制药有限公司。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、脂质过氧化物(lipid peroxide,LPO)和总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒,南京建成生物工程研究所;Trizol试剂,美国Life Technology公司;NF-κB和β肌动蛋白引物(表1),上海捷瑞生物工程有限公司;逆转录和实时荧光定量PCR试剂盒,大连宝生物工程有限公司。Eon全功能多波段酶标仪,美国BioTek公司;722型分光光度计,上海精密科学仪器有限公司;BX53光学显微镜,日本Olympus公司;SmartSpec Plus核酸蛋白测定仪和 CFX96 Real-Time System,美国 Bio-Rad 公司;Microfuge22R型低温离心机,美国Beckman公司;TC-512型普通PCR仪,北京瑞尔欣德科技有限公司。
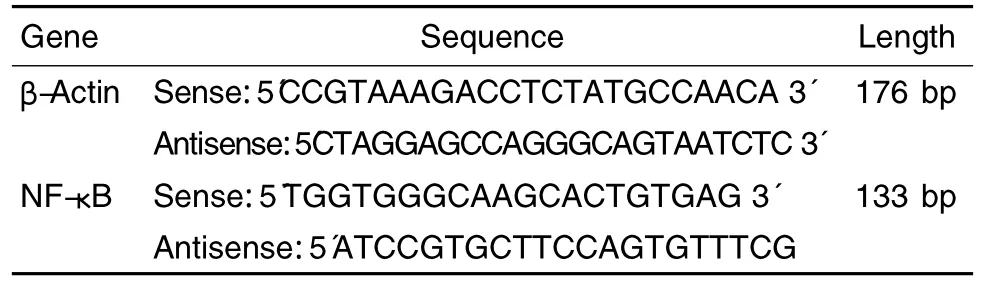
Tab.1 Primer sequences and theoretical amplification lengths
1.3 动物分组和处理
选择32只健康成年雄性SD大鼠随机分为正常对照组、PQ染毒组以及氯沙坦干预7 d(PQ+氯沙坦7 d)和14 d(PQ+氯沙坦14 d)组。正常对照组大鼠每天ig给予生理盐水10 mL·kg-1,连续15 d。PQ染毒组一次性 ig PQ 40 mg·kg-1染毒,此后每天等容积ig给予生理盐水至第15天。氯沙坦干预7和14 d组于一次性ig给予PQ 40 mg·kg-1染毒后次日,根据临床成人每天用药等效剂量ig给予氯沙坦10 mg·kg-1,每天1次,连续7和14 d。
1.4 肺组织病理变化观察
各组大鼠于给药第16天采用颈椎脱位法处死,取右肺中叶用4%多聚甲醛固定,常规制备石蜡切片并行HE染色,观察肺组织病理学改变,以确定急性肺损伤造模是否成功。光学显微镜观察肺组织病理组织学变化。剩余肺组织用无菌生理盐水漂洗后液氮中冻存,用于其他指标检测。
1.5 肺组织匀浆中 T-SOD,CAT,LPO和 T-AOC水平测定
准确称取左侧肺组织,按质量(g):体积(mL)=1∶9的比例加入无菌生理盐水,冰水浴匀浆,1000×g离心10 min,取上清液BCA法检测蛋白质浓度,并根据试剂盒操作步骤检测各项指标,结果用单位质量蛋白质中各指标含量表示。
1.6 大鼠肺组织NF-κB mRNA表达水平检测
取液氮中保存的肺组织约100 mg加入1 mL Trizol于冰浴中匀浆并提取总RNA,用核酸蛋白测定仪测定RNA浓度并确保其A260nm/A280nm在1.8~2.2之间。根据 RNA逆转录试剂盒说明书,选择10 μL反应体系,于 37℃ 15 min,85℃ 5 s,4℃5 min将 RNA逆转录为 cDNA,-20℃保存。以cDNA为模板,用 NF-κB引物进行实时荧光定量PCR扩增,内参照为β肌动蛋白。实时荧光定量PCR反应过程严格按照SYBR Premix Ex TapⅡ试剂盒说明书进行。反应条件为95℃预变性30 s,95℃变性5 s,60℃退火30 s,40个循环。所有样品均采用相同的阈值得到Ct值并采用Pfaffl法[7]计算NF-κB mRNA的相对表达水平。
1.7 统计学分析
2 结果
2.1 氯沙坦干预后大鼠肺组织病理改变
如图1所示,正常对照组肺泡间隔及肺泡腔大小如常,肺泡间隔内未见明显胶原沉积及炎性细胞浸润,间质小血管管壁如常(图1A)。PQ染毒组肺泡间隔弥漫性显著增宽,肺泡腔狭窄或闭合,肺泡间隔及肺间质内大量胶原沉积,成纤维细胞增生,部分区域可见炎性细胞浸润,间质小血管壁增厚,管腔狭窄(图1B)。氯沙坦7 d干预组肺损伤比PQ组减轻,肺间质胶原沉积减少,但多数区域肺间质内仍有成纤维细胞增生,间质小血管管壁仍增厚(图1C)。氯沙坦14 d干预组肺组织多数区域接近正常,肺间质胶原沉积进一步减少,间质小血管管壁轻微增厚(图1D)。
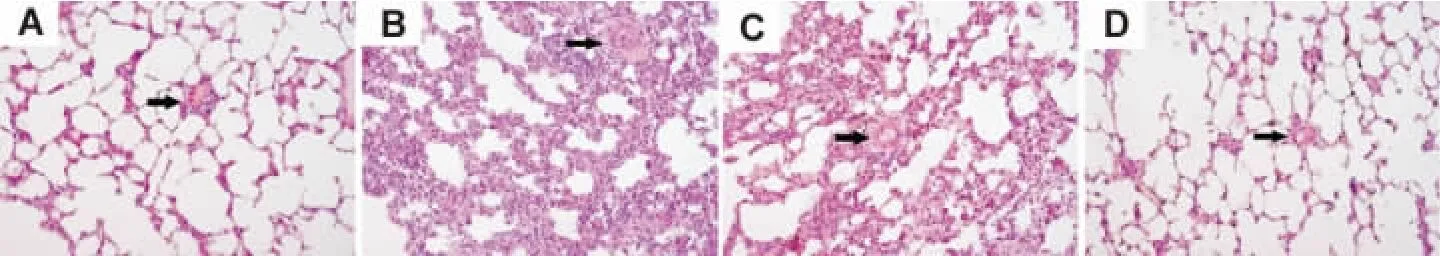
Fig.1 Effect of losartan on paraquat(PQ)induced histopathological changes of lung tissuein rats(HE ×200).The rats were ig given losartan 10 mg·kg -1for 7 and 14 d after being single ig given PQ 40 mg·kg -1.A:normal control group;B:PQ group;C - D:losartan intervention for 7 and 14 d groups,respectively.The arrows show lung interstitial capillary.
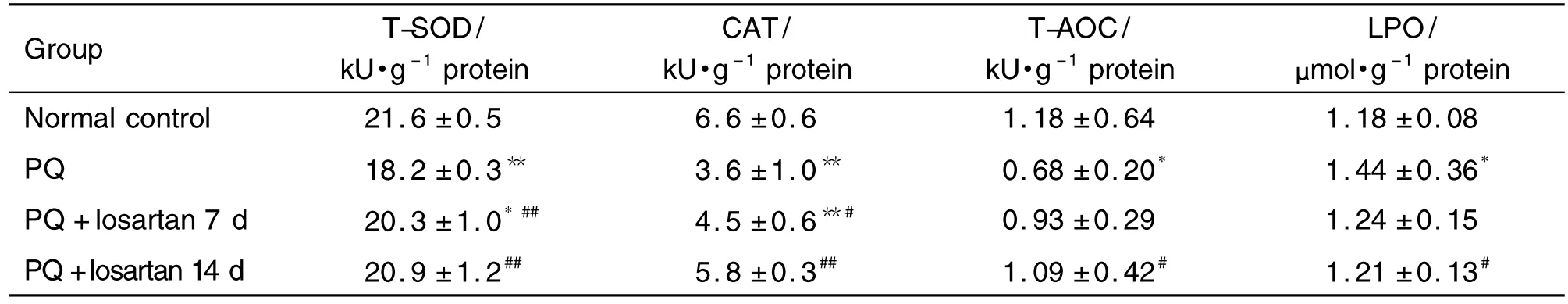
Tab.2 Effect of losartan on oxidative stress change in lung tissues of rats induced by PQ
2.2 氯沙坦干预后大鼠肺组织氧化应激水平的变化
由表2可见,与正常对照组比较,PQ染毒后大鼠肺组织中T-SOD和CAT活性明显降低,T-AOC明显减弱,LPO 含量明显升高(P <0.05,P <0.01)。与PQ染毒组比较,氯沙坦干预7 d大鼠肺组织中T-SOD和CAT活性明显回升(P<0.05,P<0.01),T-AOC活性和LPO含量无明显变化;氯沙坦干预14 d T-SOD和CAT活性及T-AOC均明显升高,LPO 含量明显降低(P <0.05,P <0.01),均恢复接近正常水平。提示氯沙坦对PQ急性染毒大鼠肺组织中 T-SOD,CAT,T-AOC 和 LPO 活性或含量的异常变化具有逆转作用。
2.3 氯沙坦干预后大鼠肺组织NF-κB mRNA表达水平的变化
由图2可见,与正常对照组比较,PQ组大鼠肺组织中 NF-κB mRNA表达水平明显升高(P<0.05)。与PQ染毒组比较,氯沙坦干预7和14 d大鼠肺组织中 NF-κB mRNA含量明显下降(P<0.05),基本恢复接近正常水平。
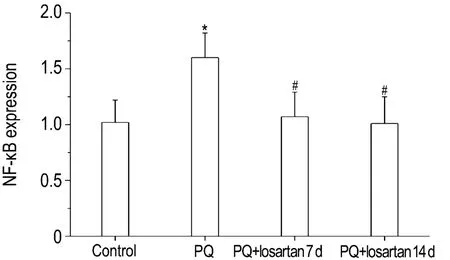
Fig.2 Effect of losartan on NF-κB mRNA expression induced by PQ in lung tissue of rats by real-time quantitative PCR.See Fig.1 for the rat treatment.The NK-κB mRNA expression was analyzed by Pfaffl method.±s,n=8.*P <0.05,compared with normal control group;#P <0.05,compared with PQ group.
3 讨论
据报道,肺泡上皮细胞和气管Clara细胞借助多胺摄取途径将PQ转运入肺并产生大量ROS,导致机体处于氧化应激状态,进而引发链式脂质过氧化反应,使细胞膜受体、膜蛋白酶和离子通道脂质的微环境发生改变,引起肺组织氧化性损伤[8]。正常情况下机体内存在着消除自由基的防御体系,其中SOD和CAT活性直接反映机体清除ROS的能力[9]。据报道,PQ进入人体内后经由NADPH辅助的单电子还原为自由基,该自由基能与氧反应形成超氧阴离子,后者能诱导产生更多的ROS如过氧化氢、羟自由基等,间接使体内SOD活力降低,并诱导产生更多的LPO,最终引起肺泡间质不可逆的纤维化[10-11]。本研究结果表明,PQ染毒组肺组织中SOD和CAT活性明显降低,T-AOC明显减弱,而LPO含量明显升高,提示PQ中毒早期氧化应激损害占有重要地位。
NF-κB属于对氧化还原敏感的Rel蛋白家族。因此,ROS的释放和氧化还原状态的改变可直接激活 NF-κB[12]。被活化的 NF-κB 引起细胞因子网络调控失衡,大量炎性因子的产生导致肺部炎症的发生并最终引起肺纤维化[2]。本研究结果表明,PQ染毒后大鼠肺组织病理改变主要表现为肺泡间隔显著增宽,肺泡腔狭窄或闭合,部分区域可见炎性细胞浸润和胶原蛋白沉积;同时肺组织NF-κB mRNA明显上调。提示NF-κB参与了PQ急性肺损伤过程。
氯沙坦是常见的AT1R拮抗剂,可选择性地作用于AT1R,以阻断内源性和外源性的AngⅡ所产生的各种生理反应。在脂多糖诱导的大鼠肺损伤模型中,氯沙坦干预可显著抑制AT1R和NF-κB活性[13]。此外,氯沙坦可通过抗自由基和阻断AngⅡ的促炎反应治疗平阳霉素引起的大鼠肺损伤[14]。本研究结果表明,随着氯沙坦干预时间的延长,PQ染毒组大鼠肺组织中SOD和CAT活性及T-AOC明显增强,LPO含量明显降低,NF-κB mRNA表达明显降低。肺组织病理观察结果表明,氯沙坦干预14 d肺组织大多数区域未见明显病变,并接近于正常水平。
综上所述,氯沙坦通过增强肺组织的抗氧化能力和降低NF-κB mRNA表达而减轻PQ所致的急性肺损伤,为临床综合治疗PQ急性中毒提供新的思路。
[1]Hwang KY,Lee EY,Hong SY.Paraquat intoxication in Korea[J].Arch Environ Health,2002,57(2):162-166.
[2]Dinis-Oliveira RJ,Sousa C,Remião F,Duarte JA,Navarro AS,Bastos ML,et al.Full survival of paraquat-exposed rats after treatment with sodium salicylate[J].Free Radic Biol Med,2007,42(7):1017-1028.
[3]Marshall RP,McAnulty RJ,Laurent GJ.AngiotensinⅡis mitogenic for human lung fibroblasts via activation of the type 1 receptor[J].Am J Respir Crit Care Med,2000,161(6):1999-2004.
[4]Marshall RP,Gohlke P,Chambers RC,Howell DC,Bottoms SE,Unger T,et al.AngiotensinⅡ and the fibroproliferative response to acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2004,286(1):L156-L164.
[5]Campbell DJ, Kladis A, Valentijn AJ. Effects of losartan on angiotensin and bradykinin peptides and angiotensin-converting enzyme[J].J Cardiovasc Pharmacol,1995,26(2):233-240.
[6]Chou HC, Lang YD, Wang LF, Wu TY,Hsieh YF,Chen CM.AngiotensinⅡ type 1 receptor antagonist attenuates lung fibrosis in hyperoxia-exposed newborn rats[J].J Pharmacol Exp Ther,2012,340(1):169-175.
[7]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res,2001,29(9):e45.
[8]Dinis-Oliveira RJ,De Jesús Valle MJ,Bastos ML,Carvalho F,Sánchez Navarro A.Kinetics of paraquat in the isolated rat lung:influence of sodium depletion[J].Xenobiotica,2006,36(8):724-737.
[9]Mollace V,Iannone M,Muscoli C,Palma E,Granato T,Rispoli V,et al.The role of oxidative stress in paraquat-induced neurotoxicity in rats:protection by non peptidyl superoxide dismutase mimetic[J].Neurosci Lett,2003,335(3):163-166.
[10]Suntres ZE.Role of antioxidants in paraquat toxicity[J].Toxicology,2002,180(1):65-77.
[11]Hagiwara S,Iwasaka H,Matsumoto S,Noguchi T.An antisense oligonucleotide to HSP47 inhibits paraquat-induced pulmonary fibrosis in rats[J].Toxicology,2007,236(3):199-207.
[12]Häcker H,Karin M.Regulation and function of IKK and IKK-related kinases[J].Sci STKE,2006,2006(357):re13.
[13]Liu L,Qiu HB,Yang Y,Wang L,Ding HM,Li HP.Losartan,an antagonist of AT1 receptor for angiotensin Ⅱ, attenuates lipopolysaccharide-induced acute lung injury in rat[J].Arch Biochem Biophys,2009,481(1):131-136.
[14]Yao HW, Zhu JP, Zhao MH, Lu Y. Losartan attenuates bleomycin-induced pulmonary fibrosis in rats[J].Respiration,2006,73(2):236-242.

