膜转运体在肾清除药物过程中的作用研究进展
孙 晨,奇锦峰,张 娜,余文浩,王永辉
(广州中医药大学中药学院药理学教研室,广东广州 510006)
肾在内外源性化合物及其代谢产物的消除及维持机体血压、酸碱平衡中起着至关重要的作用。药物经肾的消除包括肾小球滤过、肾小管分泌和肾小管重吸收。肾小球滤过的机制是直接对药物及外源性物质的超滤作用,转运体不参与此过程[1]。肾近曲小管上富含多种特异性的摄取及外排型转运体参与外源物的排泄,肾小管的分泌和重吸收功能就是通过这一系列位于肾小管上皮细胞基底膜和管腔膜上的转运体来完成的[1]。学者们在21世纪交界前后,在肾近曲小管上发现大量的药物转运蛋白并已成功克隆[2]。人体内的转运体分为2大类:三磷酸腺苷结合盒转运体(ATP-binding cassette transporters,ABC)家族和溶质转运蛋白溶质载体(solute carriers,SLC)家族[3]。迄今人类 ABC 家族转运体由7个亚家族组成,共有49个成员[4];而SLC家族有52个亚家族和384个成员[5]。有文献报道,根据转运底物跨膜方向的不同,将肾的转运体分为摄取型转运体和外排型转运体[6]。摄取型转运体包括有机阴离子转运多肽(organic anion transporting polypeptide,OATP)、有机阳离子转运体(organic cation transporter,OCT)、卡尼汀(肉碱)/有机阳离子转运体(organic carnitine transporter,OCTN)、有机阴离子转运体(organicaniontransporter,OAT)和寡肽转运体(oligopeptide transporter,PEPT)等。外排型转运体包括 P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance associated protein,MRP)、乳癌耐药蛋白(breast cancer resistance protein,BCRP)和多药毒素外排蛋白(multidrug and toxin extrusion protein,MATE)等。本文针对这些转运体的种类、分布、底物、抑制剂及由其引起的药物-药物相互作用进行综述。
1 肾摄取型转运体
1.1 有机阴离子转运多肽
迄今,人类OATP家族(SLCO,旧SLC21)有11个成员[7],但只有 OATP4C1 在肾表达[8],在肾近曲小管基底膜侧介导外源性及内源性阴离子型多肽样化合物从血液向肾小管管腔转运[8]。如地高辛[1]、甲氨蝶呤[8]和 3-雌酮硫酸[1]等物质的分泌(表1)。
OATP4C1有多底物识别位点[9],被认为与外排型转运体 P-gp共同促进地高辛[8]及尿毒性物质[10]等的经肾清除。OATP4C1除了在肾表达外,在其他脏器的分布很少[8-9]。临床上有关OATP4C1引起药物-药物相互作用的报道较少,仍需进一步研究[9,11]。
1.2 SLC 22A家族有机离子转运体
SLC22A家族有机离子转运体有23个成员[22],包括 OCTN 和 OAT[23]。
1.2.1 SLC 22A家族有机阳离子转运体
OCT家族有3个成员[23],分别是OCT1(SLC22A1),OCT2(SLC22A2)和OCT3(SLC22A3),介导结构不同的阳离子型化合物的重吸收及排泄过程。人类OCT1主要表达于肝,而OCT2主要表达于肾[23],OCT3与一些有机阳离子药物进入大脑发挥作用有关,即暂未在肾上表达,OCT2介导有机阳离子型化合物从血液向肾小管管腔细胞转运[23]。
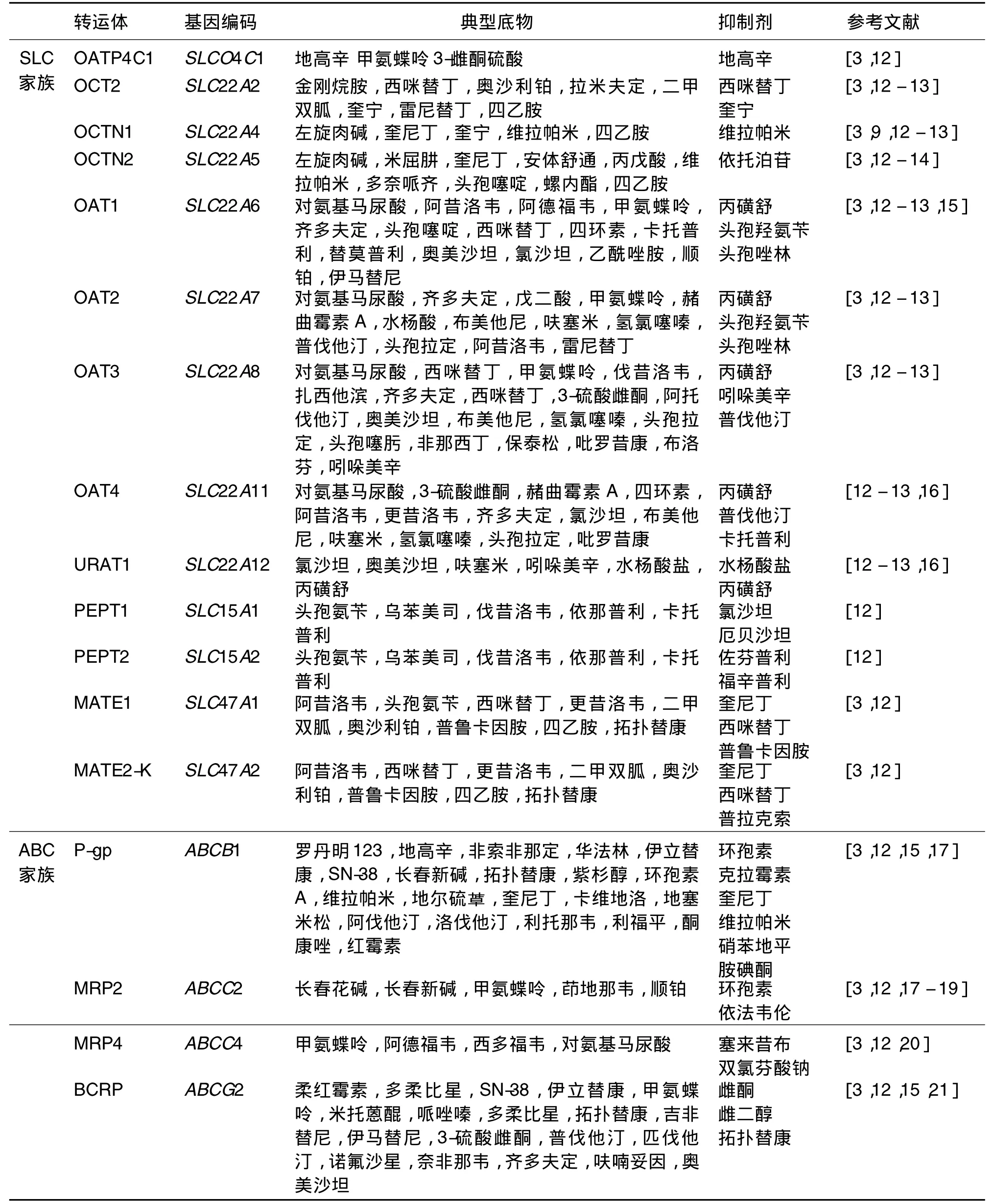
表1 肾性药物转运体及其底物
OCT2的底物一般带有1个或2个正电荷,其成员包括奥沙利铂[12]、组胺H2受体拮抗剂如西咪替丁[12]、抗病毒药如拉米夫定[24]和降糖药二甲双胍[12]等(表 1)。Somogyi等[25]研究发现,二甲双胍与西咪替丁合用后,二甲双胍的AUC增加了50%,清除率下降了27%。这是因为西咪替丁竞争性地抑制肾OCT2对二甲双胍的摄取,使得二甲双胍的血药浓度增加。
1.2.2 卡尼汀/有机阳离子转运体
肾上的OCTN有2个同源转运体OCTN1(SLC22A4)和 OCTN2(SLC22A5)[2]。OCTN1 分布广泛,在肾高度表达,位于肾近曲小管上皮细胞顶侧膜[13],转运有机阳离子型化合物 (表 1)。OCTN1可双向转运化合物,为有机阳离子单向转运体或 H+/有机阳离子逆向转运体[13]。OCTN2为有机阳离子单向转运体或Na+/卡尼汀(肉碱)有机阳离子转运体。人类OCTN2在肾、气管、骨髓、骨骼肌、心脏及胎盘中均有分布[2]。
1.2.3 SLC 22A家族有机阴离子转运体
目前发现的人类肾上表达的OAT有4种[15],即OAT1(SLC22A6)、OAT2(SLC22A7)、OAT3(SLC122A8)、OAT4(SLC22A11)。有研究显示[13]OAT1和OAT3主要分布于肾近曲小管上皮细胞的基底膜侧及大脑脉络丛顶膜侧。人类OAT2和大鼠Oat2较少表达在肾,啮齿类动物的Oat2位于肾近曲小管S3段的顶侧膜,而人类的OAT2位于近曲小管基底膜上,介导有机阴离子由血液向肾小管细胞的转运。OAT4主要分布在肾小管上皮细胞的顶侧膜及胎盘的基底膜侧,主要司职将尿液中的底物物质重吸收入血,OAT4至今未找到鼠类同源物。
研究显示[26],尿酸转运体(urate transporter,URAT1,SLC22A12)位于肾小管近曲小管细胞的顶膜侧。URAT1的氨基酸序列与OAT4有42%同源性。主要介导尿酸盐的转运,及尿酸与阴离子的交换。
肾近曲小管上皮细胞膜基底侧的OAT摄取带负电的有机阴离子进入细胞内并聚集,进而从近曲小管细胞膜的顶膜侧分泌进入尿液中消除[27],这个过程既逆浓度梯度又逆电势梯度。目前认为OAT的转运过程为三级转运机制,Na+/K+-ATP酶始终维持一个向内的(血液-细胞)Na+梯度,形成外高内低的Na+浓度梯度。这种Na+梯度驱使钠-二羧酸根阴离子协同转运蛋白,同向转运Na+和一种内源性有机阴离子,形成内高外低的二羧酸浓度梯度[27-28]。
有研究报道,许多药物的肾毒性与OAT介导的转运过程被抑制有关[29],如β-内酰胺类、抗病毒药、非甾体类抗炎药、甲氨蝶呤、环丙沙星及马兜铃酸[28]等(表 1)。
临床上,丙磺舒与头孢菌素类合用,使得头孢类的肾清除率下降,半衰期和血药浓度增加。这是因为丙磺舒可竞争性地抑制肾OAT对头孢类的摄取,降低肾清除率,减少药物在肾小管细胞中的蓄积,从而显著延长其体内半衰期并降低其肾毒性[19]。
已有研究表明,马兜铃酸导致的肾毒性与OAT被抑制有关[28,30-31]。给小鼠同时灌服马兜铃酸与OAT的专属性抑制剂丙磺舒后,发现马兜铃酸的血药浓度明显增加,肾清除率明显降低,表明马兜铃酸明显抑制OAT介导的有机阴离子的摄取[31]。Xue等[28]观察Oat1和Oat3基因敲除小鼠及其相应野生型小鼠给予马兜铃酸后肾功能的变化,发现基因敲除小鼠的肾功能改变明显轻于野生型小鼠,表明OAT在药物肾毒性中起了重要作用。
1.3 寡肽转运体
PEPT,属SLC15基因家族,表达于小肠及肾小管上皮细胞的刷状缘膜侧,调节寡肽类的吸收[32]。PEPT有2个同源物 PEPT1(SLC15A1)和PEPT2(SLC15A2)。PEPT1为低亲和力、高容量药物转运体,首次由兔的小肠克隆出来,随后在人和大鼠的小肠上发现[2]。大鼠Pept1位于肠上皮细胞的刷状缘侧及近曲小管顶膜侧的 S1段[2]。PEPT2为高亲和力、低负荷药物转运体,主要表达于肾(位于近曲小管S3段上皮细胞的顶侧膜),在脑、肺、脾和乳腺等部位也有分布,在小肠几乎没有分布[2]。PEPT有广泛的底物特异性,包括二肽、三肽,还包括多肽类的药物,如β-内酰胺类、血管紧张素转换酶抑制剂、抗癌药[2,32-33](表 1)。质子偶联是PEPT转运系统的主要特征,即转运底物的能量依赖于胞外较高的H+,酸性环境利于对药物的转运吸收[1]。PEPT2参与86%甘氨酰肌氨酸的重吸收,而 PEPT1 仅占14%[34]。
PEPT2在药物的肾重吸收过程中发挥着不可或缺的作用。Knütter等[35]采用高表达 PEPT2的SKPT细胞测定了二肽模型药物Gly-Sar的摄取情况并考察了沙坦类药物对其的抑制作用。结果表明,各种沙坦类药物可不同程度地抑制Gly-Sar在SKPT细胞中的摄取。其机制为沙坦类药物与二肽在肾排泄过程中竞争PEPT2结合位点,导致二者的重吸收减少。Zhang等[36]的研究结果也表明,当Gly-Sar与头孢妥仑合用后头孢妥仑的肾清除率是单独给药的3.1倍。
2 肾外排型转运体
2.1 P-糖蛋白
P-糖蛋白(P-gp)为多药耐药蛋白,是人类所发现的第一个转运体,因而是目前研究较为透彻的转运体。它主要司职结构各异的各类化合物从细胞内转运外排到细胞外,在体内分布最为广泛,如在小肠、肾、肝、脑及胎盘中均有密集分布[15]。在肾中,位于近曲小管上皮细胞顶侧膜,介导其底物排入尿液[29]。合用奎尼丁后可使地高辛等强心苷类及许多药物的生物利用度增加,胆汁排泄减少[15]。这是由于奎尼丁抑制了肾近端小管上皮细胞的外排性转运体P-gp,使地高辛经肾P-gp的外排性分泌(即清除)受到抑制,重吸收增加,因此导致地高辛的血药浓度明显升高即不良反应加重。临床上极易发生与P-gp有关的药物相互作用,包括许多饮食成分、多种天然产物如葡萄柚和夹竹桃均抑制或诱导P-gp[15,37]。
2.2 多药耐药相关蛋白
人类MRP家族有9个成员(MRP1~MRP9),基因编码为 ABCC1~ABCC6,ABCC10~ABCC12[15]。其中与肾排泄有关的是MRP2(ABCC2)和MRP4(ABCC4),存在于肾小管细胞的顶膜侧,介导其底物从肾小管管腔细胞向肾小管内的排泄过程[18]。MRP2可转运对氨基马尿酸,但与氨基马尿酸的亲和力较低(Km:2 mmol·L-1),相比MRP2,MRP4有着较高的亲和力参与氨基马尿酸的转运(Km:160 μmol·L-1)[2]。实时 PCR 和蛋白印迹实验均表明,MRP4在肾小管的表达是MRP2表达的5倍[38]。表明MRP4在氨基马尿酸及一些亲水性的有机阴离子如尿酸盐、cAMP和cGMP的排泄中起了主要作用[20]。MRP2有较宽的内源性和外源性底物谱,并主要集中于结合型有机阴离子型化合物如内源性糖醛酸结合物、类固醇激素的葡糖醛酸及硫酸结合物、谷胱甘肽结合物以及其他外源物的Ⅱ相代谢物等的排泄[18]。MRP4与甲氨蝶呤及抗病毒药如阿德福韦、西多福韦等的排泄有关[19]。经MRP介导的药物相互作用的研究目前主要在肠道及肝代谢方面,在肾排泄方面的研究的报道很少[15]。
2.3 乳癌耐药蛋白转运体
BCRP(ABCG2)是ABC转运体家族中的重要成员之一,在小肠、肝、肾、胎盘以及血脑屏障等处有广泛分布,在药物的吸收、分布与排泄过程中发挥重要作用。在肾中,BCRP表达于肾小管上皮细胞顶膜侧,介导众多药物从管腔细胞向管腔中的分泌[15](表1)。
Jonker等[39]给 BCRP 基因敲除(-/-)的小鼠同时灌服BCRP抑制剂依克立达与BCRP底物拓扑替康,结果使拓扑替康的体内分布是未敲除前的7倍。Kruijtzer等[15]在癌症患者的研究显示,依克立达使拓扑替康的口服生物利用度从40%增加到97%。
2.4 多药毒素外排转运体
MATE是一种H+/有机阳离子共轭转运体,属于外排型转运体[15]。人类 MATE有2个成员,分别 为 MATE1(SLC47A1)[40]和 MATE2-K(SLC47A2)[41]。人类 MATE1 在肾和肝都有表达[40]。人类MATE2-K主要在肾表达,在结肠和睾丸也有少量表达[41]。
体外研究发现,MATE1和MATE2与OCT有相似的抑制剂和底物[42-43],两者共同的内源性底物包括有机阳离子胍类药物、维生素B1、N-甲基烟酰胺和肌酐等。迄今为止,>30种临床药物已被证实为MATE1和MATE2的底物或抑制剂,包括西咪替丁、阿昔洛韦、二甲双胍、普鲁卡因胺和拓扑替康[3,12](表 1)。
Kusuhara等[44]给健康志愿者乙胺嘧啶后再给予治疗量的口服降糖药二甲双胍,其代谢物N-甲基烟酰胺(为MATE1,MATE2的底物的血药浓度)的清除率明显下降,这很可能是乙胺嘧啶抑制了MATE介导的该药的肾排泄[45]。
3 展望
近10年来,美国FDA十分强调代谢性药-药相互作用(metabolic DDI)。2004年出版了药物相互作用的Concept Paper[46],正式提出代谢性药物相互作用在临床用药中的重要性。两年后就向全球颁发了DDI研究指南(草案),2012年又对其进行了较大的修订和改进[47]。代谢性DDI主要有2个方面,即基于P450的DDI和源于转运体的DDI[47]。
肾的摄取型和外排型2类转运体在以药物、毒物为主的外源物的清除过程中发挥着不可替代的作用,研究这些转运体的生物学特性对于了解药物的与药物的体内过程有关的不良反应具有重要意义。国际转运体联盟建议(2010年)、FDA批准(2012年)[47]的与临床药物治疗密切相关的7个转运体[12]中,有4个分布在肾,充分说明关注肾转运体的必要性及迫切性。
近年来大量科学研究发现,与转运体有关的DDI几乎见于大部分药物治疗的临床实践。例如,天然产物中种类繁多的黄酮类和有机酸等成分为人类的日常饮食且多与OAT有关,使得药物-饮食相互作用变得不可避免。平衡利害关系,减少或避免药物不良反应,提高疗效是最大目标。深入研究肾的药物转运体,不仅有利于加深对药物转运机制的了解、为新药开发提供药代依据,而且对防范可能的、由药物-转运体相互作用引发的不良反应、以及从分子水平阐明某些毒性反应的机制,促进临床更加合理用药具有现实意义。
[1]Zhang J,Liu KX.Intestinal absorption and renal excretion mediated by transporters and the relationship with drug-drug interaction [J]. Acta Pharm Sin(药学学报),2010,45(9):1089-1094.
[2]Anzai N,Endou H.Drug transport in the kidney[C]∥Proc 6th World Congress on Alternatives&Animal Use in the Life Science.Tokyo,Japan 2007.AATEX 14,Special issue:447-452.
[3]Morrissey KM,Stocker SL,Wittwer MB,Xu L,Giacomini KM.Renal transporters in drug development[J].Annu Rev Pharmacol Toxicol,2013,53:503-529.
[4]Huls M,Russel FG,Masereeuw R.The role of ATP binding cassette transporters in tissue defense and organ regeneration[J].J Pharmacol Exp Ther,2009,328(1):3-9.
[5]Schlessinger A,Yee SW,Sali A,Giacomini KM.SLC classification:an update[J].Clin Pharmacol Ther,2013,94(1):19-23.
[6]Morrissey KM, Wen CC, Johns SJ, Zhang L,Huang SM,Giacomini KM.The UCSF-FDA Trans-Portal:a public drug transporter database[J].Clin Pharmacol Ther,2012,92(5):545-546.
[7]Hagenbuch B,Meier PJ.Organic anion transporting polypeptides of the OATP/SLC21 family:phylogenetic classification as OATP/SLCO superfamily,new nomenclature and molecular/functional properties[J].Pflugers Arch,2004,447(5):653-665.
[8]Mikkaichi T,Suzuki T,Onogawa T,Tanemoto M,Mizutamari H,Okada M,et al.Isolation and characterization of a digoxin transporter and its rat homologue expressed in the kidney[J].Proc Natl Acad Sci USA,2004,101(10):3569-3574.
[9]Kuo KL,Zhu H,McNamara PJ,Leggas M.Localization and functional characterization of the rat Oatp4c1 transporter in an in vitro cell system and rat tissues[J].PLoS One,2012,7(6):e39641.
[10]Toyohara T,Suzuki T,Morimoto R,Akiyama Y,Souma T,Shiwaku HO,et al.SLCO4C1 transporter eliminates uremic toxins and attenuates hypertension and renal inflammation[J].J Am Soc Nephrol,2009,20(12):2546-2555.
[11]Roth M,Obaidat A,Hagenbuch B.OATPs,OATs and OCTs:the organic anion and cation transporters of the SLCO and SLC22A gene superfamilies[J].Br J Pharmacol,2012,165(5):1260-1287.
[12]International Transporter Consortium,Giacomini KM,Huang SM,Tweedie DJ,Benet LZ,Brouwer KL,et al.Membrane transporters in drug development[J].Nat Rev Drug Discov,2010,9(3):215-236.
[13]Klaassen CD,Aleksunes LM.Xenobiotic,bile acid,and cholesterol transporters:function and regulation[J].Pharmacol Rev,2010,62(1):1-96.
[14]Hu C,Lancaster CS,Zuo Z,Hu S,Chen Z,Rubnitz JE,et al.Inhibition of OCTN2-mediated transport of carnitine by etoposide[J].Mol Cancer Ther,2012,11(4):921-929.
[15]König J,Müller F,Fromm MF.Transporters and drug-drug interactions:important determinants of drug disposition and effects[J].Pharmacol Rev,2013,65(3):944-966.
[16]Burckhardt G,Burckhardt BC.In vitro and in vivo evidence of the importance of organic anion transporters(OATs)in drug therapy[J].Handb Exp Pharmacol,2011,(201):29-104.
[17]Marchetti S,Mazzanti R,Beijnen JH,Schellens JH.Concise review:Clinical relevance of drug drug and herb drug interactions mediated by the ABC transporter ABCB1(MDR1,P-glycoprotein)[J].Oncologist,2007,12(8):927-941.
[18]Keppler D.Multidrug resistance proteins(MRPs,ABCCs):importanceforpathophysiologyand drug therapy[J].Handb Exp Pharmacol,2011,(201):299-323.
[19]Feng B,LaPerle JL,Chang G,Varma MV.Renal clearance in drug discovery and development:molecular descriptors,drug transporters and disease state[J].Expert Opin Drug Metab Toxicol,2010,6(8):939-952.
[20]Van Aubel RA,Smeets PH,van den Heuvel JJ,Russel FG.Humanorganicaniontransporter MRP4(ABCC4)is an efflux pump for the purine end metabolite urate with multiple allosteric substrate binding sites[J].Am J Physiol Renal Physiol,2005,288(2):F327-F333.
[21]Jani M,Makai I,Kis E,Szabó P,Nagy T,Krajcsi P,et al.Ivermectin interacts with human ABCG2[J].J Pharm Sci,2011,100(1):94-97.
[22]Yacovino LL,Aleksunes LM.Endocrine and metabolic regulation of renal drug transporters[J].J Biochem Mol Toxicol,2012,26(10):407-421.
[23]Ma L,Rao Z,Wu XA.The role of drug transporters in drug excretion[J].Chin Pharm J(中国药学杂志),2013,48(8):582-586.
[24]Jung N,Lehmann C,Rubbert A,Knispel M,Hartmann P,van Lunzen J,et al.Relevance of the organic cation transporters 1 and 2 for antiretroviral drug therapy in human immunodeficiency virus infection[J].Drug Metab Dispos,2008,36(8):1616-1623.
[25]Somogyi A,Stockley C,Keal J,Rolan P,Bochner F.Reduction of metformin renal tubular secretion by cimetidine in man[J].Br J Clin Pharmacol,1987,23(5):545-551.
[26]Yang CH,Glover KP,Han X.Characterization of cellular uptake of perfluorooctanoate via organic anion-transporting polypeptide 1A2,organic anion transporter 4,and urate transporter 1 for their potential roles in mediating human renal reabsorption of perfluorocarboxylates[J].Toxicol Sci,2010,117(2):294-302.
[27]You G.Towards an understanding of organic anion transporters:structure-function relationships[J].Med Res Rev,2004,24(6):762-774.
[28]Xue X,Gong LK,Maeda K,Luan Y,Qi XM,Sugiyama Y,et al.Critical role of organic anion transporters 1 and 3 in kidney accumulation and toxicity of aristolochic acid I[J].Mol Pharm,2011,8(6):2183-2192.
[29]Hagos Y, Wolff NA. Assessmentof the role of renal organic anion transporters in drug-induced nephrotoxicity[J].Toxins(Basel),2010,2(8):2055-2082.
[30]Bakhiya N,Arlt VM,Bahn A,Burckhardt G,Phillips DH,Glatt H.Molecular evidence for an involvement of organic anion transporters(OATs)in aristolochic acid nephropathy[J].Toxicology,2009,264(1-2):74-79.
[31]Babu E,Takeda M,Nishida R,Noshiro-Kofuji R,Yoshida M,Ueda S,et al.Interactions of human organic anion transporters with aristolochic acids[J].J Pharmacol Sci,2010,113(2):192-196.
[32]Terada T,Sawada K,Irie M,Saito H,Hashimoto Y,Inui K.Structural requirements for determining the substrate affinity of peptide transporters PEPT1 and PEPT2[J].Pflugers Arch,2000,440(5):679-684.
[33]Daniel H, Kottra G. The proton oligopeptide cotransporter familySLC15 in physiologyand pharmacology[J].Pflugers Arch,2004,447(5):610-618.
[34]Ocheltree SM,Shen H,Hu Y,Keep RF,Smith DE.Role and relevance of peptide transporter 2(PEPT2)in the kidney and choroid plexus:in vivo studies with glycylsarcosine in wild-type and PEPT2 knockout mice[J].J Pharmacol Exp T-her,2005,315(1):240-247.
[35]Knütter I,Kottra G,Fischer W,Daniel H,Brandsch M.High-affinity interaction of sartans with H+/peptide transporters[J].Drug Metab Dispos,2009,37(1):143-149.
[36]Zhang Q,Liu Q,Wu J,Wang C,Peng J,Ma X,et al.PEPT1 involved in the uptake and transepithelial transport of cefditoren in vivo and in vitro[J].Eur J Pharmacol,2009,612(1-3):9-14.
[37]Rodríguez-Fragoso L, Martínez-Arismendi JL,Orozco-Bustos D,Reyes-Esparza J,Torres E,Burchiel SW.Potential risks resulting from fruit/vegetable-drug interactions:effects on drug-metabolizing enzymes and drug transporters[J].J Food Sci,2011,76(4):R112-R124.
[38]Smeets PH,van Aubel RA,Wouterse AC,van den Heuvel JJ,Russel FG.Contribution of multidrug resistance protein 2(MRP2/ABCC2)to the renal excretion of p-aminohippurate(PAH)and identification of MRP4(ABCC4)as a novel PAH transporter[J].J Am Soc Nephrol,2004,15(11):2828-2835.
[39]Duan P,You G.Novobiocin is a potent inhibitor for human organic anion transporters[J].Drug Metab Dispos,2009,37(6):1203-1210.
[40]Otsuka M,Matsumoto T,Morimoto R,Arioka S,Omote H,Moriyama Y.A human transporter protein that mediates the final excretion step for toxic organic cations[J].Proc Natl Acad Sci USA,2005,102(50):17923-17928.
[41]Masuda S,Terada T,Yonezawa A,Tanihara Y,Kishimoto K,Katsura T,et al.Identification and functional characterization of a new human kidneyspecific H+/organic cation antiporter,kidney-specific multidrug and toxin extrusion 2[J].J Am Soc Nephrol,2006,17(8):2127-2135.
[42]Damme K,Nies AT,Schaeffeler E,Schwab M.Mammalian MATE(SLC47A)transport proteins:impact on efflux of endogenous substrates and xenobiotics[J].Drug Metab Rev,2011,43(4):499-523.
[43]Nies AT,Koepsell H,Damme K,Schwab M.Organic cation transporters(OCTs,MATEs),in vitro and in vivo evidence for the importance in drug therapy[J].Handb Exp Pharmacol,2011,(201):105-167.
[44]Kusuhara H,Ito S,Kumagai Y,Jiang M,Shirosh-ita T,Moriyama Y,et al.Effects of a MATE protein inhibitor,pyrimethamine,on the renal elimination of metformin at oral microdose and at therapeutic dose in healthy subjects[J].Clin Pharmacol Ther,2011,89(6):837-844.
[45]Ito S,Kusuhara H,Kumagai Y,Moriyama Y,Inoue K,Kondo T,et al.N-methylnicotinamide is an endogenous probe for evaluation of drug-drug interactions involving multidrug and toxin extrusions(MATE1 and MATE2-K)[J].Clin Pharmacol Ther,2012,92(5):635-641.
[46]Drug Development and Drug Interactions:Publications[EB/OL].http://www.fda.gov/Drugs/Development Approval Process/Development Resources/DrugInteractions Labeling/ucm091806.htm,2013.9.15.
[47]Drug Development and Drug Interactions:Regulatory Guidance and Manual for Policies and Procedures[EB/OL].http://www.fda.gov/Drugs/Development ApprovalProcess/Development Resources/DrugInteractions Labeling/ucm093606.htm,2013.9.15.

