固定化菌株DF51对小麦幼苗的苯酚污染修复
张谨华,王慧阳,邵青玲,武玉珍
(晋中学院生物科学与技术学院,山西晋中 030600)
小麦是禾本科小麦属植物的统称,在世界各地广泛种植.小麦中碳水化合物约占75%,蛋白质约占10%,它富含淀粉、蛋白质、脂肪、矿物质、钙、铁、硫胺素、核黄素、烟酸、维生素A及维生素C等.2010年,小麦是世界上总产量位居第二的粮食作物(6.51亿吨),仅次于玉米(8.44亿吨).苯酚是农药、化学品的重要的工业生产原料[1],是工业废水的主要污染物之一.国内对苯酚毒性的研究较多,主要有鱼类的急性毒性实验[2,3]、以苯酚为原材料合成的双酚A等毒理性研究[4,5],而对于植物方面的研究则相对较少,彭永康等[6]报道过,40mg/L的苯酚溶液对黄瓜、番茄等蔬菜种子的萌发以及主胚根的生长有抑制作用,祁忠占等[7]对小麦受到苯酚毒害后多酚氧化酶同工酶活性进行了研究,覃广泉等[8]对菜心受苯酚胁迫进行了报道.目前对苯酚对小麦幼苗株高及SOD等酶活性的影响的评价较少.本实验通过苯酚与固定化菌株DF51处理土壤,研究了苯酚与固定化菌株DF51配合施用对小麦幼苗净光合速率(Pn)、胞间CO2浓度(Ci)、叶绿素相对含量(CCI)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等的影响.为评价固定化菌株DF51对苯酚污染土壤的修复及其对小麦幼苗的影响,进一步探讨固定化菌株DF51增强苯酚胁迫下小麦耐性的作用机理提供理论依据.
1 材料与方法
1.1 供试材料
普通小麦(晋麦47)种子由山西农业大学作物化学调控中心提供;苯酚为分析纯试剂,固定化的苯酚降解菌株DF51均由晋中学院生物科学与技术学院微生物实验室提供.
1.2 试验设计
试验于2012年5月至2013年10月在晋中开发区农业试验田小麦小区进行,试验地为黄土状母质上发育的碳酸盐褐土,水浇地.耕层(0~20 cm)土壤含有机质1.74 g/kg,全氮0.0636 g/kg,速效磷6.69mg/kg,速效钾185.2mg/kg,pH值7.68.采用随机区组设计,小区面积为6m2(3m×2m),种植密度90000株/hm2,每小区54株,3次重复,田间管理同大田.
试验采用随机区组试验设计,苯酚与固定化菌株施用时与耕层土壤混匀.苯酚P设4个P处理质量浓度(浓度以风干土壤计):P0(0μg/g)、P1(50μg/g)、P2(100μg/g)、P3(150μg/g)、P4(200μg/g);固定化菌株DF51设5个D处理水平:D0(0 kga.i./hm2)、D1(10 kga.i./hm2)、D2(20 kga.i./hm2)、D3(30 kga.i./hm2)、D4(40 kga.i./hm2).
1.3 测定指标及方法
取冬小麦幼苗为材料,用SPAD-250、光合仪CI-340分别测定叶片叶绿素含量与光合特性;同时取叶片测定SOD、POD活性[8];取均值.用Statistical Analysis System(SAS)和Microsoft Excel(Office 2003)软件进行显著性分析,Duncan新复极差法多重比较分析在0.05水平上进行.
2 结果与分析
2.1 苯酚污染及修复对小麦幼苗叶绿素含量的影响
图1可知,随苯酚浓度的升高CCI呈显著降低趋势;单施固定化菌株DF51时,随固定化菌株DF51浓度的增加对
CCI的影响均不显著;同时施用苯酚和固定化菌株DF51时,随固定化菌株DF51浓度的增加CCI呈不同程度的上升趋势,处理之间差异显著.经方差分析和Duncan新复极
差法多重比较可知:苯酚和固定化菌株的交互作用对CCI的影响达到显著水平.说明苯酚对小麦幼苗造成胁迫,使其叶片的叶绿素含量降低;固定化菌株DF51可增加苯酚胁迫下小麦幼苗的CCI;不同的苯酚水平以D4处理时CCI最大,苯酚处理浓度越低CCI越大.表明固定化菌株DF51可增强苯酚胁迫下小麦幼苗的叶绿素含量.

图1 苯酚污染及修复对小麦幼苗叶绿素含量的影响
2.2 苯酚污染及修复对小麦幼苗Pn和Ci的影响
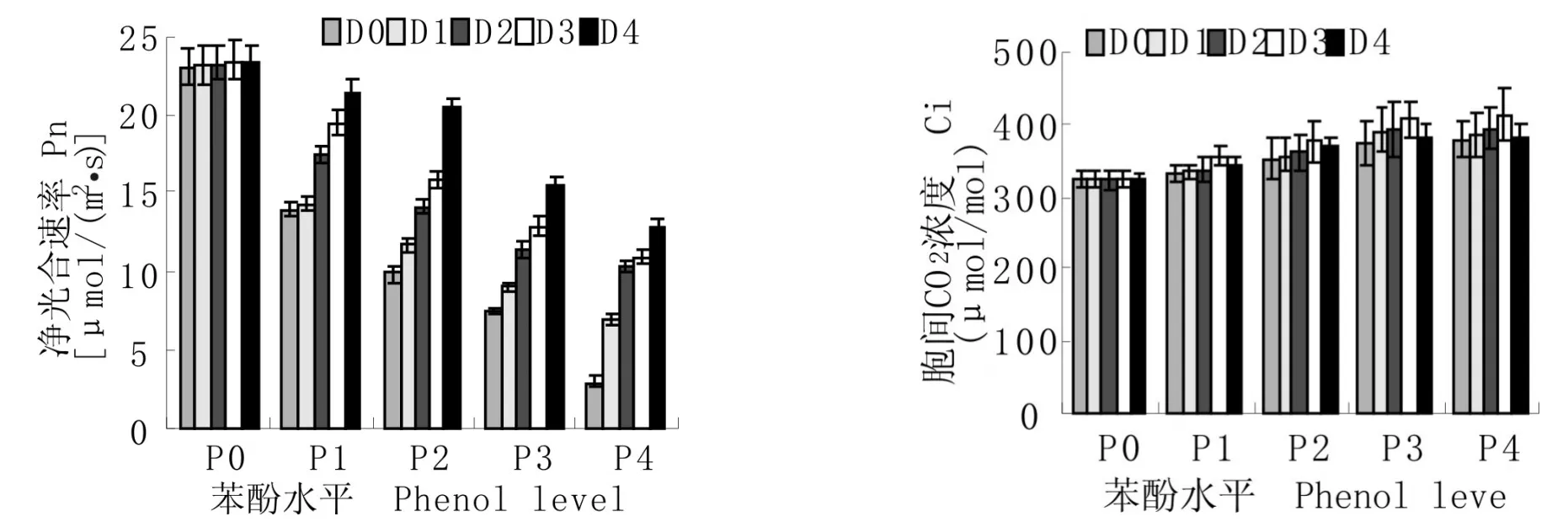
图2 苯酚污染及修复对小麦幼苗光合特性指标的影响
图2可知,随苯酚浓度的升高Pn呈显著降低趋势,Ci呈显著上升趋势;单施固定化菌株DF51时,随固定化菌株DF51浓度的增加对Pn、Ci的影响均不显著;同时施用苯酚和固定化菌株DF51时,随固定化菌株DF51浓度的增加Pn、Ci呈不同程度的上升趋势,处理之间差异极显著.经方差分析和Duncan新复极差法多重比较可知:苯酚和固定化菌株的交互作用对Pn的影响达到极显著水平,对Ci影响不显著.说明苯酚对小麦幼苗造成胁迫,使其叶片的光合速率降低;固定化菌株DF51可增加苯酚胁迫下小麦幼苗的Pn;不同的苯酚水平均以D4处理时CCI和Pn最大,且P1D4、P2D4处理与对照P0D0无显著性差异,苯酚处理浓度越低Pn越大.这表明小麦幼苗光合速率降低的主要原因不是由于CO2供应不足,而是由于叶肉细胞光合活性降低引起的碳氮代谢失调,同化力(即ATP和NADPH)供应不足,限制了光合碳同化[9];固定化菌株DF51可增强苯酚胁迫下小麦幼苗的光合特性,在P1D4、P2D4处理下可恢复到正常水平.
2.3 苯酚污染及修复对小麦幼苗S O D活性的影响
SOD活性高低可反映植株自身清除有害物质能力的强弱.由图2可知,SOD活性随苯酚浓度的升高呈显著下降趋势,单施固定化菌株DF51时,随固定化菌株DF51浓度的增加对SOD的影响不显著;同时施用苯酚和固定化菌株DF51时,随固定化菌株DF51浓度的增加SOD呈不同程度的上升趋势,处理之间差异极显著.表明苯酚对小麦幼苗的SOD活性具抑制作用,固定化菌株DF51可使小麦幼苗的的抗逆性增高,以抵抗不良外界环境条件.
2.4 苯酚污染及修复对小麦幼苗P O D活性的影响
过氧化物酶(POD)是植物抗逆性活性较高的一种酶,其具有双重作用.它既与光合作用、呼吸作用、生长素的氧化等密切相关,同时又与清除细胞内的H2O2,解除植物逆境胁迫时产生的活性氧伤害有密切关系.研究表明,POD活性对环境因子的变化相当敏感,植物在遭受逆境(如水分、农药、盐等逆境)时,POD活性与同工酶都会作出快速反应[10,11].图2看出,单施苯酚(D0水平)时,随苯酚浓度的升高POD值呈先增高后降低的趋势,P2处达到峰值.这是因为小麦体内的POD酶可通过提升活力来抵御低浓度苯酚胁迫(P1、P2)对其产生的危害,但随着苯酚浓度的增加,POD活力开始下降,低于对照,这可能是胁迫加重超过了POD的调节能力,此时小麦幼苗已受到氧化损伤.单施固定化菌株DF51时,随固定化菌株DF51浓度的增加对POD的影响均不显著.同时施用苯酚和固定化菌株DF51时,随固定化菌株DF51浓度的升高POD值呈增高趋势;D2、D3、D4水平时随苯酚浓度的升高POD值呈上升趋势,而D1水平时随苯酚浓度的升高POD值呈先增高后降低的趋势,P3处达到峰值,处理之间差异极显著,这是由于低浓度的固定化菌株DF51(D1水平)对土壤中苯酚的去除率较低,因此不能提高P4水平胁迫时POD的活性,导致小麦幼苗受到氧化损伤.表明固定化菌株DF51可通过增加小麦幼苗的抗氧化酶活性来增强其对低浓度苯酚胁迫的耐性.

图3 苯酚污染及修复对小麦幼苗SOD活性的影响
3 讨论与结论
苯酚降解菌DF51的降解作用是清除环境中有机污染物苯酚的有效途径之一.本试验发现,固定化菌株DF51可降解土壤中的苯酚.本实验表明固定化菌株DF51对苯酚胁迫下的小麦幼苗的生长和生理特性影响显著,在生产实践中施用固定化菌株DF51可预防和补救小麦植株在苯酚胁迫下受损,促进叶片制造更多的光合产物,增强小麦生产的安全性.
固定化菌株DF51对小麦幼苗的抗逆性指标影响显著,提高了小麦幼苗在苯酚胁迫下SOD、POD的活性,从而使自身抗逆性提高,同时促进了小麦的光合作用.单施苯酚处理时,显著降低了小麦的光合特性;超氧化物歧化酶活性呈降低趋势、过氧化物酶活性呈先上升后下降趋势,P2处为高峰.同时施用苯酚和固定化菌株DF51时,固定化菌株DF51可去除土壤中的苯酚,提高的小麦光合特性(CCI、Pn增加)和抗逆性(SOD、POD活性增加).但在高浓度苯酚污染区施用低浓度的固定化菌株DF51处理(P4D1处理)的小麦有不结籽现象.固定化菌株DF51能显著提高小麦幼苗在苯酚胁迫下的耐性,提高幼苗Pn,促进植株生长,这些效应与其提高抗氧化酶活性有关.固定化菌株DF51的施药模式可修复苯酚污染的大田,可用作苯酚污染土壤的修复途径.

图4 苯酚污染及修复对小麦幼苗POD活性的影响
根据Farquhar等[9]的观点,当气孔导度与Ci同时下降时,光合速率下降主要是由气孔限制引起的,Pn降低伴随Ci的升高时,光合作用的主要限制因素是非气孔因素.据此推断,本试验条件下Pn的降低是由非气孔因素引起的,也就是光合碳同化力不足,碳氮代谢失调引起的.这可能是叶肉细胞光合活性的下降造成的,如叶绿素含量降低、光合羧化酶Rubisco活性下降、光合电子传递活性降低等,具体原因和内在机理还有待进一步的研究.
[1]李玉芳.国内外苯酚生产技术进展[J].中国石油和化工,2004(8):40~41.
[2]鲁义善,余坦健,吴灶和,等.苯酚对奥尼罗非鱼非特异性免疫指标的影响[J].广东海洋大学学报,2011,31(1):52~57.
[3]石洪玥,姜志强,高小强,等.苯酚对红鳍东方鲀幼鱼的急性毒性及对肝脏抗氧化酶的影响[J].吉林农业大学学报,2012,34(6):682~687.
[4]邱志勇,周青,王丽红.双酚A对大豆幼苗叶绿素合成中间产物的影响[J].农业环境科学学报,2012,31(8):1664.
[5]李曼,王丽红,周青.双酚A对大豆幼苗叶绿素荧光参数的影响[J].农业环境科学学报,2012,31(6):1256~1256.
[6]彭永康,祁忠占,宋玖雪,等.苯酚对蔬菜幼苗生长及氧化酶同工酶的影响[J].环境科学学报,1990(4):501~505.
[7]祁忠占,彭永康,宋玖雪,等.不同浓度苯酚溶液对小麦根系生长及几种氧化酶同工酶的影响[J].农业环境科学学报,1990(2):17~19.
[8]邹琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[9]FARQUHARDG,SHARKEY TD.Stomatal Conductance and Photosynthesis[J].Annu Rev PlantPhysiol,1982,33(1):317~345.
[10]刘轶鸥,王岩,刘波,等.O3浓度升高和UV-B辐射增强对大豆叶片抗氧化酶活性及POD同工酶的影响[J].大豆科学,2013,32(2):202~205.
[11]吴建勋,张姗姗.Cr、Co、Pb单一胁迫对浮萍SOD、POD、MDA的影响[J].中国农学通报,2013,29(15):188~194.

