多条溶出曲线评价奥美沙坦酯片的质量
胡士现,杨 宁,蒋成猛,晏 芳
(昆明源瑞制药有限公司研发中心,云南昆明651701)
奥美沙坦酯由日本Sankyo和美国Forest Laboratories开发,2002年5月以商品名Benicar在美国上市,同年8月在德国获批准并在10月初以Olmetec上市之后得到英国、奥地利、荷兰、希腊、西班牙、丹麦、挪威、芬兰、法国、比利时、葡萄牙等多个欧盟国家的认可,用于治疗高血压。本品上市剂型为片剂,规格为5 mg、20 mg、40 mg 3种。于2006年8月在我国上市,商品名“傲坦”。该药是一种新的血管紧张素Ⅱ受体抑制剂,该药对不同程度的高血压病人均有很好的疗效。奥美沙坦酯难溶于水,药物的溶出直接影响药物在体内的吸收和利用,因此要对其进行溶出度检测,溶出度试验技术不仅已作为评价固体制剂内在质量的一种重要手段[1],也是一种评价药物在体内释放和吸收的有效手段[2]。溶出度试验的深入全面研究以及溶出曲线的精确客观绘制,既可初步为体内生物利用度研究提供参考,也可以揭示各制剂工艺的差别和内在品质的优劣。本文以国外上市的制剂为参比制剂,考察自制奥美沙坦酯片在不同溶出介质中的溶出行为,并采用相似因子法评价药品的内在质量。
1 实验材料与仪器
奥美沙坦酯片参比制剂:批号110 010,第一三共制药(上海)有限公司;奥美沙坦酯片:批号20 120 201、20 120 202、20 120 203,昆明源瑞制药有限公司自制;奥美沙坦酯对照品:中国药品生物制品检定所,批号100 864-200 601,质量分数99.0%;乙腈:Merck KgaA,HPLC级;磷酸二氢钾,AR,天津市风船化学试剂科技有限公司;氢氧化钠:AR,国药集团化学试剂有限公司;水为纯化水。
Sartorius CPA225D十万分之一电子天平:德国赛多利斯;ZRS-8G智能溶出试验仪:天津天大天发科技有限公司;1 700型紫外分光光度仪:日本岛津公司。
2 实验方法
2.1 溶出度测定方法
参照奥美沙坦酯片(YBH06992006)质量标准溶出度项下的方法,取奥美沙坦酯片,按照溶出度测定法(中国药典2010年版二部附录XC第二法)[3],以磷酸盐缓冲液(pH6.8)1 000 mL 为溶出介质,转速为50 r/min,经30 min,取溶液10 mL,过滤,精密量取续滤液适量,加溶出介质稀释成每1 mL中约含奥美沙坦酯10 μg的溶液,按照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA),在258 nm的波长处测定吸光度;另取奥美沙坦酯对照品约20 mg,精密定量,置100 mL容量瓶中,加乙腈-水(60∶40,体积比)适量,超声使溶解,放冷,加乙腈-水(60∶40,体积比)稀释至刻度,摇匀,精密量取5 mL,置100 mL容量瓶中,加磷酸盐缓冲液(pH6.8)稀释至刻度,摇匀,测定吸光度。
2.2 溶出度检测方法验证
2.3 专属性
取奥美沙坦酯对照品、奥美沙坦酯片及奥美沙坦酯空白片按奥美沙坦酯片溶出度检查项下方法制备奥美沙坦酯对照品溶液、供试品溶液及空白辅料溶液。
取上述空白辅料溶液、对照品溶液和供试品溶液,在258 nm的波长处测定吸光度;并分别于240~300 nm进行紫外扫描,空白辅料溶液在258 nm处无吸收,对照品溶液和供试品溶液在258 nm处均有最大吸收,空白辅料对奥美沙坦酯片溶出度检测无干扰,表明奥美沙坦酯片溶出度检测方法专属性良好。
2.4 滤膜吸附试验
按奥美沙坦酯片溶出度项下方法,制备奥美沙坦酯片供试品溶液,分别过0.8 μm滤膜,分别弃滤液2、3、4 mL,取续滤液检测,与供试液离心分离,取上清液检测进行对比,判断滤膜的吸附性。检测结果证明,奥美沙坦酯片供试品溶液用0.8 μm滤膜过滤,对检测结果无明显影响。
2.5 线性范围
精密称取奥美沙坦酯对照品20.55 mg,置100 mL容量瓶中,加溶剂适量,超声溶解,放置冷却,加溶剂稀释至刻度,摇匀,精密量取5 mL,置50 mL容量瓶中,加溶出介质稀释至刻度,摇匀,作为奥美沙坦酯线性储备液。分别精密量取该储备液1、3、4、5、6、7 mL 置于10 mL 容量瓶中,加溶出介质稀释至刻度,依次配制成 2.034,6.102,8.136,10.170,12.204,14.238 μg/mL 的溶液,取上述溶液在 258 nm波长处测定吸光度,试验结果见图1。
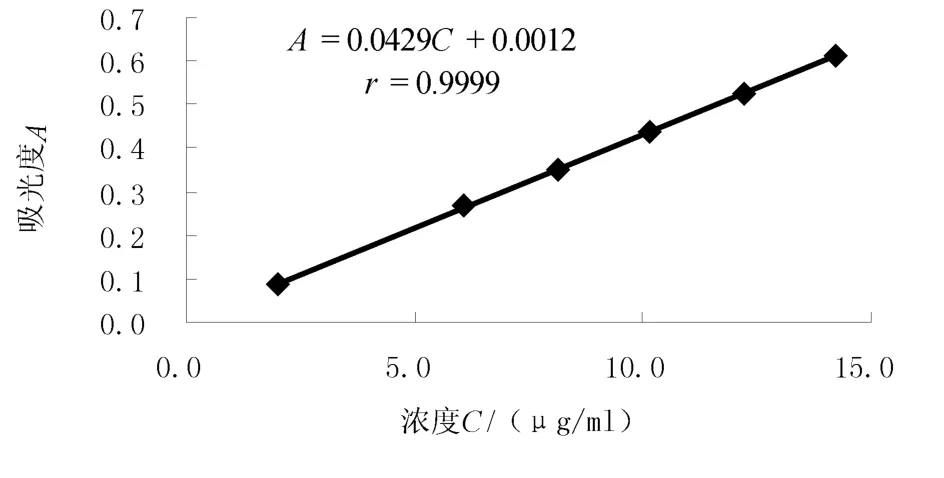
图1 奥美沙坦酯溶出度标准曲线图Figure 1 The dissolution curve of olmesartan medoxomil
由图1可知,奥美沙坦酯在2.034~14.238 μg/mL范围内,质量浓度与吸光度呈良好线性关系。
2.6 重复性
按奥美沙坦酯片溶出度检查项下方法由同一分析人员同法制备6份供试品溶液进行检测,6次检测结果的RSD=0.62%,表明溶出度检测方法重复性良好。
2.7 中间精密度
按奥美沙坦酯片溶出度检查项下方法由不同分析人员于不同日期同法各制备6份供试品溶液检测,12次检测结果的RSD=0.73%,表明溶出度检测方法中间精密度良好。
2.8 溶液稳定性
按奥美沙坦酯片溶出度检查项下方法,制备奥美沙坦酯片供试品溶液,室温放置 0、1、2、4、6、8 h进行检测,6个时间点检测结果的 RSD=0.32%,证明本品溶出度检测供试品溶液在室温下放置8h稳定。
2.9 准确度
采用加样回收法,按奥美沙坦酯片溶出度检查项下对照品溶液制备方法,取奥美沙坦酯空白片及奥美沙坦酯对照品适量制成质量分数为50%、75%、100%的供试品溶液,分别计算其回收率,验证溶出度检测方法的准确度,结果见表1。

表1 奥美沙坦酯片溶出度回收率试验结果Table 1 Olmesartan tablets dissolution recovery test results
表1结果表明溶出度检测方法准确度良好。综上所述研究结果表明该方法适用于奥美沙坦酯片溶出度检测。
3 溶出曲线测定
取奥美沙坦酯片样品6片,照2.1方法进行测定,以4种不同pH的溶出介质1 000 mL,分别在5、10、15、20、30、45、60、90、120、180、240、300、360 min取溶出液10 mL(每次取液补同温度的溶出介质10 mL),过滤,精密量取滤液5 mL,置10 mL容量瓶中,加溶出介质稀释至刻度,摇匀,作为供试品溶液,在258 nm的波长处测定吸光度,计算各取样点的累计溶出度,当连续两点的溶出率达90%以上,且差值在5%以内时试验可以提前结束。
3.1 溶出曲线检测方法的重现性验证
取奥美沙坦酯片参比制剂(110 010)按溶出曲线测定法重复检测2次,绘制溶出曲线,考察2次检测结果的重现性,试验结果见表2。
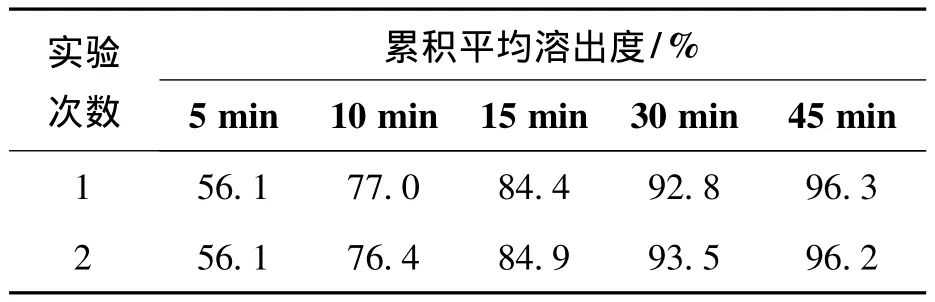
表2 奥美沙坦酯片(参比制剂)的溶出曲线重复试验结果Table 2 Repeat results of the dissolution curve of olmesartan medoxomil tablets(reference formulation)
表2结果表明,奥美沙坦酯片溶出曲线两次检测各时间点的累计溶出度基本相等,说明溶出曲线检测方法可操作性及重现性较好,可用于奥美沙坦酯片自制样品与参比制剂溶出曲线的对比检测。
3.2 溶出均一性
取奥美沙坦酯片(批号为:20110201及参比制剂(批号为:110010)分别测定在pH6.8的磷酸盐缓冲溶液中溶出曲线,考察批内溶出均一性,试验结果见表3、表4。
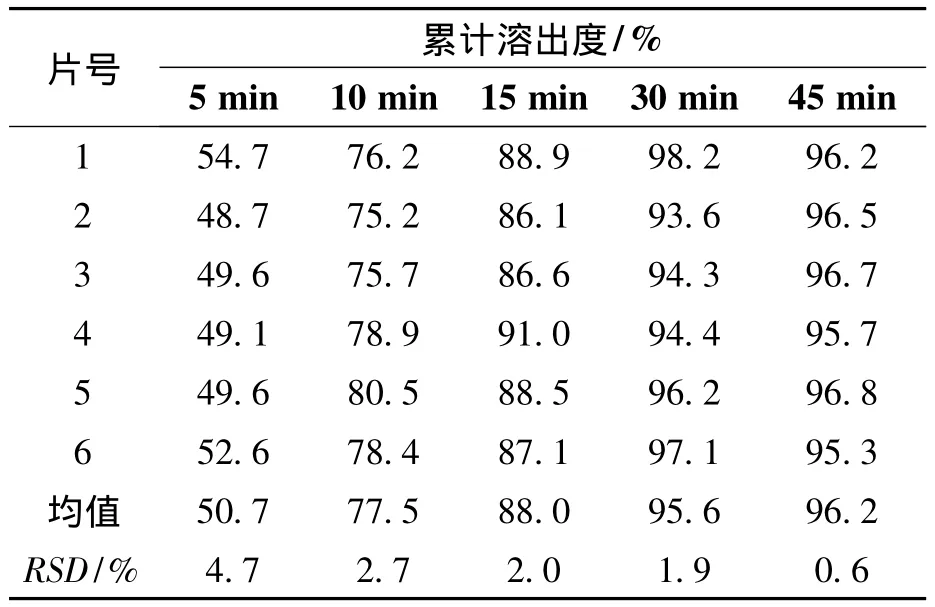
表3 奥美沙坦酯片(20110201批)溶出均一性试验结果Table 3 Olmesartan medoxomil tablets(20110201 batch)dissolution homogeneity test results
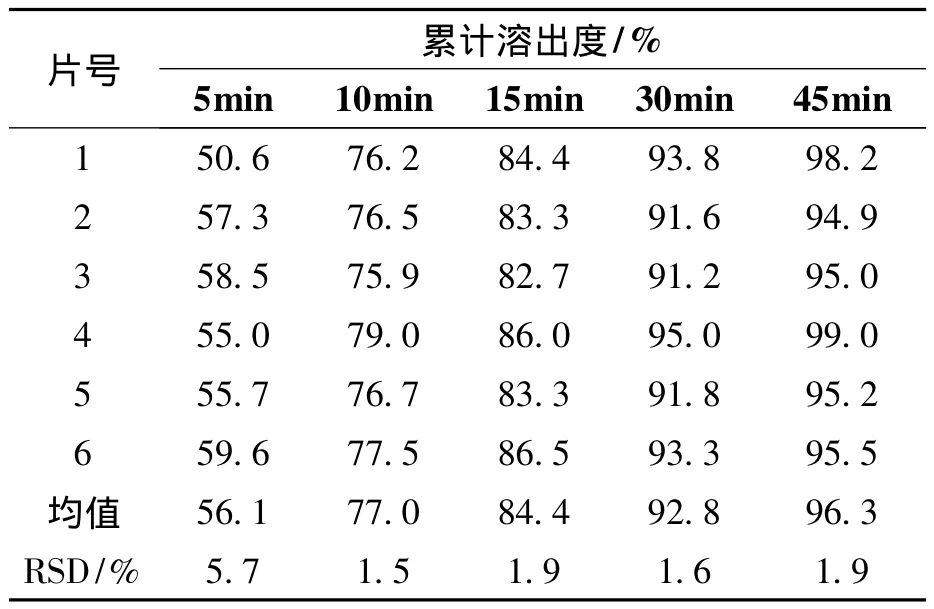
表4 奥美沙坦酯片(参比制剂,110010批)溶出曲线结果Table 4 Olmesartan medoxomil tablets(reference formulation,110010 batch)dissolution profile results
表3、表4结果显示溶出5 min后自制品和参比制剂6片间溶出度RSD均小于5%,表明二者6片间的溶出均一性均良好。
3.3 自制奥美沙坦酯片溶出重现性及与参比制剂的溶出相似性
按溶出曲线测定法检测自制奥美沙坦酯片3批样品(20120201、20120202、20120203)在 pH6.8的磷酸盐缓冲溶液中的溶出曲线,将第一批(20120201)自制样品与另外两批(20120202和20120203)自制样品在pH6.8的磷酸盐缓冲液中的溶出曲线进行对比,以考察自制3批样品的批间重现性;将自制品第一批和参比制剂在pH6.8的磷酸盐缓冲液中溶出曲线进行对比,以考察自制样品与参比制剂在pH6.8的磷酸盐缓冲液中溶出行为的一致性,试验结果见图2。

图2 自制样品与参比制剂溶出曲线对比Figure 2 Dissolution curve comparison of self-prepared and reference samples
将3批自制样品在pH6.8的磷酸盐缓冲液中的溶出曲线和参比制剂的溶出曲线进行对比,采用5、10、15、30 min的平均累计溶出度分别计算f2因子,并以pH6.8的磷酸盐缓冲液中3批自制样品的第一批为参照,计算另外两批样品在同种介质中溶出曲线的f2[4]因子,结果见表 5。

表5 自制样品与参比制剂溶出曲线f2因子的计算结果Table 5 Caculation results of factor f2of dissolution curve of self-prepared and reference samples
表5结果显示,自制3批样品与参比制剂在pH6.8的磷酸盐缓冲液中的溶出行为相似;自制3批样品在pH6.8的磷酸盐缓冲液中的溶出曲线重现性较好。
3.4 不同介质中的溶出曲线比较
采用多条溶出曲线剖析自制品与参比制剂溶出特性,方法:取奥美沙坦酯片(自制20120201)以参比制剂(110010)按溶出度测定法,分别以纯化水、0.1 mol/L盐酸溶液、pH4.5醋酸盐缓冲溶液为溶出介质进行溶出曲线检测。
自制样品和参比制剂在上述3种溶出介质中溶出曲线图见图3、图4、图5。

图3 自制样品与参比制剂在水中的溶出曲线对比Figure 3 Dissolution curve comparison of self-prepared and reference samples in water
3.5 不同介质中的溶出曲线相似性评价
奥美沙坦酯片自制品与参比制剂在4种溶出介质中溶出曲线相似性评价结果见表6。
由表6结果可知,奥美沙坦酯片自制品与参比制剂在4种溶出介质中溶出曲线均相似,表明自制品与参比制剂体外溶出行为一致。

图4 自制样品与参比制剂在pH=1.0盐酸溶液中溶出曲线对比Figure 4 Dissolution curve comparison of self-prepared and reference samples in pH=1.0 HCl solution
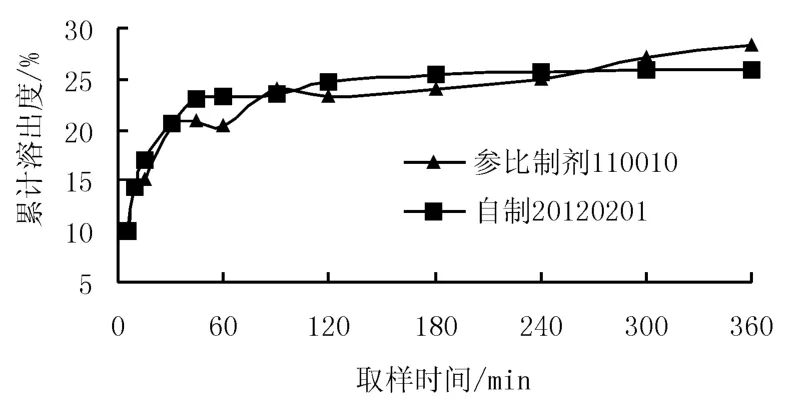
图5 自制样品与参比制剂在pH=4.5醋酸盐缓冲溶液中溶出曲线对比Figure 5 Dissolution curve comparison of self-prepared and reference samples in pH=4.5 HAc buffer solution

表6 溶出曲线相似性评价结果Table 6 Evaluation results of the dissolution profile similarity
4 结论
奥美沙坦酯难溶于水,实验中自制品与参比制剂在水和pH4.5醋酸盐缓冲溶液中360 min均未溶出90%以上,未达到溶出平台,在后续研究中应在这两种介质中加入一定量的表面活性剂使样品中奥美沙坦酯溶出完全,以提高自制品与参比制剂在这两种介质中溶出行为的区分度。虽然奥美沙坦酯片自制品与参比制剂在4种溶出介质中溶出曲线均相似,体外溶出行为一致,但是自制品与参比制剂体内生物利用度是否等效还有待进一步考察。
[1]谢沐风.改善溶出度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,2005,36(7):447-451.
[2]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946—955.
[3]国家药典委员会.中华人民共和国药典:二部[M].北京:中国医药科技出版社,2010:附录85.
[4]陈贤春,吴清,王玉蓉,等.关于溶出曲线比较和评价方法[J].中国医院药学杂志,2007,27(5):662-664.

