小鼠脑梗死后小胶质细胞内Toll样受体9选择性上调*
纪 原, 杨碧莹, 黄小雄, 潘经锐, 王鸿轩, 王艺东△
器官缺血再灌注后出现的炎症反应对组织细胞 损伤起着重要作用。Toll样受体(Toll-like receptor,TLR)家族在各器官缺血再灌注中介导的自身免疫炎症反应近年越来越受到关注[1]。TLR2、TLR4等在脑缺血再灌注中的作用已有大量研究,但有关卒中后TLR9表达情况的文献还较少,其具体细胞表达位点及动态变化尚未明确。作为族中唯一识别DNA的受体,TLR9不仅辨认细菌/病毒等异源DNA,在一定条件下也能被宿主自身DNA激活[2]。脑缺血再灌注后损伤细胞DNA外溢扩散,很可能激活TLR9及其下游NF-κB及IRF7信号转导通路,通过调控凋亡蛋白等机制[3]影响神经结构的损伤和功能的恢复。本研究拟观察TLR9在局灶脑缺血再灌注(脑梗死)后的表达情况,明确其主要表达细胞类型,为深入研究TLR9在脑卒中后的作用打下基础。
材料和方法
1 动物及主要材料
雄性 SPF级 C57小鼠 30只,体重23~25 g[4],购自中山大学东校区动物中心,置于北校区动物中心SPF屏障环境饲养(No.00024488)。环境维持20~22℃相对恒温,昼夜时长12 h/12 h,所有笼具、垫料、饲料、饮水均经过高温灭菌,动物自由饮水、进食。线栓购自北京沙东生物技术有限公司;羊抗TLR9多克隆Ⅰ抗购自Abcam;兔抗离子钙结合接头分子 1(ionized calcium-binding adaptor molecule 1,Iba-1)、胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经元核抗原(neuronal nuclear antigen,NeuN)和髓磷脂碱性蛋白(myelin basic protein,MBP)多克隆Ⅰ抗购自Millipore;Alexa Fluor 488标记驴抗羊和594标记驴抗兔Ⅱ抗购自Jackson;DAPI购自Roche;4%多聚甲醛、蔗糖(分析纯)、OCT冷冻包埋剂、防脱载玻片、Triton X-100、免疫组化笔和防淬灭封片剂购自广州威佳公司;冷冻切片机和正立式全自动荧光显微镜由中山大学医学实验中心提供;激光多普勒血流仪购自瑞典帕瑞医学(中国)公司。
2 方法
2.1 脑梗死模型制备 全部实验用鼠随机分成2组,假手术组12只,余用于手术建模。参照Longa线栓法[5]制备小鼠右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,栓塞90 min后将线栓拔出至颈外动脉残端实现再灌注;假手术组线栓不进入大脑中动脉。术中维持肛温于(37.0±0.5)℃并使用激光多普勒血流仪监测,达到如下标准视为缺血再灌注成功:线栓置入大脑中动脉后血流值下降大于75%,拔栓后,血流值上升超过基线值的50%。假手术组脑血流无变化。动物清醒后出现左上肢内收、瘫痪,强迫转圈实验(+),自发转圈追尾,向左侧倾倒,视为模型制备成功。剔除死亡等情况,最终12只入选梗死组。
2.2 取材、制片、定位及细胞计数 梗死组在再灌注 6 h、3 d、7 d、14 d(假手术组于相应时点)处死取脑,各时点n=3。10%水合氯醛腹腔注射,深度麻醉后迅速开胸。剪破右心耳放血,左心室4℃生理盐水持续灌流15 min冲尽血液,续以20 mL 4%多聚甲醛灌流。开颅取脑,4%多聚甲醛4℃固定过夜,依次浸于10%、20%和30%蔗糖溶液内梯度脱水。OCT包埋后切成8 μm冠状位脑片,载于防脱载玻片上-80℃保存。大体脑片标本早期呈现明显的水肿、肿胀,后期则萎缩、瘢痕化,肉眼便可以清晰辨别其交界线。镜检时,梗死区可见明显的核固缩、核碎裂,与周围相对正常区差别明显,用作镜下初步定位的主要依据。×5镜头先定位至两者交界处,再逐渐调至高倍镜(×5→×10→×20→×40),准确定位至梗死边缘区。沿此线×40镜下多点随机拍摄,范围覆盖整张脑片的梗死边缘区,所得细胞计数结果取均值,以保证各切片观察区域的一致,及数据的稳定性。
2.3 免疫荧光双染 TLR9与神经元(NeuN)/小胶质细胞(Iba-1)/星形胶质细胞(GFAP)/少突胶质细胞(MBP)共染,步骤如下:1×PBS摇床洗片3次,每次5 min。0.3%Triton X-100室温孵育30 min。洗片(同前)。10%正常驴血清室温孵育1 h。轻甩去封闭液后,滴加相应Ⅰ抗混合液(TLR9:1∶200;NeuN:1∶300;Iba-1:1∶250;GFAP:1∶200;MBP:1∶400),4℃湿盒孵育过夜。洗片,滴加相应Ⅱ抗混合液(Alexa Fluor 488标记驴抗羊Ⅱ抗1∶800;594标记驴抗兔Ⅱ抗1∶800),避光室温孵育1 h。洗片,DAPI避光室温孵育10 min。洗片,滴加防淬灭剂后盖玻片封片,荧光下镜检。对照片以PBS代替相应Ⅰ抗孵育。40倍镜下观察梗死组梗死灶边缘区,见图1A,缺血对侧相应部位及假手术组右侧半球。采用Image-Pro Plus 6.0软件分析,以累积吸光度(IA;扣除对照片本底)对TLR9半定量;计数TLR9阳性的各类细胞并计算阳性率。各样本脑片均随机选取后重复3~4次,所得数据取均值。
3 统计学处理
计量数据以均数±标准差(mean±SD)表示。缺血侧与缺血对侧比较采用配对t检验,组间比较采用单因素方差分析(ANOVA),进一步采用LSD法两两比较。部分不符合正态性、方差齐性数据采用校正t检验或秩和检验。用SPSS 20.0软件包分析。以P<0.05为差异有统计学意义。
结 果
1 脑梗死后TLR9蛋白表达量的变化
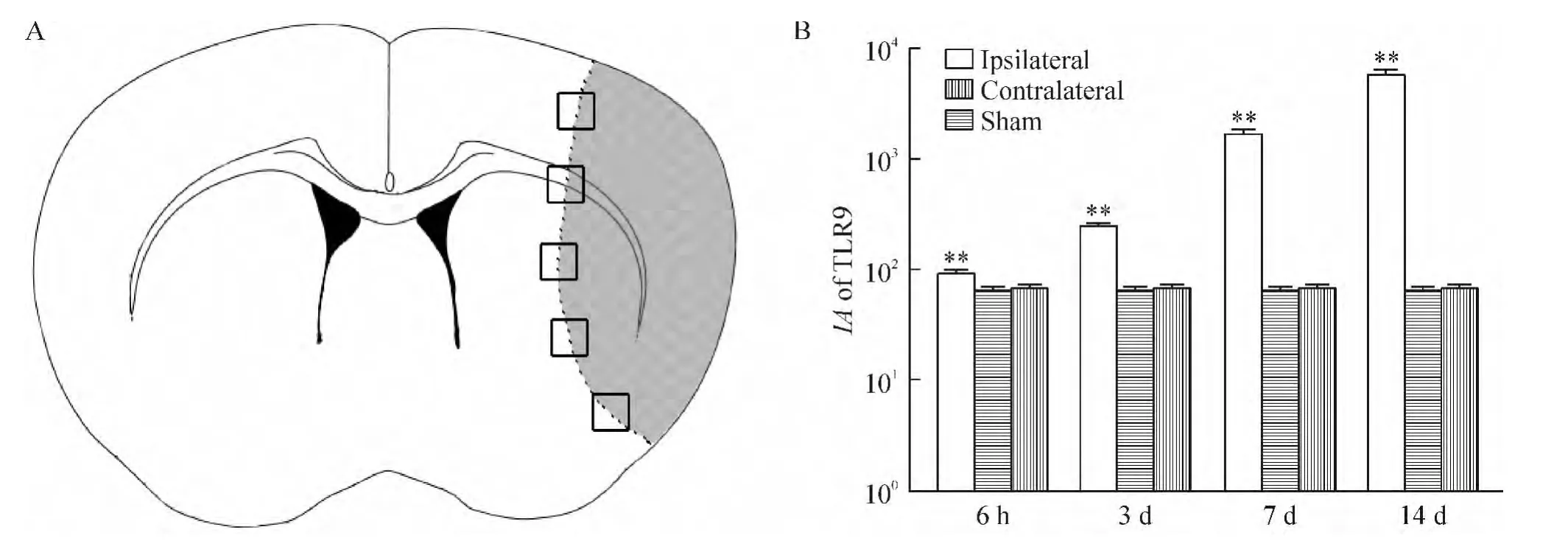
Figure 1.Schematic illustration of the evaluated peri-infarct region and the semiquantitative data of integral absorbance(IA)of TLR9.A:observation points(black boxes)between the infarct tissue(dark area)and the normal one(white area)after middle cerebral artery occlusion(MCAO)and reperfusion;B:bar graph of the quantified fluorescent data reveals that IA of TLR9 in the ipsilateral peri-infarct region increased from 6 h to 14 d after MCAO while the contralateral and sham-operated groups showed no significant change.Mean±SD.n=3.**P <0.01 vs sham group.图1 脑梗死灶边缘区取样示意图及TLR9荧光半定量结果
梗死灶边缘区代表TLR9的IA值始终高于对侧及假手术组相同时点的IA值(均P<0.01),而且随时间逐渐增加(均P<0.01)。相同时点缺血对侧与假手术组间的IA无统计学意义,见图1B。
2 脑梗死后神经元和神经胶质细胞TLR9表达变化
2.1 神经元变化 梗死灶边缘区的神经元出现急性缺血缺氧后改变如胞体缩小变形、核固缩等,部分成为鬼影细胞;缺血对侧与假手术组的神经元形态无明显异常。各时点观察梗死灶边缘区、对侧相应位置及假手术组均偶见胞内小点状TLR9着染,主要位于核周胞质,见图2。梗死灶边缘区的神经元总数和TLR9阳性神经元数目除6 h外,其余各时点始终低于对侧及假手术组(均P<0.01),两者均随时间先降后升(均P<0.01),最低值位于7 d,见图3A。梗死灶边缘区各时点TLR9的阳性率以及与其它组比较均无统计学意义,见图3B。
2.2 小胶质细胞变化 梗死灶边缘区的小胶质细胞胞体增大,突起增多、增粗,呈激活状态,胞内TLR9着染逐渐增多,由少量小点状渐变为团块状粗颗粒样;而缺血对侧与假手术组的小胶质细胞呈静止状态,有多条细长分枝状突起,偶见小点状TLR9着染,见图4。梗死灶边缘区小胶质细胞总数、TLR9阳性细胞数和TLR9阳性率始终高于对侧及假手术组相同时点的相应指标(均P<0.05);组内各时点比较,总数及阳性数随时间逐渐增加(均P<0.01);阳性率随时间先升后降(均P<0.05),于3 d达峰值。缺血对侧小胶质细胞仅总数在后期(7 d、14 d)高于假手术组(均P<0.01),两组间TLR9阳性细胞数和TLR9阳性率均无统计学意义,见图5。
2.3 星形胶质细胞及少突胶质细胞的变化 两者随时间延长逐渐在梗死灶边缘区聚集增生,但始终未见TLR9在胞内表达,见图6。
讨 论
TLR9的经典配体是非甲基化胞嘧啶-磷酸-鸟嘌呤二核苷酸序列DNA(CpG-DNA),主要来源于无脊椎动物如细菌、真菌等病原体[6];但病理条件下脊椎动物自身DNA释放外溢,定位于包涵体后也可激活TLR9[7]。静息情况下TLR9定位于内质网,当配体进入激活态细胞溶酶体后,TLR9能在伴侣Unc93b1帮助下迅速募集至内吞溶酶体,并以后者为主要表达的细胞器,启动配体识别和后续的信号转导[8-9]。本研究中,荧光半定量结果提示梗死灶周边组织TLR9表达量较对侧明显增加,推测梗死灶内部坏死组织DNA释放外溢,但梗死灶周围胶质细胞密集增生形成瘢痕[10],这些自身DNA碎片主要浓集于周边组织,成为内源性配体激活TLR9。
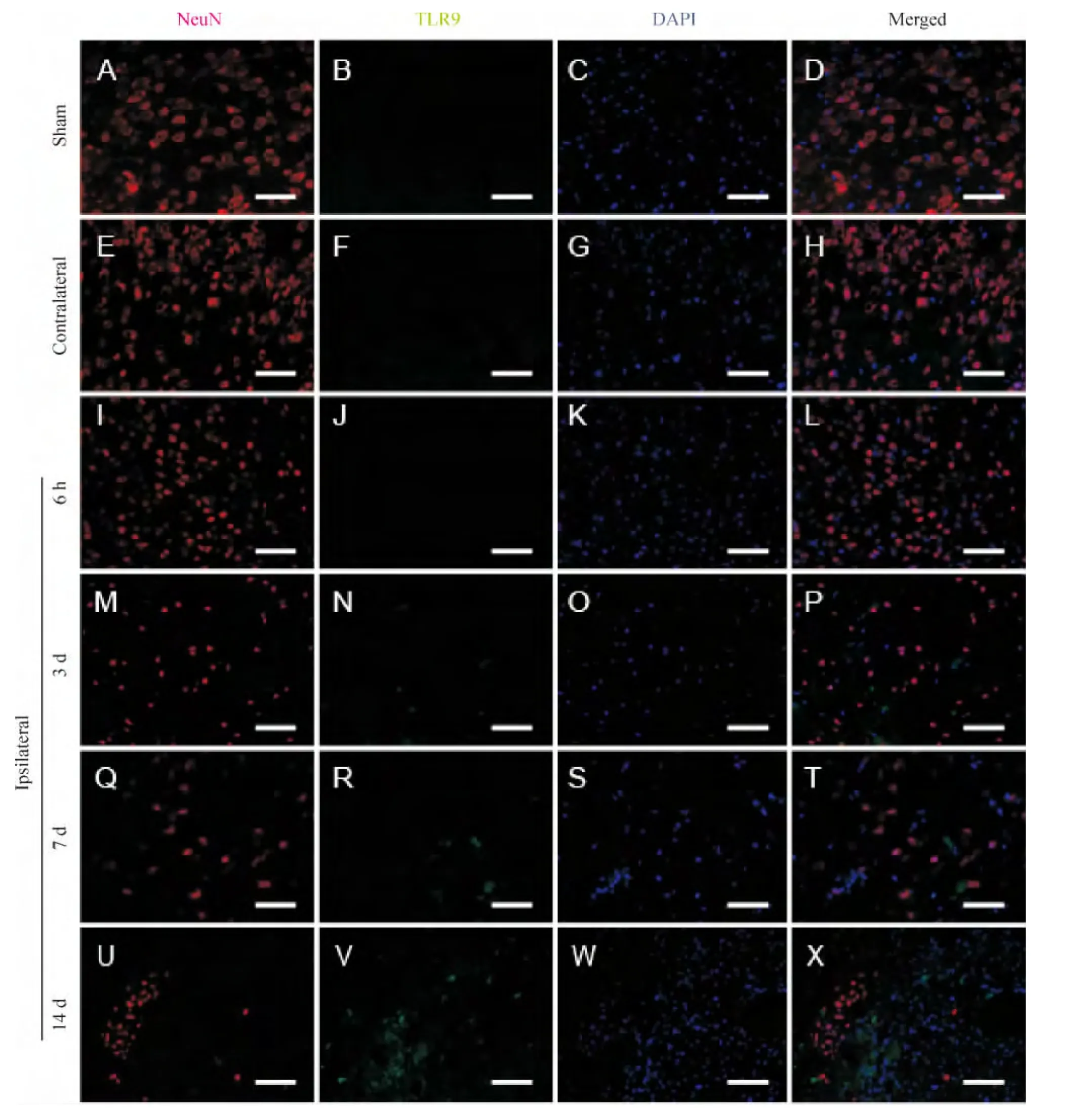
Figure 2.Immunofluorescence double staining of NeuN(a marker of neuron;red)and TLR9(green).In the contralateral and shamoperated groups,neurons were eumorphism,occasionally with perinuclear tiny dots of TLR9.Remnant neurons in the ipsilateral peri-infarct region exhibited karyopyknosis.Excellular TLR9 staining increased from 6 h to 14 d,but still occasionally with perinuclear tiny dots of TLR9.DAPI labeled cell nucleus.Scale bars=100 μm.图2 神经元和TLR9免疫荧光双染图
正常情况下,中枢神经系统中神经元与小胶质细胞均表达少量 TLR9[11-12]。本实验中,小鼠在MCAO后,其神经元的TLR9阳性率在各时点、组间均无统计学差异,胞内TLR9始终呈散在小点状着染。这些结果说明TLR9表达没有发生改变。神经元无吞噬功能,胞外DNA碎片难以进入,缺乏配体很可能是胞内TLR9无反应的原因。TLR9阳性神经元数量的变化,由于其趋势与总数变化一致,可能是依固有表达比例,随神经元总数变化的结果。既往研究发现,卒中早期由于缺血缺氧及再灌注损伤等原因,神经元总数逐步脱失减少,后期随着神经干细胞的迁移分化可部分恢复[13]。

Figure 3.Comparison of the total number of neurons,TLR9-positive neuron number(A)and positive rate(B)in each group.Mean±SD.n=3.图3 各组神经元总数、TLR9阳性神经元数目及阳性率比较
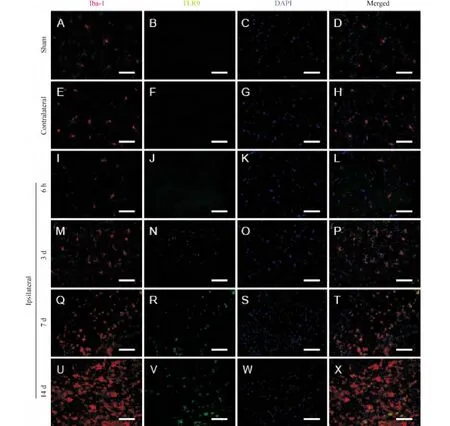
Figure 4.Immunofluorescence double staining of Iba-1(a marker of microglia;red)and TLR9(green).In the contralateral and sham-operated groups,the processes of microglia branched off with further distal arborization,occasionally with tiny dots of TLR9.In ipsilateral peri-infarct region,at 6 h after ischemia and reperfusion(I/R),the morphological changes of micriglia were not obvious but TLR9 already slightly increased.Microglia showed proliferation,shortened their branches,accompanied with the increase in the intracellular TLR9 at 3 d after I/R.At 7 d and 14 d after I/R,microglia clusters were in activated ameboid state,with intracellular TLR9 staining from scattered tiny dots to clustered coarse particles.DAPI labeled cell nucleus.Scale bars=100 μm.图4 小胶质细胞和TLR9免疫荧光双染图
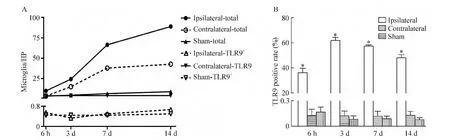
Figure 5.Comparison of the total number of microglia,TLR9-positive microglia number(A)and positive rate(B)in each group.Mean±SD.n=3.*P<0.05 vs sham.图5 各组小胶质细胞总数、TLR9阳性小胶质细胞数及阳性率比较
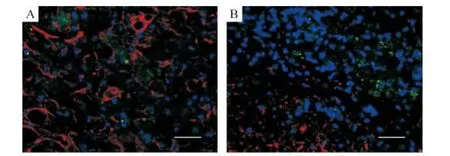
Figure 6.Immunofluorescence merging of GFAP(A;a marker of astrocyte;red)or MBP(B;a marker of oligodendrocyte;red)with TLR9(green).TLR9 was located outside the astrocytes and oligodendrocytes.DAPI labeled cell nucleus.Scale bars=50 μm.图6 星形胶质细胞或少突胶质细胞与TLR9免疫荧光染色融合图
我们观察到,作为 TLR9固有表达的另一细胞——小胶质细胞的表现截然不同。缺血侧小胶质细胞迅速激活增生,吞噬增加以清除自身坏死物质。胞内晚期溶酶体中的自身DNA碎片可激活TLR9[8]。本实验中,梗死灶周围小胶质细胞总数及TLR9阳性细胞数均出现升高,TLR9阳性率先升后降,三者始终高于假手术组,胞内TLR9由极少量散在的细粒状转变为团块样深浅不一粗颗粒状。这些结果支持小胶质细胞的TLR9出现激活上调。缺血对侧的小胶质细胞仅在后期总数略有增加,可能是因损伤侧神经元延伸至对侧的神经纤维后期缓慢出现华勒变性所致[14],但这些纤维在对侧脑组织中所占比例极少,且崩解产物以髓鞘及轴突碎片为主,内含自身DNA微乎其微,故本实验没有发现缺血对侧TLR9激活。
本实验也观察到,脑梗死后星形胶质细胞及少突胶质细胞均未见胞内TLR9表达。这两类细胞在梗死灶周边聚集增生,可能参与了梗死灶周边胶质瘢痕的形成[10]。McKimmie 等[15]在静息态原代星形胶质细胞培养中发现TLR9的mRNA表达,给予不同刺激物后观察到表达量的上/下调。这一结果与本实验及既往其它文献所见并不一致,推测由于体外特定培养环境与在体差异所致。
另外,脑梗死后外周诸多炎症细胞可通过受损的血脑屏障浸润入脑,但它们大多数持续时间短,如中性粒细胞3 d左右即消失[16];或为目前未发现TLR9 表达的 CD4+/CD8+/Treg/γδ等 T 细胞[6]。值得注意的是单核-巨噬细胞,其作为抗原呈递细胞表达TLR9[6],且能在中枢神经系统驻留较长时间,并与小胶质细胞具有相同的起源,目前的细胞标记物还不能将两者完全区分开[12,16]。但 Schilling 等[17]利用绿色荧光蛋白标记发现,相比单核巨噬细胞,中枢定居的小胶质细胞在激活时间、数量及持续时间方面均占明显主导地位。由此我们推测,本实验所见TLR9激活的细胞中,单核巨噬来源极少。
总之,本研究发现,脑梗死后脑内定居细胞中仅小胶质细胞的TLR9选择性激活。作为脑内定居的巨噬细胞,小胶质细胞是缺血性卒中后的主要炎症反应细胞,既往研究认为其有双重作用:早期通过氧自由基及细胞因子等加重神经损伤,后期通过吞噬动作及分泌多种神经营养因子施加修复作用,但具体机制仍未明确[16]。结合我们前期发现脑梗死后TLR9的炎症损伤通路和细胞保护通路先后被激活[18],或许是小胶质细胞在脑缺血再灌注后能表现出双重作用的一个重要原因。
[1] Chang WJ,Toledo-Pereyra LH.Toll-like receptor signaling in liver ischemia and reperfusion[J].J Invest Surg,2012,25(4):271-277.
[2] Connolly DJ,O′Neill LA.New developments in Toll-like receptor targeted therapeutics[J].Curr Opin Pharmacol,2012,12(4):510-518.
[3] 郭晓芳,顾 勤,刘 宁,等.P53在急性肾损伤小鼠肾脏的表达及其与细胞凋亡的关系[J].中国病理生理杂志,2012,28(11):1971-1975.
[4] 赵 瑾,苑 琳,王驭龙,等.线栓法复制昆明小鼠局灶性脑缺血再灌注模型的稳定性研究[J].中国病理生理杂志,2011,27(7):1450-1452,1456.
[5] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6] Kumagai Y,Takeuchi O,Akira S.TLR9 as a key receptor for the recognition of DNA[J].Adv Drug Deliv Rev,2008,60(7):795-804.
[7] Yasuda K,Yu P,Kirschning CJ,et al.Endosomal translocation of vertebrate DNA activates dendritic cells via TLR9-dependent and-independent pathways[J].J Immunol,2005,174(10):6129-6136.
[8] Latz E,Schoenemeyer A,Visintin A,et al.TLR9 signals after translocating from the ER to CpG DNA in the lysosome[J].Nat Immunol,2004,5(2):190-198.
[9] Fukui R,Saitoh S,Matsumoto F,et al.Unc93B1 biases Toll-like receptor responses to nucleic acid in dendritic cells toward DNA-but against RNA-sensing[J].J Exp Med,2009,206(6):1339-1350.
[10] Badan I,Buchhold B,Hamm A,et al.Accelerated glial reactivity to stroke in aged rats correlates with reduced functional recovery[J].J Cereb Blood Flow Metab,2003,23(7):845-854.
[11] Kaul D,Habbel P,Derkow K,et al.Expression of Tolllike receptors in the developing brain[J].PLoS One,2012,7(5):e37767.
[12]Kettenmann H,Hanisch UK,Noda M,et al.Physiology of microglia[J].Physiol Rev,2011,91(2):461-553.
[13] Nakatomi H,Kuriu T,Okabe S,et al.Regeneration of hippocampal pyramidal neurons after ischemic brain injury by recruitment of endogenous neural progenitors[J].Cell,2002,110(4):429-441.
[14] Thiel A,Heiss WD.Imaging of microglia activation in stroke[J].Stroke,2011,42(2):507-512.
[15] McKimmie CS,Fazakerley JK.In response to pathogens,glial cells dynamically and differentially regulate Toll-like receptor gene expression[J].J Neuroimmunol,2005,169(1-2):116-125.
[16] Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J].J Leukoc Biol,2010,87(5):779-789.
[17] Schilling M,Besselmann M,Muller M,et al.Predominant phagocytic activity of resident microglia over hematogenous macrophages following transient focal cerebral ischemia:an investigation using green fluorescent protein transgenic bone marrow chimeric mice[J].Exp Neurol,2005,196(2):290-297.
[18]黄小雄,谢 芬,潘经锐,等.TLR9信号通路在大鼠脑梗死灶周围组织中的双向转导[J].中华神经医学杂志,2012,11(5):454-458.

