刺五加酸对急性肝损伤小鼠的保护作用*
郝乘仪,吴艳玲,廉丽花,南极星
(1.吉林医药学院药学院,吉林 132013;2.延边大学药学院,延吉 133002)
刺五加[Acanthopanax senticosus(Rupr.et Maxin.)Hams]为多年生硬质灌木,由于含有多种天然活性成分,且无毒副作用,自古就倍受人们青睐,距今具有两千多年的应用历史,《本草纲目》称其为“本中上品”,具“补中益气、坚筋骨强意志、久服轻身耐老”功效。近年来研究证明,刺五加和人参具有相似的药理作用和临床疗效,可增加机体的免疫功能,提高机体对各种有害刺激非特异性的抵抗力和抗癌作用[1]。肝脏是药物和毒物代谢过程中的重要器官,日常生活中过量饮酒或饮用中药都会引发肝脏的损伤[2-4]。刺五加对肝脏有较好的保护作用,但是对其研究还比较少,而且多是提取物的研究[5-6],笔者在本实验利用刺五加中的有效成分刺五加酸证明其具有很好的保肝作用。
1 材料与方法
1.1 动物 取雄性SPF级昆明种小鼠,体质量20~22 g,由延边大学医学部动物科提供,动物合格证号:SCXK(吉)2008-5110,生产许可证号:SCXK(吉)2008-0003,25℃恒温环境饲养,饲标准饲料。
1.2 药品与试剂 他克林(Sigma公司);刺五加酸由韩国生命工学研究院李晶俊博士提供,纯度98%;N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC,Sigma公司);丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、苏木精染剂(批号:20101215)均购自南京建成生物研究所;甲醛溶液(天津市福晨化学试剂厂)。
1.3 仪器 HJ-2双头磁力加热搅拌器(金坛市科析仪器有限公司),SUNRISE酶标仪(上海麦莎生物科技有限公司),MDF-U4186S超低温冰箱(三洋电机国际贸易有限公司),BS224型电子分析天平(北京赛多利斯仪器系统有限公司),SP-4430型生化分析仪(日本ARKRAY公司),1-13型离心机(Sigma公司)。
1.4 方法
1.4.1 动物分组及肝损伤模型制作 雄性小鼠60只,随机分成6组,即正常对照组,模型对照组,阳性对照组(NAC 300 mg·kg-1),刺五加酸小、中、大剂量组(50,100,200 mg·kg-1),每组 10 只。正常对照组与模型对照组灌胃给予等体积0.9%氯化钠溶液。其余4组连续灌胃给予相应药物,共3 d,末次给药前禁食16 h,给药1h后除正常对照组外均灌胃给予他克林35 mg·kg-1,6 h后颈动脉取血,分离肝脏,脱颈椎处死,收集血清,肝脏存放于-80℃冰箱中,备用[7]。
1.4.2 指标测定 取小鼠颈动脉血,静置15 min后,以3000 r·min-1离心 15 min后,取出血清,置于-20℃下冷冻保存,以备用。血清中 ALT、AST和LDH测定:以SP-4430型生化分析仪按试剂说明书进行测定。肝脏组织中GSH、MDA的测定依据试剂盒的说明书进行。
1.4.3 病理组织学检查 取肝脏左叶距边缘0.5 cm处小块组织,用10%甲醛溶液固定,按常规脱水、透明、浸蜡、包埋、切片后显微镜下观察组织形态学(苏木精-伊红染色)。肝细胞脂肪变性程度和坏死及炎症活动度判断标准分为:0分,无变性、坏死;1分,肝细胞内脂滴极稀少,一个或者几个坏死细胞;2分,轻微病变,10% ~25%坏死细胞或炎细胞浸润;3分,中度病变,~40%坏死细胞或炎细胞浸润;4分,明显病变,~50%坏死细胞或炎细胞浸润;5分,严重病变,>50%坏死细胞或炎细胞浸润[8]。
1.4.4 统计学方法 实验数据采用Graphpad prism program 5.0 版软件(Graphpad software,Inc,san Diego,USA)分析,用单因素方差分析(One-way ANOVA)和Turkey's多因素 t检验进行数据比较。P <0.05为差异有统计学意义。
2 结果
2.1 对他克林所致急性肝损伤大鼠AST ALT及LDH的影响 给予他克林后,模型对照组的ALT、AST以及LDH含量明显升高,与正常对照组比较差异有统计学意义(P<0.01),说明造模成功。各给药组ALT、AST以及LDH含量下降,与模型对照组比较差异有统计学意义(P <0.01或 P <0.05)。见表1。
2.2 病理组织学观察 正常对照组,模型对照组,阳性对照组,刺五加酸小、中、大剂量组肝损伤的评分分别为 0.0,4.2,2.3,2.9,2.2,1.8 分。正常对照组的肝组织完好,肝细胞完整,细胞核正常;模型对照组表现为肝小叶结构大部分破坏,肝细胞呈弥漫性坏死,细胞核固缩或消失,有大量炎性细胞浸润;刺五加酸小剂量组细胞结构较完整,坏死性区域与模型对照组相比有所减少;刺五加酸中剂量组肝索排列接近正常,部分肝细胞体积增大,中央静脉及汇管区清晰可见;刺五加酸大剂量组肝细胞完整,部分肝细胞增大,与正常对照组接近。见图1。
2.3 对他克林所致急性肝损伤大鼠MDA、GSH的影响 给予他克林6 h后,模型对照组MDA含量明显升高,与正常对照组比较差异有统计学意义(P<0.01),刺五加酸中剂量组、大剂量组和阳性对照组MDA含量均明显降低,与模型对照组比较均差异有统计学意义(均P<0.01),刺五加酸大剂量组与中剂量组差异无统计学意义(P>0.05)。模型对照组GSH含量明显降低,与正常对照组比较差异有统计学意义(P<0.01),刺五加酸大剂量组和中剂量组GSH含量明显升高,与模型对照组比较差异有统计学意义(P<0.01),刺五加酸大剂量组与中剂量组比较差异有统计学意义(P<0.05)。见表2。
表1 6组小鼠血清中AST、ALT和 LDH的含量比较Tab.1 Comparison of the serum level of AST,ALT and LDH among six groups of mice U·L-1,

表1 6组小鼠血清中AST、ALT和 LDH的含量比较Tab.1 Comparison of the serum level of AST,ALT and LDH among six groups of mice U·L-1,
与正常对照组比较,*1 P <0.01;与模型对照组比较,*2 P<0.01,*3 P <0.05Compared with normal control group,*1 P <0.01;compared with model control group,*2 P <0.01,*3 P <0.05
组别 小鼠/只 剂量/(mg·kg-1)AST ALT LDH正常对照组 10 …52±23 14±1 1028±487模型对照组 10 … 425±85*1 59±7*1 3918±737*1阳性对照组 10 300 149±42*2 26±4*2 1357±421*2刺五加酸小剂量组 10 50 241±37*3 50±3*3 3404±615*3中剂量组 10 100 123±19*2 25±5*2 3251±765*3大剂量组 10 200 143±46*2 32±9*2 1218±312*2
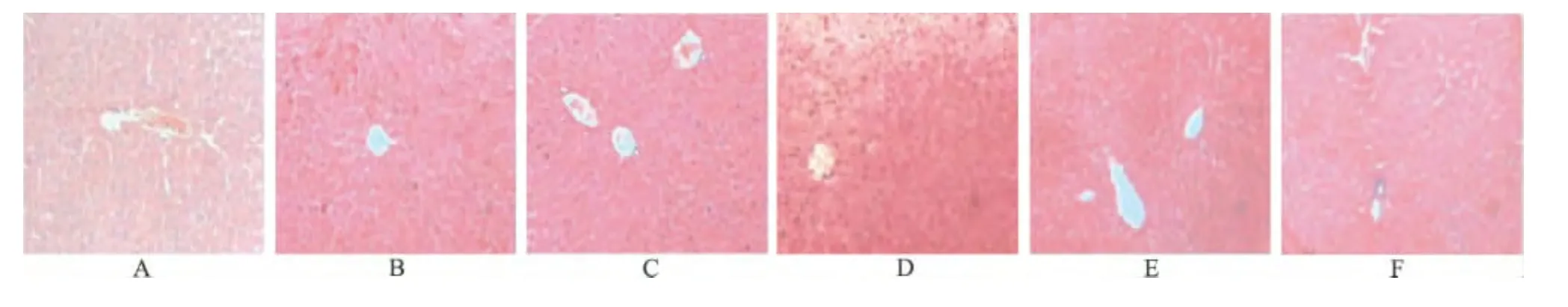
A.正常对照组;B.模型对照组;C.阳性对照组;D.刺五加酸小剂量组;E.刺五加酸中剂量组;F.刺五加酸大剂量组图1 6组小鼠肝脏病理组织切片图(×100)A.normal control group;B.model control group;C.positive comtrol group;D.low-dose acanthoic acid group;E.middle-dose acanthoic acid group;F.high-dose acanthoic acid groupFig.1 Histopathologic slide image of livers from six groups of mice(×100)
表2 6组小鼠MDA和GSH的含量比较Tab.2 Comparison of the contents of MDA and GSH among six groups of mice

表2 6组小鼠MDA和GSH的含量比较Tab.2 Comparison of the contents of MDA and GSH among six groups of mice
与模型对照组比较,*1 P<0.01;与中剂量组比较,*2 P<0.05Compared with model control group,*1 P < 0.01;compared with middle dose group,*2 P <0.05
组别 小鼠/只剂量/(mg·kg-1)MDA/(μmol·g-1)GSH/(mg·g-1)正常对照组 10 … 2.80±1.50*1 601±33*1模型对照组 10 … 7.63±0.50 238±27阳性对照组 10 300 3.01±0.24*1 226±23刺五加酸小剂量组 10 50 5.41±0.72 268±31中剂量组 10 100 3.00±0.55*1 397±21*1大剂量组 10 200 3.24±0.48*1 417±15*1*2
3 讨论
他克林是一种胆碱酯酶抑制药,其化学名为9-氨基-1,2,3,4-四氢吖啶,是治疗老年痴呆症的一种有效药物,但其有很强的肝毒性[9]。NAC对肝损伤有较好疗效,其保护作用可能是通过补充血清及肝脏组织中所消耗的GSH,并提高血清中一氧化氮来增强组织灌流,降低肝脏组织中有毒性作用的一氧化氮而产生保护作用[10-11]。
笔者建立了他克林小鼠肝损伤模型。实验表明,他克林35 mg·kg-1可引起明显的小鼠肝毒性,表现为肝脏血清ALT和AST升高。经实验发现,刺五加酸灌胃给药,可显著改善由他克林所导致的肝损伤。在给药组中,尤其是刺五加酸中、大剂量组,血清中的AST、ALT含量显著降低,说明刺五加酸具有防止他克林诱导的肝损伤作用。刺五加酸还显著降低了肝组织中MDA的含量和肝组织中GSH的消耗。提示刺五加酸对他克林引起的急性肝损伤具有较好的保护作用。
目前有关刺五加酸的研究较少,其确切的药理作用及作用机制报道甚少,极具开发研究潜力。
[1]贾继明,王宏涛,王宗权,等.刺五加的药理活性研究进展[J].中国现代中药,2010,12(2):7 -8.
[2]王君明,崔瑛,王峥涛,等.超氧化物歧化酶参与肝损伤的研究进展[J].中国实验方剂学杂志,2011,17(7):265-266.
[3]余琼华.42例药物性肝损害分析[J].医药导报,2011,30(2):256.
[4]霍记平,汤强,胡本容,等.长期摄入乙醇对大鼠心血管系统与肝脏的影响[J].医药导报,2009,28(11):1420 -1421.
[5]金英顺.刺五加对D-氨基半乳糖与内毒素合用所致小鼠暴发性肝衰竭的保护作用[D].延吉:延边大学,2005.
[6]冯丹.刺五加注射液对大鼠肝缺血-再灌注损伤的保护作用[D].延吉:延边大学,2010.
[7]陈震,吕雄文,李俊,等.咖啡因对小鼠急性酒精性肝损伤的保护作用[J].安徽医科大学学报,2009,44(3):359-362.
[8]WANG A Y,LIAN L H,JIANG Y Z.Gentiana manshurica Kitagawa prevents acetaminophen-induced acute hepatic injury in mice via inhibiting JNK/ERK MAPK pathway[J].World J Gastr,2010,16(3):384 -354.
[9]MENG Q,RU J H.Reevaluation of tacrine hepatotoxicity using gel entrapped hepatocytes[J].Toxi Lett,2007,168(1):140-141
[10]巫国谊.N-乙酰半胱氨酸对实验性肝损伤模型保护作用及其机制研究[D].重庆:重庆医科大学,2004.
[11]李卫.重症急性胰腺炎大鼠肝损伤机制及NAC对肝的保护作用[D].衡阳:南华大学,2011.

