过硫酸钠热激活法深度氧化竹材制浆废水生化出水的研究
李四辉,施英乔,丁来保,崔宏辉,盘爱享,房桂干
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
国家对工业废水排放要求的进一步提高,推动了以羟基自由基HO·为主要活性物质的高级氧化技术(AOTs)在废水治理方面的研究和应用。相比于吸附、超滤、离子交换等深度处理工艺,高级氧化技术的特点在于氧化能力强、选择性小、反应速率快[1]。过硫酸盐作为H2O2衍生物具有氧化性,标准电极电势为2.01 V,相比而言,H2O2和MnO4-的标准电极电势为1.776 V和1.679 V,可是过硫酸盐在常温下较稳定,氧化活性较弱。然而经过热、金属离子等激活可产生强氧化性的HO·或类似于HO·的,HO·和·的氧化还原电势为2.8 V和2.6 V[2],致使过硫酸盐体系的氧化活性显著增强,从而实现对有机污染物的深度氧化,达到净水目的。然而芬顿(Fenton)体系生成HO·的较佳pH值为3~5,而热激活可以生成,对有机物的氧化性强,矿化程度高[3-4]。
过硫酸盐的激活方式包括热、紫外光、微波、过渡金属离子、双氧化剂、碱性条件等单一型激活和以过渡金属离子螯合、紫外光-过渡金属离子和热-过渡金属离子等复合型激活[5]。热激活过硫酸盐的原理是加热升温,吸收的能量大于激活能,造成Na2S2O8分子结构的O—O键断裂而生成反应活化能为140.2 kJ/mol[6]。·含有一个未成对电子,具有极强的配对倾向,性质活泼,反应性极强。研究表明过硫酸盐体系的氧化活性是HO·和共同作用的结果,受pH值等因素影响,当废水pH值为2~7时,活性物质以为主,而pH值大于10时,活性物质以HO·为主[7]。过硫酸盐广泛应用于游泳池保洁、皮毛漂白、金属显微蚀刻、印刷铜电路板、原位化学修复和化学分析等行业,在对氯苯酚[8]、刚果红[9]、多氯联苯[10]、三氯乙烯[11]、酸性橙 7[12]、聚乙烯[13]、丁基羟基苯甲醚[14]等污染物降解方面表现出较优的性能,据此以福建竹材化学机械法制浆废水经厌氧、好氧处理的生化出水为对象,采用热激活Na2S2O8体系进行深度氧化实验,研究热激活过程温度、pH值、Na2S2O8用量和反应时间等因素对生化出水COD去除效果的影响。
1 实验
1.1 仪器和药品
Na2SO4为光谱纯,K2CrO7为优级纯,乙醚、浓 H2SO4、(NH4)2Fe(SO4)2、AgNO3、Na2SiO3、Na2S2O8、二乙烯三胺五乙酸(DTPA)和MgSO4等均为分析纯,H2O2、NaOH为工业级。
南京科环公司KHCOD-12型消解仪;SD-9 011色度仪,Pt-Co比色法;上海雷磁公司DDS-11A型电导率仪;METTLER FE20型pH计;德国Jana公司Multi N/C2 100分析仪;德国HACH公司 DR5 000型紫外分光光度仪。
1.2 废水来源
采用福建竹材进行化学机械法制浆,工艺流程如图1。制浆工艺的热洗废水因受污染状况较轻而重复使用,在总污染负荷中的比重不足2%而予以忽略;将蒸挤废水、挤压废水和洗浆废水混匀即为制浆废水。
1.3 废水生化处理
调节制浆废水pH值6.5~7.5,采用上流式厌氧活性污泥床(UASB)进行两段厌氧生物化学法处理,其中一段厌氧过程维持UASB温度为35~37℃,污泥含量(MLSS)为10~17 g/L,水力停留时间(HRT)为12~18 h,单位时间单位质量活性污泥的化学需氧量(COD)承载负荷(L)为0.63~1.42 kg/(kg·d),单位时间 COD 容积负荷(S)为 9.93 ~16.98 kg/(m3·d),不排泥[15];二段厌氧过程维持温度为 35~37℃,MLSS为 11~16 g/L,HRT为 8~10 h,L为 0.63~1.42 kg/(kg·d),S为9.93~16.98 kg/(m3·d),过程排泥周期为7 d,排泥比例为5%。厌氧出水进入间歇式活性污泥床反应器(SBR)进行好氧处理,维持温度为18~25℃,HRT为8~10 h,MLSS为2.6~3.7 g/L,活性污泥指数(SVI)为50.2 ~73.9,L 为0.20 ~0.40 kg/(kg·d),微孔曝气维持溶解氧浓度为 4.88 mg/L,排泥周期为5 d,期间视污泥和处理参数补充能源和营养物质,运行5个月得到生化出水。

图1 竹材化学机械法制浆流程图Fig.1 The flow sheet of chemical mechanical pulping process by ues of bamboo
1.4 过硫酸钠热激活法实验
以生化出水为实验对象,用1 mol/L的NaOH和H2SO4溶液调节废水的pH值为2~12,取100 mL水样放置在转速调为4档的恒温磁力搅拌器上搅拌,将温度探头悬空放置于烧杯并设置为12、20、30、40和50℃,温度升高到指定温度时分别加入用量为0.25~2.50 kg/t的Na2S2O8时开始计时,30 min后停止搅拌,取下烧杯放置于恒温水浴箱30 min后取样测定COD值;此外,在40℃下,调节反应时间为20~100 min(恒温搅拌时间和恒温水浴时间均等),加入适量的Na2S2O8重复上述操作以探究反应时间的影响。
1.5 COD 测定
按照标准回流法进行消解,向消解瓶中依次加入10 mL水样、12 mL浓硫酸和5 mL K2Cr2O7溶液(0.200 mol/L)后,加热回流2 h后,用30 mL去离子水洗涤回流管,静置冷却后采用硫酸亚铁铵溶液滴定法测定COD。COD去除率(η)用如下公式计算:

式中:COD1—废水处理之前COD初值;COD2—废水处理后废水上清液或出水的COD值。
2 结果与讨论
2.1 废水分析
竹材化学机械法制浆过程耗水量较少,为25.43 m3/t,而制浆废水污染物含量较高,单位竹浆的COD污染负荷达190.21 kg/t。废水量和污染负荷主要与浆性能要求相关,浆的白度、松厚度、撕裂指数等性能要求高,则对原料进行机械、化学作用的强度较大,导致制浆过程产生的微小悬浮物及大分子类物质多,经洗涤进入废水造成COD较高。制浆废水的分析结果见表1。废水的色度高达7 541度,电导率也较高,主要是因为在一段浸渍和二段浸渍过程无机类药品用量较多,化学和机械作用使竹材遭到破坏,木质素和半纤维素、色素类物质[16]的分解产物进入废水,致使色度较大;过量的药品及反应产物经洗涤进入废水造成电导率较高。废水pH值为4.58,酸性较强的主要原因是需要在pH值为4时进行酸化以稳定浆的性能,而洗浆耗水量所占比重大,脱水后大量酸进入废水。废水静置后,测定上清液总有机碳(TOC)为6 460 mg/L,而废水完全混合时的TOC值为6 760 mg/L,可见废水水质较为均匀稳定,竹材碎片或大分子有机物等影响有机碳含量的可沉降类物质较少。此外废水总氮(TN)含量较高,生化处理过程微生物所需氮元素较为充足。
2.2 生化处理出水分析
制浆废水经1.3节两段UASB和一段SBR处理后,出水水质见表1。可见制浆废水经过生化处理,COD 从8 491 mg/L降低至144 mg/L,电导率p仅下降29.75%,而COD、TOC、TN、SS(悬浮物)等去除率均高于97.35%,色度从7 541度降低至200度,说明生化过程对无机离子类物质的去除效果差,而有机污染物去除效果较好。

表1 竹材化学机械法制浆废水性质Table 1 The wastewater properties for bamboo in chemical mechanical pulping craft
2.3 过硫酸钠热激活法实验影响因素
2.3.1 温度的影响 为研究温度对热激活Na2S2O8处理生化出水的效果,进行空白实验以考察Na2S2O8加入量为0时,温度对水样COD的影响,结果如图2所示。可知,温度由12℃增加至50℃时,COD值微微降低,其中温度超过40℃时,COD开始降低,而50℃时,COD降低3 mg/L,这可能是温度升高引发稳定性稍差的有机物分解所致,然而温度升高引起废水COD的降低较小。
调节Na2S2O8用量,温度对COD的影响见图2。分析可知,相同Na2S2O8用量时,温度升高,COD先保持不变再迅速减低,最后出现轻微下降或增加。当Na2S2O8用量为0.25 ~1.75 kg/t时,随着温度升高至30℃,COD基本保持不变,但是COD均高于处理前;在30~40℃时,COD迅速降低,增加Na2S2O8用量,COD下降明显,在40℃、1.75 kg/t时,具有最小值为75 mg/L;温度升高至 50℃时,COD降低较小,Na2S2O8用量增加,COD进一步降低,其中用量为1.50 kg/t,温度为50℃时,降幅最大为14 mg/L,此时COD为65 mg/L,水质较好。然而,Na2S2O8用量为2.00~2.50 kg/t时,在12~30℃时,随着温度的升高,COD缓慢降低;在30~40℃时,COD迅速降低,Na2S2O8用量增加,COD下降减少,在40℃、2 kg/t时,具有最小值为75 mg/L,此时COD降低幅度为68 mg/L;温度升高至50℃时,COD反而升高,用量越多,升高越明显。

图2 不同Na2S2O8用量时温度对COD的影响Fig.2 Effect of the temperature on COD at different dosages of Na2S2O8
2.3.2 pH值的影响 实验测知生化出水的总无机碳含量(TIC)较低,为81 mg/L,则可忽略废水自身的缓冲作用,计算100 mL废水,调节pH值为2和12时所需H2SO4和NaOH溶液的体积最大,分别为0.5 mL和1 mL,体积增加0.5%和1%,故pH值调节对废水COD的稀释效应也可忽略。

图3 不同Na2S2O8用量时pH值对COD的影响Fig.3 Effect of the pH value on COD at different dosages of Na2S2O8
不同Na2S2O8用量时,pH值对废水COD的影响,结果见图3。分析可知,随着pH值的降低,COD值逐渐降低。当pH低于6时,COD降低现象比中性和碱性条件更明显,pH值为2时,废水COD为128 mg/L,COD较原水下降了16 mg/L,这主要是因为在一段和二段浸渍过程,强碱性NaOH与原料的部分木质素发生化学反应,生成的可溶性碱木质素经洗涤进入废水,而当调节废水pH值为强酸性时,H+取代碱性木质素中的Na+成为不溶性酸性木质素而发生木质素酸析效应,实验过程中观察到烧杯底部沉积的少许浅棕色物质应该即为酸性木质素类物质,从而导致pH值为2~4时COD下降明显。然而,除了在pH值小于4时,pH值对废水COD的影响并不显著。

在12℃,Na2S2O8用量为2和2.5 kg/t时反应1 h,pH值对废水COD的影响如图3所示,可见随着pH值的增加,废水COD值变化较为复杂。在pH值为6~8的近中性条件下,废水的COD值为145和129 mg/L,然而pH值为4时,COD增加的原因可能是H+浓度增加导致起氧化作用的比例减少,造成更多的因为氧化性弱于而引起COD升高,而pH值为2时COD再次降低应当是受木质素酸析效应的影响。pH值为12时,废水COD值最低,分别为121和106 mg/L,说明碱性激活效应对废水中污染物的降解作用比酸析木质素和自身氧化作用强,但是pH值为10时,COD高于pH值为8和12的原因不清楚,有待进一步研究。
2.3.3 Na2S2O8用量的影响 调节废水至相同温度,Na2S2O8用量与COD关系如图4所示。分析可知,Na2S2O8用量对COD的影响与温度有关。在12℃时,随着Na2S2O8用量的增加,废水的COD值先增加后降低,最终COD在129 mg/L处趋于稳定,降解效果较差。当Na2S2O8用量为0.25、0.50和 0.75 kg/t时,废水的 COD 依次为 169、194 和 207 mg/L,反而造成废水COD升高,这应该是因为未有效激活Na2S2O8生成活性自由基,而在废水消解测定COD时因氧化性弱于强酸环境中的而被氧化为Na2SO4,造成处理后废水的COD值不降反增。在Na2S2O8用量高于0.75 kg/t时,COD随着 Na2S2O8用量的增加而降低,说明Na2S2O8参与有机物氧化反应的比例增加。当Na2S2O8用量增加为2 kg/t时,COD逐渐降低为145 mg/L,与原废水COD相当,表明此时Na2S2O8参与污染物氧化引起COD降低值与自身引起COD增加值相当。增加Na2S2O8用量至2.25 kg/t,COD降低变慢,当Na2S2O8用量为2.5 kg/t时,COD降低至129 mg/L,COD降低了15 mg/L,去除率仅为10.39%,说明在常温下Na2S2O8对废水中污染物的氧化作用较弱,COD去除率较低。在20、30和35℃时,Na2S2O8用量对废水COD影响的变化规律与12℃时类似,用量为2.5 kg/t时,废水COD值最低,分别为124、122和103 mg/L,去除率仅为13.89%、15.28%和27.46%。

图4 不同温度时Na2S2O8用量对COD影响Fig.4 Effect of the dosage of Na2S2O8at COD in different temperatures
在40和50℃时,随Na2S2O8用量的增加,废水COD值先降低再升高,Na2S2O8用量为1.5 kg/t时,COD达最低值,分别为79和65 mg/L,此时对废水的降解效果最好,去除率最大为45.14%和54.86%,此时废水达到80 mg/L的国家排放标准。这说明升高温度可以有效促进激活,氧化活性明显增强。然而,在40℃时,COD降低速度小于50℃时,说明温度越高,Na2S2O8激活效果越明显,这应该是热激活Na2S2O8生成的结果。Na2S2O8用量增加至2.5 kg/t的过程中,COD逐渐升高至98和123 mg/L,说明温度升高可以增强Na2S2O8的氧化活性,但是Na2S2O8存在最佳用量,Na2S2O8并非越多越好,这可能是因为具有极强活泼性的·可以与·发生自由基连锁反应造成氧化活性变差[17]。
2.3.4 反应时间的影响 自由基含有未成对电子,具有极强的电子配对倾向,具有反应性强、选择性差、寿命短[16]的特点。活泼羟基自由基HO·的寿命短于10-6s,氧化有机物的过程在极短时间内完成。SO4-·的寿命也非常短暂,热激活过硫酸盐过程应用于废水污染物的去除的机理同样为自由基反应,以生产应用中Fenton试剂的反应时间为5~10 min为参考,而废水在Na2S2O8热活化反应中有固体物质析出,加大了自由基反应动力学过程研究的难度,在保证反应充分进行的前提下缩短反应时间,因而设计Na2S2O8热激活体系反应时间为20~100 min,研究在40℃和不同Na2S2O8用量时,反应时间对废水COD的影响,结果见图5。当Na2S2O8用量为1.25~1.75 kg/t时,反应时间增加,废水COD值出现波动,但是基本保持不变。经数据分析可知,相同Na2S2O8用量时,不同反应时间测得COD值的极差依次为3、4和4 mg/L,最大偏差依次为2、2和3 mg/L,最大相对偏差依次为2.02%、2.53%和3.95%,可见随着反应时间的延长,废水COD几乎无变化,过硫酸盐热激活反应在20 min内反应已经较为充分,Na2S2O8热激活实验的反应时间为60 min,所得实验结果准确可靠。
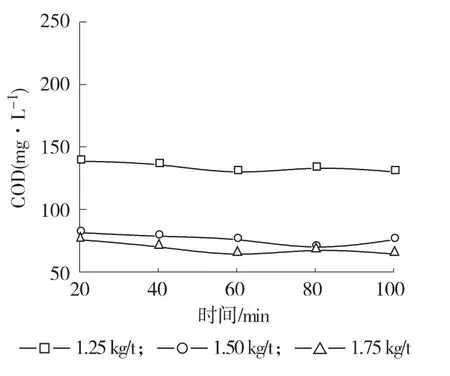
图5 不同Na2S2O8用量时反应时间对COD影响Fig.5 Effect of reaction time on COD at different dosage of Na2S2O8
3 结论
3.1 竹材制浆废水不仅酸性强、色度大,而且有机物含量高,COD达8 491 mg/L,TOC高达6 760 mg/L,色度达到7 541度。废水经过UASB-SBR处理后的生化出水,COD为144 mg/L,TOC为48 mg/L,色度为200度。
3.2 采用Na2S2O8热激活法深度氧化生化出水,温度升高,氧化活性增强,但是并非越高越好。温度升高,COD先保持不变再迅速降低,最后出现小幅下降甚至增加。
3.3 Na2S2O8用量增加,COD降低。Na2S2O8用量对COD的影响还与温度有关。温度升高,COD具有最小值时Na2S2O8用量减小。在温度为50℃,Na2S2O8用量为1.5 kg/t时,COD达到最低值65 mg/L,去除率为54.86%。
3.4 随着pH值增加,COD变化复杂。Na2S2O8热激活体系,pH值对废水COD的影响体现在既可以在强酸性时发生木质素酸析效应,又可以在碱性时影响体系起主要活性物质的自由基类型。
3.5 Na2S2O8热激活体系反应性很强,反应20 min内基本完成,延长反应时间,COD值几乎不变。
[1]陈晓旸.基于硫酸自由基的高级氧化技术降解水中典型有机污染物研究[D].大连:大连理工大学博士学位论文,2007.
[2]关英红,马军,方晶云.UV/PMS体系中BrO3-的生成和控制[J].黑龙江大学自然科学学报,2012,29(4):526-529.
[3]PEYTON G R.The free-radical chemistry of persulfate-based total organic carbon analyzers[J].Marine Chemistry,1993,41(1):91-103.
[4]ANIPSITAKIS G P,DIONYSIOU D D.Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J].Environmental Science & Technology,2003,37(20):4790-4797.
[5]BLOCK P A,Brown R A,Robinson D.Novel activation technologies for sodium persulfate in situ chemical oxidation[C].Proceedings of the Fourth International Conference on the Remediation of Chlorinated and Recalcitrant Compounds.2004:24-27
[6]杨照荣,崔长征,李炳智,等.热激活过硫酸盐降解卡马西平和奥卡西平复合污染的研究[J].环境科学学报,2013,33(1):98-104.
[7]LIANG C J,BRUELL C J,MARLEY M C,et al.Persulfate oxidation for in situ remediation of TCE(Ⅰ).Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J].Chemosphere,2004,55(9):1213-1223.
[8]赵进英,张耀斌,全燮,等.加热和亚铁离子活化过硫酸钠氧化降解4-CP的研究[J].环境科学,2010,31(5):1233-1238.
[9]张乃东,朱正江,栾万利.日光/Fe2+/S2O2-8体系中酸性刚果红的降解机理[J].化学学报,2011,69(19):2307-2312.
[10]KILLIAN P F.Peroxydisulfate oxidation of PCBs,chlorobenzenes and MGP waste[D].USA:University of Massachusetts Lowell,2004.
[11]LIANG C,BRUELL C J,MARLEY M C,et al.Persulfate oxidation for in situ remediation of TCE(Ⅱ).Activated by chelated ferrous ion[J].Chemosphere,2004,55(9):1225-1233.
[12]YANG S,WANG P,YANG X,et al.A novel advanced oxidation process to degrade organic pollutants in wastewater:Microwave-activated persulfate oxidation[J].Journal of Environmental Science,2009,21(9):1175-1180.
[13]PRICE J,CLIFTON A A,KEEN F.Ultrasonically enhanced persulfate oxidation of polyethylene surfaces[J].Polymer,1996,37(26):5825-5879.
[14]LAU T K,CHU W,Graham N J D.The aqueous degradation of butylated hydroxyanisole by UV/S2O82-:Study of reaction mechanisms via dimerization and mineralization[J].Environmental Science & Technology,2007,41(2):613-619.
[15]沈建,唐大为,李心亮.注册环保工程师专业考试复习教材[M].3版.北京:中国环境科学出版社,2011:190-192.
[16]詹怀宇,刘秋娟,陈嘉川,等.制浆原理与工程[M].3版.北京:中国轻工业出版社,2011:162-175.
[17]林亲铁,刘国光,刘千钧.微波强化氧化处理难降解有机废水研究进展[J].工业水处理,2012,32(2):1-3.

