一氧化氮处理对香蕉多聚半乳糖醛酸酶及MaPGs基因表达的影响
吴 斌, 郭 芹, 王刚霞, 陈维信, 李雪萍*
1.华南农业大学园艺学院,广东省果蔬保鲜重点实验室,广州 510642;
2.新疆农业科学院农产品贮藏加工研究所,乌鲁木齐 830091;
3.中国农业科学院农产品加工研究所,农产品贮藏保鲜与物流研究室,北京 100193
香蕉(Musaspp.cv.Brazil)是典型的呼吸跃变型果实,在采后很短的时间会发生大量的生理生化变化[1],硬度、外观、风味和营养价值都会降低。因此,该果实的货架期较短。软化是香蕉成熟过程的一个显著变化,制约了香蕉的市场销售。研究发现导致软化的主要原因是细胞壁软化酶的组成和结构发生了变化,例如果胶甲酯酶(PME)、多聚半乳糖醛酸酶 (PG)、果胶裂解酶(PL)和纤维素酶 (Cx)[2~4]等。其中,PG的主要功能是降解细胞壁和果胶成分,对果实的成熟软化起重要作用[5,6],但其具体作用机理尚不清楚。目前,虽然已在香蕉果实中克隆到4个PG家族基因[3,7],但是从基因表达揭示调控作用机制的研究报道较少,通常采用热处理、植物生长调节剂和化学添加剂等[3,8]调控香蕉果实的采后软化。
一氧化氮(NO)作为一种生长调节剂,可控制许多植物的生长、成熟和抗病性[9~11],但对 NO在采后香蕉果实贮藏中的研究报道较少。本研究以‘巴西’香蕉为试材,研究NO处理果实中PG活性及MaPGs基因表达的变化,探讨NO延缓香蕉果实软化的分子作用机理,为进一步深入研究NO在果蔬采后的应用提供理论基础。
1 材料与方法
1.1 试验材料
供试的香蕉品种为‘巴西’(Musa spp.cv.‘Brazil’),2010年10月采自广州市番禺宝升生态农场,采后立即运回实验室,选取成熟度一致(绿熟)、大小均一、无病虫害、无机械伤的果实,用2g/L强力溶液浸泡10min,再用500μL/L的抑菌鲜浸果1min,晾干备用。
NO气体,纯度99.9%,购自广州市世源气体有限公司。
1.2 仪器与设备
GC-2014C型气相色谱仪,日本岛津公司;UV-2450型紫外分光光度计,日本岛津公司;3k15型台式高速冷冻离心机,德国SIGMA公司;5542型果蔬材料硬度测试机,美国INSTRO公司;iCycleriQ5实时荧光定量PCR仪,美国Bio-Rad公司。
1.3 处理方法
在20℃条件下,将香蕉置于密封箱内(30.8L),进行 NO 处理,具体操作参照郭芹等[10]方法,在无氧 N2环境下,通入40μL/L NO气体,熏蒸3h,处理完后装入厚度为0.03mm的保鲜袋内装箱,在20±1℃、相对湿度85%条件下贮藏。对照组通入N2维持3h,其他条件不变。各处理均设3个重复,每个重复60个果实。
1.4 乙烯和硬度的测定
各处理分别取5个果实,在20℃条件下密封2h后抽取气体测定乙烯释放量。乙烯含量采用GC-2014C型气相色谱仪测定,色谱条件为:采用不锈钢色谱柱,柱温80℃,进样口温度140℃,氢火焰离子检测器(FID)温度150℃,气体样品进样量1mL。重复3次取平均值,以μL/h·kg·FW表示。硬度测定采用5542型果蔬材料硬度测试机测定,探头直径为8mm。以300mm/min速度在每果赤道线均匀测5个点,最大硬度值用牛顿(N)表示,取平均值。
1.5 多聚半乳糖醛酸酶(PG)活性的测定
多聚半乳糖醛酸酶(PG)活性参照Guo等[12]的方法测定,以每分钟每克鲜样37℃时分解果胶产生1μg游离半乳糖醛酸定义为一个果胶酶活性单位(U)。
1.6 RNA提取和cDNA合成
采用 TRIzol试剂盒(Invitrogen,上海,中国)提取香蕉果实总RNA,RNA的完整性通过1.2%琼脂糖凝胶电泳确定。cDNA的合成参照Guo等[12]方法。
1.7 MaPGs基因表达量实时荧光定量PCR检测
使用iCycler iQ5实时定量PCR仪进行RT-PCR检测,反应体系(20.0μL)为:10.0μL SYBR©qPCR Mix,2.0μL cDNA,6.0μL ddH2O,上下游引物各1.0 μL(引物浓度10μmol/L)。运行程序为:95℃预变性30s;95℃变性5s,50℃退火10s,72℃延伸10s,40次循环。每个样品重复3次。
以香蕉Actin基因(登录号为:AF246288.1)作为内参,参照MaPGs基因序列设计特异性引物。引物对为:MaPG1-F:5′-TGTCGTCGGTCTCATCAA-3′,MaPG1-R:5′-GGTGCATTCCATGTGTATTC-3′,(登录号:AF311881);MaPG2-F:5′-TCATTACAGCATTGAAGGGAAA-3′,MaPG2-R:5′-GTCAAGTTATTTGGGGTGCATT-3′,(登录号:AF311882);MaPG3-F:5′-GCACCCAACATCACTCTATC-3′,MaPG3-R:5′-AGGGAATCGTCAGCGTCT-3′,(登录号:AY603339.1);MaPG4-F:5′-GTATTGGAAGCTTAGGAAAGCAG-3′,MaPG4-R:5′-ACGGTGTCCATGCGTATGTT-3′, (登录号:AY603341);Actin-F:5′-GAGAAGATACAGTGTCTGGA-3′, Actin-R: 5′-ATTACCATCGAAATATTAAAAG-3′。采用姜妮娜等[6]方法计算基因相对表达量。
1.8 数据统计与作图
使用SigmaPlot 12.0(Systat Software Inc.,San Jose,CA,USA)软件作图;使用SPSS 16.0(Version 16.0,SPSS Inc.,Chicago,IL,USA)在P=0.05水平进行显著性(LSD)分析。测得值均以平均数 ±标准误 (S.E.)表示。
2 结果与分析
2.1 NO处理对香蕉果实乙烯释放量的影响
乙烯在果实成熟过程中起着重要的调节作用,这种作用通过乙烯生成量的增加和组织对乙烯敏感性的改变而实现。从图1可知:香蕉果实在贮藏前5d都无乙烯产生,从第16d开始对照果实乙烯释放量迅速增加,在第23d达到最大值,之后开始下降。NO处理果在贮藏的前23d乙烯释放量较低,在第25d达到最大值,是对照果峰值的0.77倍。结果表明,NO处理可降低香蕉果实乙烯释放量,延缓乙烯峰值的出现。

图1 NO处理对香蕉果实乙烯释放量的影响 Fig.1 Effect of NO treatment on ethylene production of banana fruit.
2.2 NO处理对香蕉果实硬度的影响
果实硬度是判断果实质地、反映果实贮藏性和衡量贮藏效果的主要指标。香蕉果实硬度在采后前21d下降缓慢,之后迅速下降,表明在此阶段果实快速软化,与乙烯的迅速释放量相一致。NO处理香蕉果实硬度的变化与对照相似,前期随着乙烯的缓慢释放逐渐下降,之后随着乙烯峰值的出现迅速下降,但在贮藏过程中硬度明显高于对照,在第27d果实的硬度是8.88N,约是对照(1.80N)的5倍(图2)。结果表明,NO处理显著抑制了乙烯的生成,从而延缓了香蕉果实硬度的下降,尤其在贮藏后期效果较为显著。
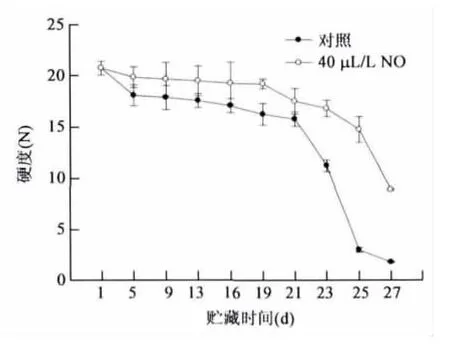
图2 NO处理对香蕉果实硬度的影响 Fig.2 Effect of NO treatment on firmness of banana fruit.
2.3 NO处理对香蕉果实多聚半乳糖醛酸酶(PG)的影响
多聚半乳糖醛酸酶在水果细胞壁的降解和软化过程起着重要作用。从图3可知,对照香蕉果实的PG活性从第0d的0.37U/g·min·FW 逐渐增加到第21d的0.94U/g·min·FW,之后开始下降。NO处理果PG活性在贮藏过程低于对照果,尤其是贮藏后期显著低于对照。

图3 NO处理对香蕉果实PG活性的影响 Fig.3 Effect of NO treatment on PG activity of banana fruit.
2.4 NO处理对香蕉果实MaPG1基因表达的影响
从图4可知,在香蕉的贮藏过程,对照果与NO处理果MaPG1基因表达的变化趋势相似,随着果实中PG活性的增加,MaPG1基因表达水平也逐渐增加,在第21d达到最大值,之后随着PG活性的下降逐渐降低,但NO处理果MaPG1的表达水平在贮藏过程与对照果无显著差异。

图4 NO处理对香蕉果实MaPG1基因表达的影响 Fig.4 Effect of NO treatment on the expression of MaPG1 of banana fruit.
2.5 NO处理对香蕉果实MaPG2基因表达的影响
对照香蕉果实MaPG2基因表达水平在贮藏过程逐渐增加,在第21d达到最大,之后开始下降,而NO处理的香蕉果实MaPG2基因表达水平在贮藏前13d与对照无显著差异,之后MaPG2基因表达水平显著低于对照(图5),说明NO对香蕉果实MaPG2基因表达有一定的抑制作用。
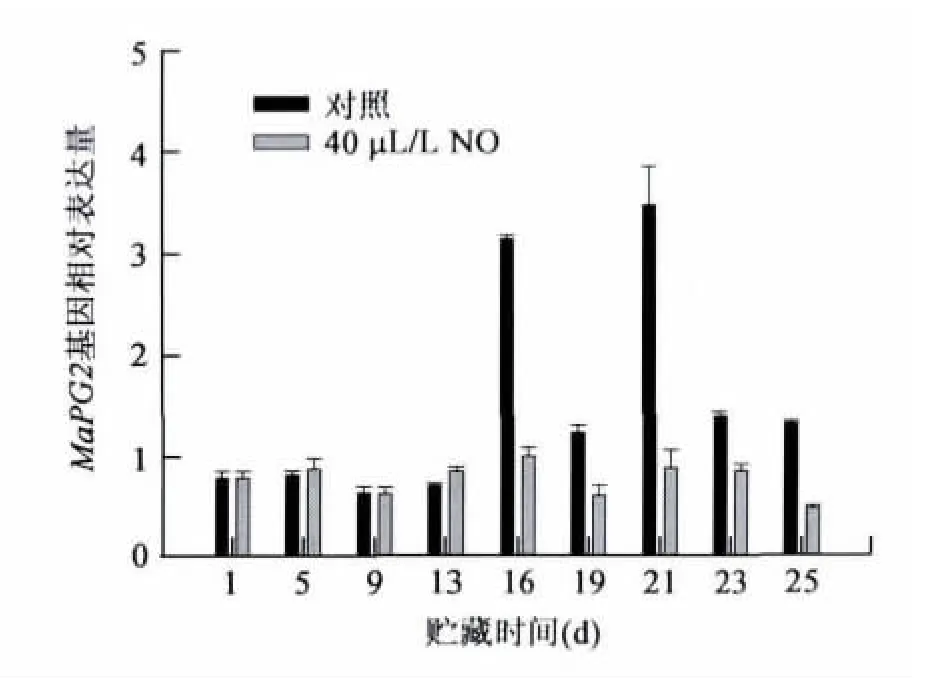
图5 NO处理对香蕉果实MaPG2基因表达的影响Fig.5 Effect of NO treatment on the expression of MaPG2 of banana fruit.
2.6 NO处理对香蕉果实MaPG3基因表达的影响
对照果与NO处理果MaPG3基因在香蕉果实的贮藏前13d表达较弱,从第16d开始对照香蕉果实MaPG3基因表达量迅速增加,在第23d达到最大值。NO处理的香蕉果实MaPG3基因在第25d才有较高的表达,说明NO可显著抑制贮藏过程香蕉果实MaPG3基因的表达。

图6 NO处理对香蕉果实MaPG3基因表达的影响 Fig.6 Effect of NO treatment on the expression of MaPG3 of banana fruit.
2.7 NO处理对香蕉果实MaPG4基因表达的影响
从图7可知,在贮藏过程中,香蕉果实的MaPG4基因在贮藏的前16d表达较弱,与低的乙烯释放量相一致,之后随着乙烯的迅速释放MaPG4基因的表达量急剧增加,在第23d达到最大,之后开始下降。NO处理果MaPG4基因在贮藏的前23d都表达较弱,随着乙烯峰值的出现表达量在第25d迅速增加。说明NO可显著抑制香蕉果实贮藏过程MaPG4基因的表达,并延缓基因表达峰值的出现。

图7 NO处理香蕉果实MaPG4基因表达的影响 Fig.7 Effect of NO treatment on the expression of MaPG4 of banana fruit.
3 讨论
香蕉果实软化是成熟衰老过程的重要特征,直接影响到果实的采后贮藏和商品价值。本研究的结果表明NO可显著抑制香蕉果实乙烯的生成,延缓硬度的下降,与NO对番茄、番木瓜、草莓的研究结果相一致[10,13,14]。已有研究表明 NO 可通过抑制果实1-氨基环丙烷-1-羧酸(ACC)氧化酶(ACO)的活性及CpACO1基因的表达量来降低乙烯释放量[15],从而延缓硬度的下降[12],这可能是NO与ACO反应生成ACO-NO配合物,再与ACC反应形成ACC-ACO-NO配合物,阻止了乙烯的产生。但也有研究发现果实成熟过程乙烯释放量的降低是由于NO与ACC合成酶(ACS)发生硝基化反应从而抑制了ACS的活性[16]。这些结果表明:NO降低乙烯释放量的机理可能还与果实的种类有关。
乙烯的迅速释放会加快果实的软化,果实的软化与细胞壁中果胶物质的增溶作用以及酶活性的变化有关[4,17]。香蕉果实软化是细胞壁中层结构变化,大量细胞壁结构丧失以及细胞壁物质降解,导致细胞发生分离所致。PG是导致细胞壁、果胶降解的主要因素,在果实成熟软化过程中起重要作用[6],PG活性的变化与乙烯及其合成相关酶的变化趋势一致,对果实的快速软化产生较大的影响[4,15]。本研究结果表明NO处理可延缓香蕉贮藏过程PG活性的增加,与Guo等[4]在番木瓜中的研究一致。PGs可以催化番茄果实中果胶分子β-(1,4)-聚半乳糖醛酸的裂解,从而参与果胶的降解,促进果实软化。NO可能是抑制了PG活性,从而阻止了果实细胞壁多糖中多聚半乳糖醛酸降解为半乳糖醛酸,维持了细胞壁结构的完整性。但是,对反义PG转基因番茄及成熟变异植株的研究发现,果实的硬度并非随PG活性及果胶的降解而变化,或者在抑制PG活性的情况下果实仍然变软[18],说明PG在果实成熟软化过程不是单独起作用,而是与软化调控网络中其它物质相互影响共同决定着果实的软化[4]。
PG基因的表达受乙烯调控,乙烯可以诱导绿熟期番茄PG mRNA的积累[6]。Wei等[19]研究发现乙烯利处理金冠苹果,PG基因表达量显著增加,且峰值极显著高于对照。Hiwasa等[20]发现丙烯能促进梨果实乙烯的产生、PG基因的大量表达以及果实的快速软化。本研究中发现NO处理的香蕉果实与对照相比,乙烯释放量明显降低,前期MaPGs基因表达量都很低,MaPG2、MaPG3和MaPG4基因表达峰值显著低于对照,出现的时间也被推迟,这些结果表明NO可下调MaPG2、MaPG3和MaPG4基因的表达,但对MaPG1基因的表达水平无显著影响,进一步说明MaPGs基因可能分别调控香蕉果实PG不同时期的表达,且这些基因的表达受乙烯调控,参与PG合成,但MaPG1基因对香蕉果实软化的影响不大。
40μL/L NO可降低‘巴西’香蕉果实乙烯释放量、延缓果实硬度的下降,也可抑制PG活性及MaPG2、MaPG3和MaPG4基因的表达来延缓果实的软化,但NO在香蕉果实软化调控网络中的信号途径还有待于进一步的研究。
[1] Huang H,Jing G,Guo L,et al..Effect of oxalic acid on ripening attributes of banana fruit during storage[J].Postharv.Biol.Technol.,2013,84:22-27.
[2] Nunes C,Santos C,Pinto G,et al..Effects of ripening on microstructure and texture of‘‘Ameixad’Elvas’’candied plums[J].Food Chem.,2009,115:1094-1101.
[3] Amnuaysina N,Jonesc M L,Seraypheapb K.Changes in activities and gene expression of enzymes associated with cell wall modification in peels of hot water treated bananas[J].Scientia Horticulturae,2012,142:98-104
[4] Guo Q,Wu B,Chen W,et al..Effects of nitric oxide treatment on the cell wall softening related enzymes and several hormones of papaya fruit during storage[J].Food Sci.Technol.Int.,2013,DOI:10.1177/1082013213484919.
[5] Crookers P R,Grierson D U.Trastructure of tomato fruit ripening and the role polygalacturonase isoenzymes in cell wall degradation[J].Plant Physiol.,1983,72(4):1088-1093.
[6] 姜妮娜,饶景萍,付润山,等.柿果实采后软化中PG酶活性及其基因DkPG1的表达[J].园艺学报,2010,37(9):1507-1512.
[7] Asif M H, Nath P. Expression of multiple forms of polygalacturonase gene during ripening in banana fruit[J].Plant Physiol.Biochem.,2005,43:177-184.
[8] de B Vilas-Boas E V, Kader A A. Effect of atmospheric modification,1-MCP and chemicals on quality of fresh-cut banana[J].Postharv.Biol.Technol.,2006,39:155-162.
[9] Zhang L,Zhu S,Chen C,et al..Metabolism of endogenous nitric oxide during growth and development of apple fruit[J].Scientia Horticulturae,2011,127:500-506.
[10] 郭 芹,吴 斌,王吉德,等.NO处理对番木瓜采后贮藏性的影响[J].食品科学,2011,32(4):227-23.
[11] Zheng Y,Shen L,Yu M,et al..Nitric oxide synthase as a postharvest response in pathogen resistance of tomato fruit[J].Postharv.Biol.Technol.,2011,60:38-46.
[12] Guo Q,Lv X,Xu F,et al..Chlorine dioxide treatment decreases respiration and ethylene synthesis in fresh-cut‘Hami’melon fruit[J].Int.J.Food Sci.Technol.,2013,48:1775-1782.
[13] Eum H L,Kim H B,Choi S B,et al..Regulation of ethylene biosynthesis by nitric oxide in tomato(Solanumlycopersicum L.)fruit harvested at different ripening stages[J].Eur.Food Res.Technol.,2009,228(3):331-338.
[14] 朱树华,周 杰,束怀瑞,等.一氧化氮延缓草莓成熟衰老的生理效应[J].中国农业科学,2005,38(7):1418-1424.
[15] 郭 芹,王吉德,李雪萍,等.一氧化氮处理对采后番木瓜果实乙烯生物合成的影响[J].广东农业科学,2013,(3):75-78.
[16] Zhu S H,Zhou J.Effect of nitric oxide on ethyleneproduction in strawberry fruit during storage[J].Food Chem.,2007,100:1517-1522.
[17] Brummell D A,Labavitch J M.Effect of antisense suppression of endopolygalacturonase activity on polyuronide molecular weight in ripening tomato fruit and in fruit homogenates[J].Plant Physiol.,1997,115:717-725.
[18] Smith C J S,Waterson C G,Ray J,et al..Antisense RNA inhibition of polygalacturonase gene expression on transgenic tomatoes[J].Nature,1998,334:724-726.
[19] Wei J M,Ma F W,Shi S G,et al..Changes and postharvest regulation of activity and gene expression of enzymes related to cell wall degradation in ripening apple fruit[J].Postharv.Biol.Technol.,2010,56 (2):147-154.
[20] Hiwasa K,Kinugasa Y,Amano S,et al..Ethylene is required for both the initiation and progression of softening in pear (Pyruscommunis L.)fruit[J].J.Exp.Bot.,2003,54(383):771-779.
——α-葡萄糖醛酸酶的研究进展*

