对我国定制式义齿监管现状的研究与对策
北京市医疗器械技术审评中心(100061)秦嘉 王晨 于泳 薛玲
1 前言
随着我国人们生活水平迅速的提高,百姓对于口腔医疗保健的重视也逐步提高,市场需求不断增加。属于应用范围广,影响大的民用产品。
自从义齿纳入医疗器械管理以来,各地食品药品监督管理局也相应制定了加强管理的措施。同时,我国也制定了相关的专业标准。这些都为我国齿科材料的监管提供了依据。但是伴随着义齿行业飞快的发展,我国目前的法规和相关标准都显得有些滞后,如何正视目前义齿监管存在的差距和问题,从促进义齿行业的长期稳定,健康发展的目的出发,深入研究创新既符合我国国情又适应现代化要求的义齿监管体系,是目前迫切需要解决的问题。
2 定制式义齿产品监管现状
2.1 定制式义齿纳入医疗器械统一监管
2002年9月17日,国家食品药品监督管理局正式发布国食药监械[2002]323号《关于规范口腔义齿生产监督管理的通知》,义齿产品正式纳入二类医疗器械进行管理。自此,定制式义齿的加工生产企业必须取得《医疗器械生产企业许可证》,义齿产品必须取得《医疗器械产品注册证书》。义齿加工企业在取得以上两样证书后方可接受有执业资格的医疗机构的委托加工[1]。
2003年12月23日,国家食品药品监督管理局正式发布国食药监械[2003]365号《关于印发定制式义齿注册暂行规定的通知》,这个文件的提出,明确指导了定制式义齿产品的注册管理工作,并明确规定了定制式义齿产品性能上的最基本要求。
以上两个文件的发布,标志着定制式义齿的向医疗器械体系监管过渡,进入了一个新的阶段[2]。
2.2 定制式义齿监管强度逐年加大
2009年7月6日,国家食品药品监督管理局正式发布国食药监械[2009]336号《关于加强定制式义齿生产监管的通知》,文件组要强调义齿加工企业应依据YY/T0287建立质量体系并有效运行,加强义齿产品在加工过程和使用过程的控制,并强调了义齿生产和使用环节的可追溯性要求[3]。
2010年3月22日,国家食品药品监督管理局正式发布国食药监办械监[2010]28号《关于加强定制式义齿注册产品标准管理的通知》,文件明确了定制式义齿需要执行的相关标准,并提出定制式义齿产品有害金属元素含量应明确控制的要求[4]。
2013年7月5日,国家食品药品监督管理局正式发布国食药监办械监[2013]30号《关于进一步加强定制式义齿生产监管的通知》,文件要求进一步加强对义齿生产企业的监管[5]。
从以上这些文件可以明显看出,国家对定制式义齿产品的监管力度逐年加大,也表明了国家对义齿行业彻底整顿的决心。然而,在多年的监管过程中,目前的监管体系和监管方式还不是很科学,需要进一步改进。
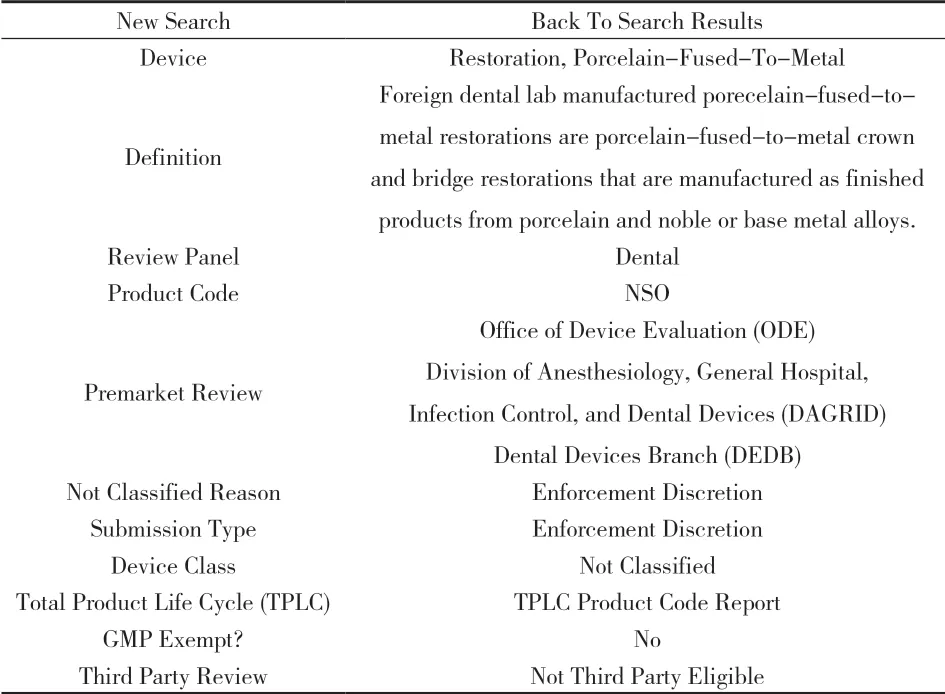
附图1 金属烤瓷修复体
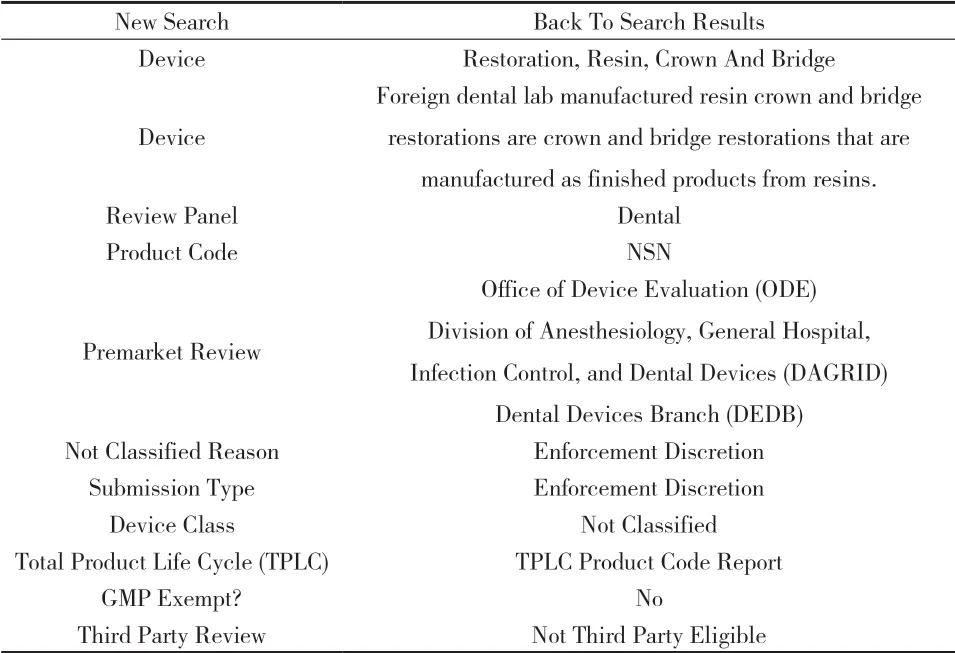
附图2 树脂、冠和桥
3 中国现行的定制式义齿监管体系存在的问题
3.1 目前的监管方式不科学,体系考核工作效率有限
从多年实践来看,我国现有的定制式义齿监管方式还不是很科学、有效。义齿生产企业的现场检查主要分为生产许可证验收和产品注册前的质量体系考核两个过程,两种检查相互分离,各自为战。部分检查内容重复,部分问题又缺乏共享和交流,浪费行政成本的同时,有时也给企业也造成困惑。
质量体系考核工作更是属于一次性、单兵作战式的检查,缺乏计划性和连续性,检查时机由企业申报决定,如此一来,监督人员到企业现场检查时很难看见义齿企业实际生产情况和过程,只能面对一些文件和记录对照标准检查其符合性,长此以往,企业形成习惯性的应对方案,体系考核工作也越来越流于形式,失去检查的实际初衷,自然而然最终的检查结果很难反映企业实际情况。
3.2 定制式义齿注册制度相对完善,但环节依旧复杂
定制式义齿产品注册工作很长时期以《医疗器械注册管理办法》和国食药监械[2003]365号文件为主要依据,对定制式义齿进行注册管理工作。随着义齿行业的发展,相关法规明显滞后,可操作性不强。然而最近国家局适时发布了《定制式义齿产品技术审查指导原则》,该指导原则大大帮助审评人员更好的掌握和理解该类产品的原理、结构、性能和预期用途等方面内容,注册工作已经得到更为明确的指导,一定程度上统一了审查尺度。
但就对义齿生产企业的调查问卷反馈的情况而言,部分定制式义齿生产企业仍然认为目前的产品注册流程过于复杂,时限冗长。从生产许可、检测、体系考核再到产品最后注册资料的编写递交,需要经历很长的周期,付出很多精力。
复杂的注册流程在一定程度上影响了部分潜在进入的企业能顺利完成产品最终注册的信心,出现了最不愿意看到的一些现象,比如黑义齿加工窝点增多,无证义齿产品私下交易,非法经营等问题,给义齿行业健康发展带来了负面影响。
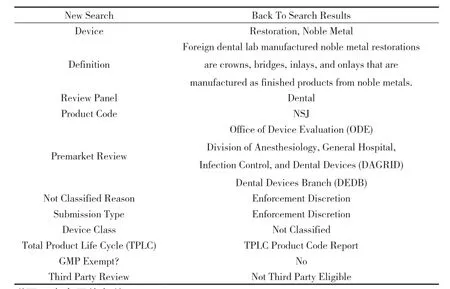
附图3 贵金属修复体
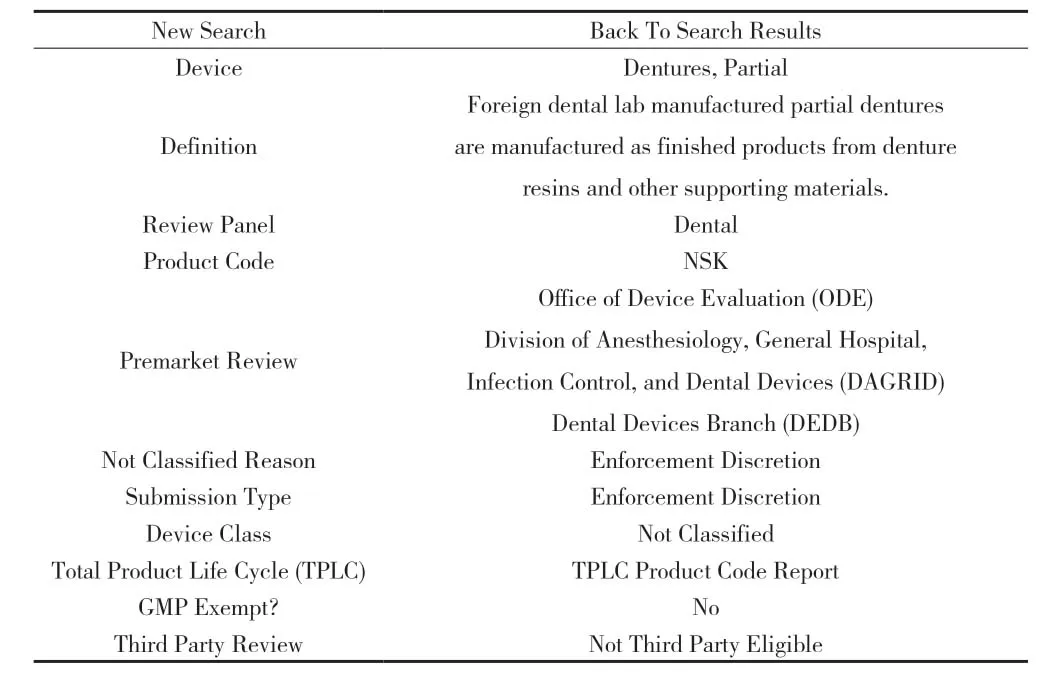
附图4 活动义齿、局部义齿
4 美国FDA对于义齿管理的相关介绍
通过咨询美国FDA在华办公室并从美国FDA的网站上信息检索,定制式义齿在美国FDA不作为医疗器械管理。美国FDA仅管理预成型或非定制义齿产品,如树脂牙,预成型牙冠等,已超出本文研究范围。对定制式义齿未见注册信息。下面附上本文研究获得产品分类信息(举例)的截图,说明FDA目前对定制式义齿暂未进行任何管理。
4.1 金属烤瓷修复体(见附图1) 通过附图1很明确地看出:①FDA给该产品赋予了一个唯一性的产品代码:NSO;②产品的分类级别:没有被分类;③不需要进行GMP现场检查;④没有相关的第三方审核。
4.2 树脂、冠和桥(见附图2)
4.3 贵金属修复体(见附图3)
4.4 活动义齿、局部义齿(见附图4)
5 健全我国定制式义齿监管体制的对策建议
5.1 优化定制式义齿监管的法律法规体系,强调基于风险控制的实质性审查
目前生产许可证现场检查和质量体系现场考核分列于企业产品注册的两个阶段,但部分检查内容重复,如企业的资源环境(生产设备、检验设备,人员资质,涉及生产过程的相关文件记录,检验过程的相关文件记录等等)。大量的重复工作既浪费了有限的行政成本,也容易出现各方要求尺度不一,给企业带来困扰的情况。
事实上,如果一个定制式义齿生产企业在其获得生产许可证时就具备了满足生产的各项设备,有合格的管理人员,有经验丰富的技术工人,并且从有资质的供货方选择优质的原材料,就为今后该企业的良性运行奠定了良好的基础。在生产许可证现场检查时已经可以完成这部分复核性质的工作。
体系考核工作时这部分内容就应该可以合理删减,而只针对企业实际运行过程进行实质性检查。但也应该明确,质量体系考核工作应该逐渐由被动的核查企业各项记录的符合性向产品加工制造过程中的实际风险控制过度,只有基于客观存在的风险进行分析及控制,才是现场检查的实际目的和意义。
通过前期设计的生产企业调查问卷相关内容的调查,多数企业和省局认为各企业定制式义齿的加工过程大体一致,所以生产过程环节应该以硬件设施是否具备为主要检查依据或者称为准入要求,而体系考核过程认为应该去更多的关注企业义齿产品源头(原材料的购进渠道和材料安全性)以及产品上市后的追溯渠道是否健全到位。
5.2 强调技术审评规范的执行,统一注册审查尺度
进一步宣贯并落实执行《定制式义齿产品技术审查指导原则》是统一注册审查尺度的好办法,该规范已经从定制式义齿的原理、结构、性能和预期用途等方面进行详细的规范,建议注册审查过程要严格执行此指导原则。
5.3 可以考虑产品注册备案制度,提高注册效率
定制式义齿产品从注册角度来谈,如果产品的原理、结构、性能和预期用途已经在指导原则内涵盖,可考虑备案注册制度。仅需要提供以下资料:生产许可证、产品标准、首次检测报告、体系考核报告或质量体系认证证书、注册登记表及使用说明书。

