外源性CSMD1对黑色素瘤A375细胞活性的影响
孙 强, 郭 澍, 唐明睿, 王玉新, 王 迪
实验研究
外源性CSMD1对黑色素瘤A375细胞活性的影响
孙 强, 郭 澍, 唐明睿, 王玉新, 王 迪
目的研究经pCDNA-3.0-CSMD1转染的A375细胞的活性,探讨外源性CSMD1的表达对黑色素瘤细胞活性的影响。方法培养人黑色素瘤A375细胞株,利用前期实验获得的CSMD1基因,构建质粒、转染细胞。A375细胞分为:A组,未转染的A375细胞;B组,经pCDNA-3.0转染的A375细胞;C组,经pCDNA-3.0-CSMD1转染的A375细胞。应用MTT法、细胞周期分析法、细胞凋亡相关检测(DAPI染色、Annexin V-FITC/PI双染、Transwell细胞迁移实验)等方法,检测A375细胞的活性,并进行统计学分析。结果C组细胞的增殖率明显低于其他两组细胞(P<0.05);C组细胞G1期的比例高于其他两组细胞(P<0.05);仅在C组细胞中发现凋亡细胞核固缩,并在48 h内出现核碎裂;C组细胞凋亡率为32.7%,明显高于A组(6.6%)和B组(8.4%)细胞(P<0.05);与A组和B组细胞相比,C组细胞极少迁移至聚碳酸酯膜下层(P<0.05)。结论外源性CSMD1可以抑制黑色素瘤A375细胞的活性,这有可能为黑色素瘤的治疗提供一种新的途径。
CSMD1; 黑色素瘤; A375细胞
CSMD1(Cub and Sushi multiple domain 1 gene)被认为是许多癌组织和细胞的抑制基因[1-2]。有学者报道,前列腺癌、膀胱癌和头颈部癌症患者不良的生存率与CSMD1的缺失有关[3]。然而,CSMD1在黑色素瘤中的作用还未被检验过。前期实验中,我们已首次证实,与正常皮肤细胞相比,黑色素瘤细胞中的CSMD1 mRNA和蛋白的表达水平明显降低[4]。本实验将研究经pCDNA-3.0-CSMD1转染的A375细胞的活性,探讨外源性CSMD1的表达对黑色素瘤细胞活性的影响,揭示CSMD1在黑色素瘤中的作用。
1 材料与方法
1.1 主要仪器与试剂 荧光显微镜(日本OLYMPUS公司);流式细胞仪、CellQuest软件(美国BD公司);微孔盘读取仪(美国BIO-RAD公司);博伊登室(美国CELLBIOLABS公司);CSMD1(前期实验获得);人黑色素瘤A375细胞株(美国菌种收集中心MD);DMEM培养基(美国GBICO公司);胎牛血清(杭州四季青公司);TUNEL试剂盒、碘化丙碇、DAPI、凋亡检测试剂盒(南京凯基生物科技发展有限公司);Lipofectamine 2000 (美国INVITROGEN公司);RNaseA、多聚甲醛(美国SIGMA公司);结晶紫(上海碧云天公司)染色。
1.2 A375细胞培养 将A375细胞接种于DMEM培养基,其中含胎儿牛血清和抗生素(100 U/ml 青霉素和100 μg/ml链霉素),置于37 ℃,5%CO2的培养箱进行培养。选取第4~8代细胞。
1.3 质粒建立和转染 将前期实验获得的CSMD1基因用HindⅢ酶切,并插入到哺乳类表达载体pCDNA-3.0中,形成pCDNA-3.0-CSMD1。依照产品说明书,用Lipofectamine 2000将质粒转染进入A375细胞。pCDNA-3.0转染作为对照。分别采用荧光显微镜和流式细胞仪检测转染效率。
1.4 MTT法检测 将未转染的(A组)、pCDNA-3.0转染的(B组)以及 pCDNA-3.0-CSMD1转染的(C组)A375细胞,分别置于96孔的培养皿中(每孔1500个细胞),在标准条件下培养。12 h后,用0.5 mg/ml MTT处理细胞4 h,然后用二甲基亚砜(DMSO)溶解细胞。用微孔盘读取仪测定吸光度为550~560 nm。
1.5 细胞周期分析 将细胞以1500 g的速度离心5 min,置于900 μl冷乙醇(70%)和100 μl PBS液的混合液中,冷藏1 h。细胞2次离心后,置于100 μl含RNaseA (0.2 mg/ml)的PBS液中,室温下存放30 min。细胞再次离心后,置于350 μl含碘化丙碇(50 μg/ml)的PBS液中行PI染色,用流式细胞仪进行FACS分析。
1.6 DAPI染色分析 将细胞以1×105/孔的密度在标准培养条件下保存于6孔板中。每孔中加入4%多聚甲醛,15 min后,行DAPI染色,以检测凋亡细胞。用荧光显微镜观察并拍照。
1.7 凋亡细胞的测定 在转染后48 h收集细胞,依据凋亡检测试剂盒说明书进行Annexin-V/FITC和PI双染。用CellQuest软件进行数据分析。
1.8 Transwell细胞迁移实验 迁移实验利用博伊登室(8 μm孔径聚碳酸酯膜)进行。细胞悬浮于含FBS的DMEM培养液中,浓度为3×105/ml。上室装载100 μl细胞悬液,下室装载600 μl含10%FBS的DMEM培养基质。在标准条件下培养12 h后,没有发现任何细胞漂浮于上室,表明此时细胞并没有发生凋亡。用棉签除去膜上层的细胞,将迁移至膜下层的细胞固定于4%多聚甲醛,用结晶紫染色。随机选择10个视野(400×),用光学显微镜计数细胞。每个实验步骤重复3次。
1.9 统计学分析 用SPSS 13.0统计软件进行统计学处理,其结果的比较采用t检验(单侧,不配对),P<0.05为差异具有统计学意义。
2 结果
MTT法检测显示,C组细胞的增殖率明显低于A组和B组(P<0.05,图1);细胞周期分析发现,C组细胞处于G1期的比例高于其他两组(P<0.05,图2);DAPI染色分析发现,仅在C组细胞发现凋亡细胞核固缩,并在48 h内出现核碎裂(图3);Annexin-V/FITC和PI双染检测结果显示,C组细胞凋亡率为32.7%,明显高于A组(6.6%)和B组(8.4%)细胞(P<0.05,图4);Transwell细胞迁移实验发现,与A组细胞和B组细胞相比,C组细胞较少迁移至聚碳酸酯膜下层(P<0.05,图5)。
3 讨论
黑色素瘤是由来源于神经嵴黑色素细胞的无限增殖并恶性转化所形成的一种高度恶性皮肤肿瘤,是遗传、环境等多种因素共同作用的结果。虽然发生率仅占皮肤恶性肿瘤的4%,但其死亡率却占因皮肤恶性肿瘤死亡率的80%。英国最新的一项研究报道称,目前恶性黑色素瘤(最危险的一种皮肤肿瘤) 患者10年生存率超过80%,而在19世纪70年代,该病的10年生存率只有50%左右。其原因很可能是由于目前该病治疗水平的提高和症状的较早发现[5]。肿瘤的侵袭和转移是恶性肿瘤最基本的生物学特征,同时也是恶性肿瘤的致死原因,是影响黑色素瘤生存的首要因素,同时也是治疗的最大障碍[6]。
研究表明,同其他肿瘤一样,黑色素瘤的侵袭和转移是一个涉及多层面、多步骤、多因素的极为复杂过程,包括癌基因的激活、抑癌基因活性减弱或消失,最终引起细胞活性的改变。本实验在CSMD1对黑色素瘤细胞活性的影响方面,进行了较为全面的研究。CSMD1基因定位于8p23.1,其表达降低已被证实与许多癌症相关,例如头颈部鳞状细胞癌[7]、前列腺癌[8]、结直肠癌[1]、卵巢癌[2]、乳腺肿瘤[9]和肝癌[10],但CSMD1在黑色素瘤中的作用还未被证实过。前期实验中,我们发现黑色素瘤中CSMD1 mRNA和蛋白的表达水平低于正常细胞,提示CSMD1可能是黑色素瘤的抑制基因。本实验发现,经pCDNA-3.0-CSMD1转染的A375细胞的增殖及迁移能力明显下降,并多数停滞在G1期,而且凋亡明显增加,即外源性CSMD1可以降低黑色素瘤A375细胞的活性。
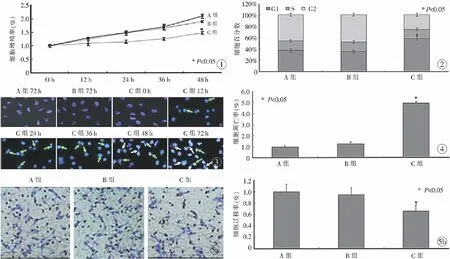
图1 细胞生长曲线图2 细胞周期分布图3 细胞核形态学变化(绿色箭头示核固缩;白色箭头示核碎裂)图4 细胞凋亡率图5 Transwell细胞迁移实验结果 a.膜下层细胞组织学观察 b.细胞迁移率
Fig1 The cell growth curve.Fig2 The cell circle distribution.Fig3 Morphological changes of the nucleus (blue arrow shows the karyopyknosis, white arrow shows the karyorrhexis).Fig4 The apoptosis rate.Fig5 The result of transwell assays. a. histological view of lower cells. b. the migration rate.
上述结果表明,CSMD1在黑色素瘤中具有抗肿瘤作用,有望成为黑色素瘤新的分子标志物;早期检测CSMD1的变化,对黑素瘤的早期诊断及早期治疗,具有借鉴价值,也可能提供新的治疗策略。但本实验仅为体外实验,所得结论还需要进一步的体内实验加以验证。同时,CSMD1在黑色素瘤中的抗肿瘤作用机制还有待于进一步研究。
[1] Farrell LC, Crimm H, Meeh P, et al. Somatic mutations to CSMD1 in colorectal adenocarcinomas[J]. Cancer Biol Ther, 2008,7(4):609-613.
[2] Wright K, Wilson PJ, Kerr J, et al. Frequent loss of heterozygosity and three critical regions on the short arm of chromosome 8 in ovarian adenocarcinomas[J]. Oncogene, 1998,17(9):1185-1188.
[3] Kerbel RS. A cancer therapy resistant to resistance[J]. Nature, 1997,390(6658):335-336.
[4] 唐明睿, 王玉新, 郭 澍, 等. CSMD1在黑色素瘤A375细胞中的表达及意义[J]. 中国美容整形外科杂志, 2013,24(4):253-255.
[5] 王亚丽. 恶性黑色素瘤诊断与治疗进展[J]. 中国综合临床, 2012,28(11):1226-1228.
[6] Garbe C, Peris K, Hauschild A, et al. Diagnosis and treatment of melanoma.European consensus-based interdisciplinary guideline-Update2012[J]. Eur J Cancer, 2010,48(15):2375-2390.
[7] Ma C, Quesnelle KM, Sparano A, et al. Characterization CSMD1 in a large set of primary lung, head and neck, breast and skin cancer tissues[J]. Cancer Biol Ther, 2009,8(10):907-916.
[8] Henshall SM, Afar DE, Hiller J, et al. Survival analysis of genome-wide gene expression profiles of prostate cancers identifies new prognostic targets of disease relapse[J]. Cancer Res, 2003,63(14):196.
[9] Kamal M, Shaaban AM, Zhang L, et al. Loss of CSMD1 expression is associated with high tumour grade and poor survival in invasive ductal breast carcinoma[J]. Breast Cancer Res Treat, 2010,121(3):555-563.
[10] Midorikawa Y, Yamamoto S, Tsuji S, et al. Allelic imbalances and homozygous deletion on 8p23.2 for stepwise progression of hepatocarcinogenesis[J]. Hepatology, 2009,49(2):513-522.
EffectsofexogenousCSMD1onactivityofA375melanomacells
SUNQiang,GUOShu,TANGMing-rui,etal.
(DepartmentofPlasticSurgery,theFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China)
ObjectiveTo study the activity of pCDNA-3.0-CSMD1 transfected A375 cells, and investigate effects of exogenous CSMD1 on activity of A375 melanoma cells.MethodsThe cultured A375 melanoma cells and CSMD1 gene which obtained by prevenient experiments were used to construct the plasmid and transfected A375 cells. The A375 cells were divided into the A group (the cells without transfection), the B group (the cells transfected with pCDNA-3.0) and the C group (the cells transfected with pCDNA-3.0 and CSMD1). The activity of A375 cells was detected with MTT assay, cell cycle analysis, measurement of apoptotic cell death (DAPI staining assay, Annexin-V FITC/PI double staining assay, Transwell migration assay) and the statistical analysis aws also performed.ResultsThe rate of cell proliferation in the C group was lower than those in the other groups (P<0.05), and its proportion of G1 phase was higher (P<0.05). Apoptotic nuclear condensation with nuclear fragmentation was only observed in the C group within 48 hours. The percentage of apoptosis in the C group was 32.7 %, which was significantly higher compared to Group A (6.6 %) and Group B (8.4%),P<0.05. The cells in the C group significantly less migrated to the lower membrane compared to cells in the A and B groups (P<0.05).ConclusionExogenous CSDM1 can inhibit activity of melanoma A375 cells, and may provide a novel target for clinical treatment.
CSMD1; Melanoma; A375 cell
10.3969/j.issn.1673-7040.2014.10.021
R619.6
A
1673-7040(2014)10-0638-03
2014-07-29)
110001 辽宁 沈阳,中国医科大学附属第一医院 整形外科
孙 强(1984-),男,辽宁人,主治医师,硕士.
郭 澍,110001,中国医科大学附属第一医院 整形外科,电子信箱:guoshu67@sohu.com

