曲马多在经皮穿刺肝肿瘤射频消融术中的应用
陈文会, 杨朝爱, 杨继金, 江 旭, 刘敬禹, 王卫星, 李 慧, 张华高
目前,射频消融(RFA)在肝脏肿瘤综合治疗中起重要作用[1-2]。已有数项临床前瞻性随机对照和回顾性研究表明其在小肝癌治疗中可获得与手术切除相近的疗效[3-4]。虽然RFA具有方便、安全、微创及患者恢复快等优点,但是还存在一定的不良反应,其中最主要的就是术中疼痛[5],一部分患者因无法耐受而影响治疗的顺利进行,因此很多情况下需在全麻下进行[6],由此引起的不良反应较多。在RFA术中使用一种简单有效的止痛方法,是临床治疗上亟待解决的问题。曲马多为非阿片类中枢镇痛药,具有双重镇痛机制,不良反应较少,临床上广泛用于术中及术后止痛[7]。本课题旨在研究曲马多在经皮肝肿瘤RFA术中的镇痛效果。
1 材料与方法
1.1 材料
1.1.1 病例入选标准 回顾性分析2012年1月—2013年5月我科行RFA治疗的原发性肝癌和转移性肝癌68例,所有患者签署手术知情同意书。
1.1.1.1 原发性肝癌:① 符合原发性肝癌临床诊断标准和(或)病理学诊断标准:直径 ≤5 cm的单发肿瘤或最大直径 ≤3 cm的3个以内多发结节;②影像学检查未见主要门脉癌栓和肝静脉癌栓形成;③无肝外转移,无肝功能衰竭,无明显凝血功能障碍 (凝血酶原活动度 >40%,血小板计数 >40×109/L);④ 既往无肝性脑病,无顽固性腹水或消化道出血病史。
1.1.1.2 转移性肝癌:原发病灶经手术病理或活检病理证实,除肝内病灶外无其他部位肿瘤转移,病灶经CT增强或MR增强证实,符合典型转移性肝癌影像学表现,如影像学表现不典型,则行细针穿刺活检,病理证实。肝内病灶<3个,病灶最大直径<5 cm。
1.1.2 排除标准 原发性肝癌中弥漫型肝癌;合并门静脉主干一二级分支或肝静脉癌栓;不可纠正的凝血功能障碍。转移性肝癌出现肝外转移或肝内病灶>3个,不在本研究之列。
1.1.3 仪器设备 仪器采用美国RITA射频肿瘤RFA系统1500型和2000型,主机能量分别为150 W和200 W。在超声或CT引导下制订进针点、进针途径,并用16 G多级电极针插入肿瘤内,内套针设置9支细针电极。设定消融温度为105℃,如患者不能耐受,则术中暂停治疗或调低消融温度。
1.2 方法
1.2.1 麻醉和镇痛方法 所有患者术前5 min予地西泮10 mg及盐酸哌替啶100 mg肌内注射,建立静脉通路,穿刺点2%利多卡因5~10 ml浸润麻醉。曲马多组在RFA开始前给予曲马多200 mg混合入5%葡萄糖液500 ml,持续静脉滴注,滴速30~40滴/min,手术结束前5 min停止用药。对照组无特殊干预手段。
1.2.2 观察指标 术中记录病灶大小、位置,消融直径,加热时间,消融时间、温度、功率及术中评分。术前向患者宣教视觉模拟评分(VAS)方法,“0”表示无痛,“10”表示疼痛无法忍受。
1.3 统计学方法
采用SAS9.2统计分析软件进行数据分析。计数资料列举频数进行描述,组间比较根据数据分布情况分别采用卡方检验、连续校正后的卡方检验或Fisher确切概率法。计量资料在正态性满足的情况下,采用进行统计描述;并依据组间方差齐性与否对两组间的比较采用t检验或Welch-Satterthwaite t检验,对于多组的比较则采用方差分析或Kruskal-Wallis检验。若不满足正态性条件则采用“中位数(Q1,Q3)”进行统计描述;2 组间的比较采用Wilcoxon Mann-Whitney检验,多组间则采用Kruskal-Wallis检验。正态性检验和方差齐性检验的检验水准均基于α=0.05。
疼痛评分为不满足正态分布的计量资料。对于分类指标与疼痛评分的相关性分析,当被考察的分类指标的类别共2种时采用Wilcoxon Mann-Whitney检验,超过2种时采用Kruskal-Wallis检验。对于连续型指标与疼痛评分的相关性分析则采用秩和检验法,包括Spearman和Kendall Tau秩检验法。
基于Mixed Model对与疼痛评分可能相关的因素造成的影响进行校正,再对曲马多组和对照组疼痛评分的差异进行检验,并给出各组的LS Mean及其两组间的差值(曲马多组-对照组),并对组间差异进行统计检验。当P<0.05时,则认为疼痛评分在两组间的分布差异具有统计学意义。
2 结果
2.1 一般资料在曲马多组和对照组分布的比较
两组间性别、BCLC分级、病灶位置、病灶大小、消融直径、加热时间、消融时间、温度的分布差异不具有统计学意义,而年龄、引导设备和手术中功率的差异具有统计学意义,见表1。
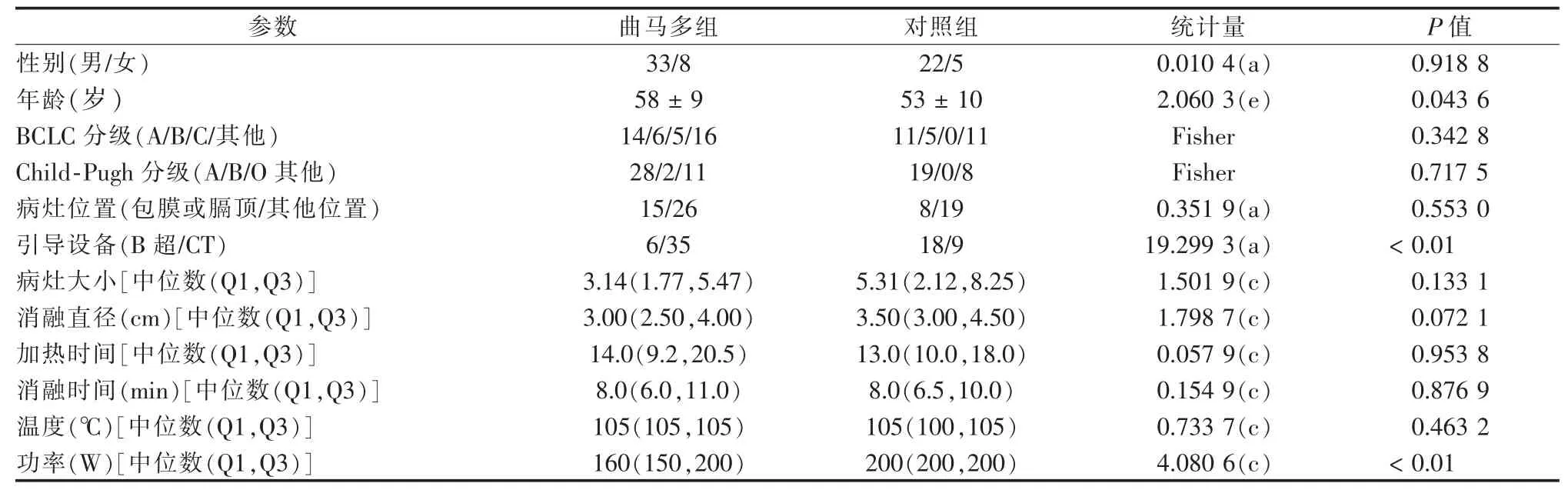
表1 患者一般资料的组间比较
对照组患者的疼痛评分较曲马多组要高,且具有统计学意义。这说明不同的处理组间,患者术中疼痛评分具有差异,由于疼痛评分受其他干扰因素的影响,所以两组间的具体差异需要在对干扰因素进行校正后才能下结论,见表2。

表2 两组间疼痛评分分布的比较
年龄和温度与疼痛评分存在负相关,且相关性具有统计学意义。即当年龄越大、温度越高时,患者的疼痛程度越低。病灶大小和消融直径与疼痛评分存在正相关,且相关性具有统计学意义。即认为当病灶面积越大、消融直径越大时,患者的疼痛程度越强。功率、加热时间、消融时间与疼痛评分存在正相关,即认为当功率越高、加热时间或消融时间越长时,患者的疼痛程度越强。但相关性不具有统计学意义,见表3。

表3 疼痛评分与考察指标的相关关系
3.2 基于Mixed模型对曲马多组和对照组对疼痛评分影响的分析
Mixed模型分析显示,在排除了潜在的干扰因素(年龄、性别、病灶位置、病灶大小、温度、加热时间)后,对照组患者疼痛评分的预期值为4.645,95%置信区间为(3.625,5.665);曲马多组患者疼痛评分的预期值为 2.383,95%置信区间为 (1.648,3.118);两组校正后的疼痛评分期望的差值为-2.262(曲马多组-对照组),95%置信区间为(-3.541,-0.983),对应的t检验P值为0.000 8。这说明曲马多组的校正后的疼痛评分预期要低于对照组,且两组之间的差异具有统计学意义。即曲马多组可以有效地降低患者术中疼痛评分,见表4。

表4 疼痛评分的Mixed模型分析结果
3 讨论
RFA治疗已经成为继手术切除、TACE后肝癌治疗的一大手段,在肝癌治疗领域起着越来越重要的作用。多个临床随机研究证实RFA治疗优于瘤内无水乙醇注射术和微波凝固术[8-9]。肝肿瘤RFA治疗多数采用经皮穿刺进行,治疗效果好,并发症少,患者恢复快,住院时间短[10]。但部分患者因术中疼痛明显无法耐受,使温度无法上升到预定的消融温度,而影响治疗效果。仅依赖穿刺点局部麻醉远远不能满足患者在治疗过程中对镇痛和镇静的需要。为了改善RFA治疗的舒适度,提高治疗的彻底性和安全性,很多情况下需采用静脉麻醉下行RFA,刘晓燕等[11]在肝肿瘤RFA时使用雷米芬太尼复合丙泊酚与芬太尼复合丙泊酚比较,发现两组均能达到手术要求的深度,雷米芬太尼组具有循环稳定,不良反应发生率低,丙泊酚用量减少的优点。但是静脉麻醉存在呼吸抑制、循环抑制、恶心呕吐等不良反应,如何既能够达到术中较好的止痛效果,又没有呼吸循环抑制等并发症,是我们在临床工作中急需解决的问题。
曲马多是一种人工合成的非阿片类中枢性镇痛药,首次剂量起效时间约为9.2 min,达到作用高峰时间约为30 min,单次使用镇痛作用持续5~6 h[12]。本研究中,在RFA开始时即开始静脉滴注,一般患者从局部麻醉至开始RFA所需时间为8~50 min,加热开始至消融开始时间波动在5~30 min,因此曲马多静脉滴注能够达到有效的止痛效果。
本研究结果显示,在排除了潜在的干扰因素(年龄、性别、病灶位置、病灶大小、消融温度、加热时间)后,使用曲马多也能够达到理想的止痛效果,对照组的疼痛评分较曲马多组高,两组之间的差异具有统计学意义。即曲马多组可以有效地降低患者术中疼痛评分。本组1例原发性肝癌肝移植患者第1次RFA治疗时未使用曲马多,疼痛评分为7分。5个月后,因又有新发病灶,再次予RFA术,其他处理方式都与前次相同,仅术中使用了曲马多静脉滴注,疼痛评分为0分。
值得一提的是,本研究统计结果显示,温度与疼痛评分存在负相关,且相关性具有统计学意义。即当温度越高时,患者的疼痛程度越低,但这是个因果倒置的结论,实际上,在RFA术中,因患者疼痛而不得不降低消融温度,在统计学上就显示成了温度与疼痛呈负相关的结果。患者年龄越大,对痛觉敏感程度降低,所以本研究也证实年龄越大,患者的疼痛程度越低。
功率、加热时间、消融时间与疼痛评分存在正相关,即功率越高、加热时间或消融时间越长,患者的疼痛程度越强。其实,这也很好理解,功率越大,产生的热量越多,引起的坏死、损伤也越大,感觉越明显,加热时间及消融时间越长,产热也越多,另外有时之所以加热或消融时间长,与患者术中疼痛需要反复停止、重复加热有关,虽然相关性不具有统计学意义,但病例数增多以后可能就会有显著性差异了。
机体对伤害性刺激,有3种经典感受器,包括温度、机械性和多调式感受器。当温度大于45℃时或温度上升大于5℃,温度感受器就可被激活。而多调式感受器能够感知高强度的机械性刺激、化学性刺激、热刺激和冷刺激,而这些感受器通常共同起作用。肝脏受交感和副交感神经共同支配,通常认为肝实质对疼痛不敏感。Lee等[13]对160例患者经皮穿刺肝肿瘤RFA术中及术后疼痛分析表明,病灶大小、与包膜的距离、与高的VAS评分具有相关性,这是在RFA过程中温度感受器和多调感受器被激活有关。本研究也证实病灶大小和消融直径与疼痛评分存在正相关,且相关性具有统计学意义。即病灶面积越大、病灶与包膜及邻近大血管的距离越近,消融直径也增大,患者的疼痛程度越强。
本研究存在一定的局限性,首先本研究是回顾性研究,未考虑到术前基础评分及术中VAS评分的变化,术前未对RFA的机器做严格要求,因此在本研究中使用两种型号的机器,且根据最后的统计结果显示,功率分布的差异具有统计学意义,但是,70%患者手术温度设定在105℃,且两组间温度设定的差异不具有统计学意义。在今后的研究中,应尽可能使用同一种功率的仪器,以提高射频操作的稳定性,达到较好的消融效果。其次,本研究未对不良事件进行统计分析;同时由于实验条件的限制未检测血压、心率、血氧等变化。
总之,在肝肿瘤患者进行RFA时,使用曲马多安全可靠,具有良好的止痛效果。
[1] 高恒军,陈敏山.射频消融治疗肝癌的选择与其联合治疗方式[J].中华肝脏病杂志, 2012, 20: 245-247.
[2] 王忠敏,陈克敏.影像引导下射频消融治疗的现状与进展[J].介入放射学杂志,2009,18:321-323.
[3] 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组.原发性肝癌规范化诊治的专家共识[J].肿瘤, 2009, 29: 295-304.
[4] Peng ZW, Lin XJ, Zhang YJ, et al.Radiofrequency ablation versus hepatic resection for the treatment of hepatocellular carcinomas 2 cm or smaller:a retrospective comparative study[J].Radiology, 2012, 262: 1022-1033.
[5] 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组.肝癌局部消融治疗规范的专家共识 [J].中华肝脏病杂志,2011,19:257-259.
[6] 潘 杰,陈绍辉,卢 欣,等.全麻下CT引导下经皮穿刺射频消融治疗肝内特殊部位的恶性肿瘤 [J].介入放射学杂志,2010, 19: 478-481.
[7] 赵 红,冯 艺,毛银泉,等.曲马多在不停跳冠状动脉旁路移植术后镇痛中的应用[J].临床麻醉学杂志,2012,28:778-780.
[8] Zhang YJ,Liang HH,Chen MS,et al.Hepatocellular carcinoma treated with or withoutethanolinjection: a prospective randomized trial[J].Radiology, 2007, 244: 599-607.
[9] Shibata T,Iimuro Y,Yamamoto Y,et al.Small hepatocellular carcinoma: comparison ofradio -frequency ablation and percutaneous microwave coagulation therapy [J].Radiology,2002, 223: 331-337.
[10]阚雪锋,郑传胜.射频消融治疗肝癌的进展[J].临床放射学杂志,2011,30:1227-1229.
[11]刘晓艳,王海燕,孙 莉.雷米芬太尼复合丙泊酚在肝脏肿瘤射频消融术麻醉中的应用 [J].中华临床医师杂志:电子版,2012, 06: 3383-3385.
[12]朱素洁,付春玲,张 蕾,等.单次静脉注射曲马多用于腹腔镜手术后镇静的效果 [J].临床麻醉学杂志,2012,28:922-923.
[13] Lee S, Rhim H, Kim YS, et al.Percutaneous radiofrequency ablation of hepatocellular carcinomas: factors related to intraprocedural and postprocedural pain [J].Am J Roentgenol,2009,192: 1064-1070.

