纳米抗体及其在诊断检测中的研究进展
孔庆明,姚亚波,陈睿,陆绍红
浙江省医学科学院寄生虫病研究所,浙江 杭州 310013
近年来,抗体技术已被广泛地应用于疾病的诊治领域,新型基因工程抗体不断出现,抗体小型化是抗体基因工程的主要研究方向之一。最新的单域抗体 (Single domain antibody,SdAb)是指保留了较好的抗原结合能力和专一性的VH小分子抗体片段,结构简单,容易进行体外规模化合成表达。SdAb体积约为完整抗体的1/12,具有较强的组织穿透能力,利于它们进入致密的组织以及穿透血脑屏障。这使它容易接近靶目标表面的沟、缝或被隐藏的抗原表位,识别许多传统抗体无法识别的抗原。然而,SdAb暴露了表面疏水基团,非特异性吸附增加,易凝结和黏附,须经结构改造后才能使用。1989年,布鲁塞尔自由大学的Muyldermans偶然发现骆驼血液中有半数的抗体是天然缺失轻链。4年后,与其导师Hamers教授在Nature发文阐明了该类重链抗体特性[1]。源于骆驼的 SdAb,即纳米抗体 (Nanobody,Nb),相对分子质量小于15 kDa,其内部存在二硫键,表面有大量亲水残基,对热和 pH值有较强的抵抗力。具有常规单域抗体无法比拟的水溶性和构象稳定性[2-4]。这种单体结构域能高特异性、高亲和力地与抗原结合,从而中和或封闭相对隐蔽的抗原表位[2,5-7]。凭借以上特性,Nb较之常规单域抗体受到了更加广泛的关注和认可。随着1994年第一个 Nb的氨基酸序列测定以后,便进入了对Nb结构、特性[3-4,8-15]和生产、应用[16-23]的探索与开发研究阶段 (图 1)。纳米抗体技术的研发必将大大提高人类疾病的诊断水平。在 Nb领域已经有很多优秀综述,从不同方面介绍 Nb的研究应用进展。本文主要从诊断检测角度出发,在介绍Nb领域的最新进展之外,分析该领域技术上存在的问题,并提出积极的解决方案。
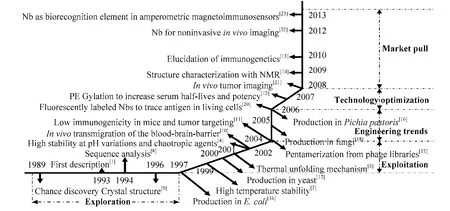
图1 纳米抗体及其在诊断检测领域的发展路线图Fig. 1 Roadmap of Nb advancements and its application in diagnosis and detection.
1 纳米抗体的制备及其分子特征
1.1 纳米抗体的制备
通过免疫学和基因工程等技术,从骆驼体内分离出重链抗体 (Heavy chain antibodies,HCAbs),提取总RNA经反转录获得模板。根据重链抗体保守区域设计引物,经 PCR法扩增获得全套重链抗体可变区基因 (Viriable domain of heavy chain of heavy-chain antibody,VHH),而后将其克隆至载体,体外表达获得含有多种单价Nb的抗体库。应用特异性抗原从Nb库中经过多次淘选即可得到抗原特异的Nb[24-26](图2)。与常规抗体库相比,Nb库的构建更为简单、有效。通常仅用一对简并引物扩增就足以获得骆驼重链抗体的全套VHH基因,经过3−4轮富集筛选后即可分析单个克隆以获得目的抗体。Nb源于天然缺失轻链的重链抗体,天然存在,稳定性和可溶性更强;且具有很强的抗原结合能力,能够识别传统抗体无法识别的隐蔽表位或小表位。
Nb的制备与筛选常用的为噬菌体天然抗体库和抗原倾向性抗体库两类。Nb的亲和力、特异性等分子特征的优劣取决于噬菌体抗体库的库容和多样性两大因素。天然抗体库是从未经免疫的骆驼B淋巴细胞中扩增得到抗体的V区基因,随后重组到噬菌体中形成的抗体库。如此得到的抗体特异性相对较低,而且只有库容足够大(109–1010)时才可能筛选到高亲和力的抗体。抗原倾向性抗体库的库容量比天然库低,但抗体库中能够识别特定抗原的特异性功能抗体较高,易于筛选到高亲和力的目的抗体。比如,A型肉毒杆菌神经毒素 (Botulinum neurotoxin serotype A,BoNT A)免疫美洲鸵5次,每次间隔3周。多次淘选后得到血清型特异的 Nb。液相芯片及表面等离子体共振技术分析Nb的结合动力学,两者的解离常数在 2.2×10–11–1.6×10–10mol/L 之间。如此高的抗原结合能力有助于 A型肉毒素现场快速筛查与检测技术的开发研究[27]。然而,该类库的最大缺陷在于对每一个新抗原都必须重新建库,工作量比较大。纳米抗体库多样性的分子基础源于骆驼重链V区胚系基因片段V、D和J在CDR3结构域随机位点处的组合性重排。对于天然抗体库和抗原倾向性抗体库,重排和位点变异的不可控性以及建库过程中转化效率不高的因素,一般很难得到具有丰富多样性和较大库容(109以上)的纳米抗体库。基于三联核苷酸突变技术 (Trinucleotide mutagenesis,TRIM)的合成或半合成抗体库以及体外翻译为基础的核糖体展示抗体库的出现,克服了常规噬菌体抗体库的库容与多样性的局限。由于不需要转染步骤,因此可获得大容量的文库 (1011–1015)。核糖体展示技术也能通过PCR易错、DNA改组和交错延伸等方法形成大量突变体库,易于达到多样性。与常规噬菌体抗体库所制备的抗体亲和力(10–7–10–8mol/L)相比,核糖体展示系统可以将抗体的亲和力提高至10–12mol/L的水平。
1.2 纳米抗体的分子特征
骆驼源重链抗体的VHH和人源抗体的VH结构非常相似,包含3个高变区和其两侧的4个骨架区。VHH由2个β片层形成支架,3个高变区聚集在一侧参与抗原识别。比较发现骆驼的VHH胚系基因序列和人类VH3家族序列高度同源,不同之处在于VHH的互补决定区1 (Complementaritydetermining region 1,CDR1)和CDR3比人的稍长,而且其 CDR3形成凸形的结构,能更好地结合抗原,这在一定程度上弥补了轻链缺失造成的抗原结合力下降的不足[28],从而提高了其对抗原结合的特异性和亲和力。VHH表面只有 10个氨基酸与人VH不同。另外,在框架区2 (Framework region 2,FR2)位置有4个特异的亲水氨基酸 (位点37、44、45、47)[29]替代了 VH 相应位点疏水的氨基酸(图3)。这些亲水残基能使VHH保持严格的单体结构而不易发生自身聚集。

图3 VHH与VH结构示意图Fig. 3 Structure scheme of VHH and VH.
Nb没有传统抗体的Fc段,从而也避免了补体反应。而且Nb对人体的免疫原性较弱,生物相容性较好,因此可通过基因工程技术进行CDR移植或者表面重塑,即选用与人单域抗体表面残基相似的氨基酸替换使其人源化。Nb表面重塑设计时,要兼顾FR2位置4个特异氨基酸的亲水性以及对抗体分子结构稳定性的功能。位点 37与47处的氨基酸替换会影响抗体分子的稳定性,或者降低对抗原特异性结合的能力;位点 44与45处的氨基酸替换能增加抗体结构稳定性[30]。因此,在减少Nb异源性改造的基础上,要兼顾Nb原有的亲水性、稳定性等抗体活性。
为了进一步改善Nb活性,比如提高亲和力,延长半衰期等,可以通过短小的连接序列 (Linker)将单价 Nb聚合在一起,转换成多价或多特异性的 Nb[31],也能够携带某些特定结构形成融合的Nb[29,32](图4)。多价Nb是识别同一种表位的单价Nb的聚合物,比单价Nb具有更高的抗原亲和力;多特异性 Nb是识别不同表位的单价 Nb的聚合物,能结合不同靶目标或同一靶目标的不同表位,即使单个Nb对其抗原的亲和力不高,但2个或以上 Nb能同时与自己的抗原表位结合 (螯合作用),这就增强了对靶目标的选择力,效果明显好于多价单特异性Nb。值得注意的是在构建多价或多特异性 Nb时,不同长度的连接肽以及所连接的不同表位 Nb的前后方向会直接影响对抗原的特异性结合能力。比如通过9个甘氨酸丝氨酸残基连接的呼吸道合胞体病毒 (Respiratory Syncytial Virus,RSV)双特异性纳米抗体 RSVD3/E4(9GS)微量中和 RSV病毒的能力是RSV-E4/D3(9GS)的 17 倍,IC50为 6 nmol/L[31]。融合的Nb是指通过基因工程技术将Nb与其他结构结合形成的融合分子,如酶、抗菌肽、能延长其半衰期的物质或介入放射学中常用的造影剂等。在新的融合分子中,Nb靶向结合抗原分子,与其融合的部分就能发挥相应的功能。比如将肿瘤坏死因子特异性Nb和半衰期较长的白蛋白特异Nb融合,其血液半衰期明显延长,同时也提高了小鼠关节炎模型中对炎症关节的靶向性[33]。
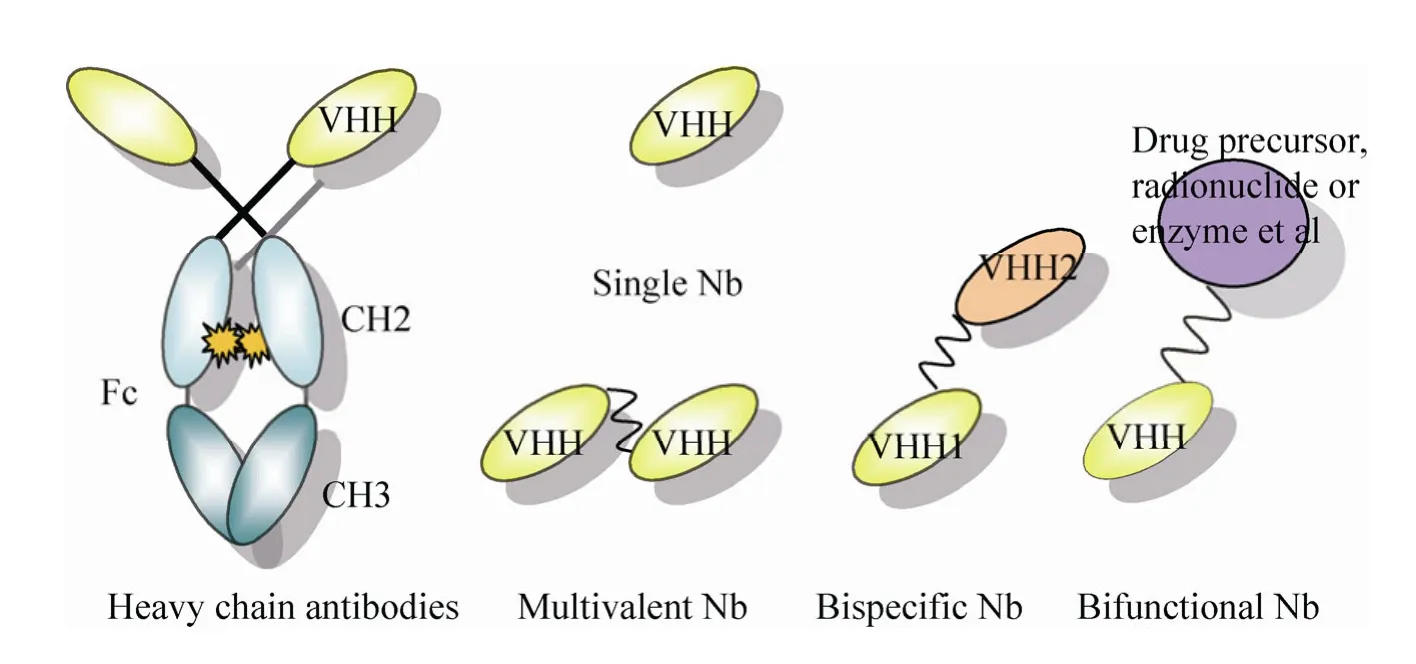
图4 纳米抗体的类型Fig. 4 Types of nanobody.
2 纳米抗体在疾病检测诊断中的应用
2.1 纳米抗体在疾病体外检测中的应用
Nb具有较强的表位识别与结合能力,其构建及表达过程甚至不需要纯化的抗原。Nb娇小的个体 (直径2.5 nm×高度4 nm),使其能够以高密度牢固地结合于固相载体捕捉微量抗原。这些特性是常规单抗甚至单域抗体所不及的。因此,可以充分发挥以Nb为基础的免疫检测方法的作用,检测与鉴别临床上较难检出的靶点以及外来病原物或毒素。
Nb能够以高密度牢固地结合于固相载体,并且具有避开复杂样本中的干扰因素结合更多配体的能力。而且,固态载体上的 Nb很适合捕捉微量抗原。前列腺特异性抗原 (Prostatespecific antigen,PSA)对前腺癌的诊断特异性达90%–97%,被广泛应用于前列腺癌的筛选、诊断及治疗后的监测。健康男性,释放入血中的PSA浓度很低,一般小于 4 ng/mL。PSA特异性的纳米抗体cAbPSA-N7 (15 kDa)固定在以金为基底材料形成的烷基硫醇自组装单层膜上的浓度可达28 fmol/mm2,血清中低于10 ng/mL的PSA均可被直接检测到。此法使用抗体捕获法进行检测,引入亲-链霉素和胶体金颗粒显色的三明治放大系统检测方法后,以 cAbPSA-N7为基础的 PSA的检测灵敏度能够达到 1 ng/mL[34],能够实现前列腺癌的早期检测。另外,Saerens等发现 PSA特异性Nb能区别不同亚型的PSA[35],如此更有助于前列腺癌的分期。中毒性休克综合征毒素-1(Toxic-shock syndrome toxin 1,TSST-1)是由I群金黄色葡萄球菌分泌的胞外致热性超抗原,是致热外毒素 C和肠毒素 F二者的统称。痕量的TSST-1即可导致多种免疫分子过度合成和释放,进而引发病症。以TSST-1特异Nb为基础的免疫检测,可以增强检出灵敏度。猪血中加入4 ng/mL的 TSST-1,经免疫亲合色谱分析,超过 96%的TSST-1可以通过特异Nb免疫吸附去除。这为进一步开发高效的免疫吸附产品,去除败血症动物或人血液中的毒素超抗原,创造了基础条件[36]。
Nb制备不需要纯化的抗原以及其较强的表位识别能力等特性可应用于锥虫病的特异性鉴定。Nb的小分子特性使其能特异性结合到锥虫涎传亚属表面抗原相对保守但却隐蔽的位点,这是常规单抗较大的抗原识别臂无法做到的。Saerens等以伊氏锥虫免疫骆驼制备了特异的纳米抗体,有利于苏拉病的高灵敏度检出[37]。Nb的表位识别能力还可以应用于带绦虫属下各种间的区分和鉴定。带绦虫属下有链状带绦虫、肥胖带绦虫和亚洲带绦虫3个种。三种带绦虫形态上较为相似难以区分,临床上以链状绦虫对人类造成的危害为重。基于单抗的酶联免疫吸附技术尽管可以特异灵敏地检测链状带绦虫,然而却无法与其他种相区分。链状绦虫特异的Nb可以识别链状绦虫特异抗原Ts14,而不与肥胖带绦虫等发生交叉反应[38],这种高特异性的表位识别能力使绦虫病的种间鉴定成为可能,有望发展为种特异性抗原检测的新方法。
胶体金标记技术是继酶免疫标记和放射性免疫标记等之后的又一较为成熟的免疫标记技术。1989–1990年,Spielberg和Beggs等在前人研究的基础上,分别建立了斑点金免疫渗滤和胶体金免疫层析法,并最先应用于检测人血清及尿液中的HCG[39-40]。然而,由于常规单抗较大 (分子量约150 kDa,大小约15 nm),与胶体金颗粒(常规应用大小为 5–50 nm)偶联的效率相对较低。随着具有高亲和力、特异性的抗原结合能力的Nb (分子量小于15 kDa,大小约3 nm)制备技术的兴起,相信免疫胶体金技术将逐渐得到完善和成熟。常规的胶体金标记抗体一般采用静电吸附或化学偶联的方式。其中,化学偶联方式中又以Au-S键或碳二亚胺盐酸盐/羟基琥珀酰亚胺形成酰胺键偶联为主。上述化学偶联方式均需对金颗粒或者蛋白表面进行相应的化学修饰,比如金纳米粒子表面的羧基修饰以及抗体分子表面的半胱氨酸基序修饰等,同时也增加了应用成本。Nb体外基因工程生产制备过程中,可以将与金属颗粒偶联的残基直接引入抗体片段。某种程度上既节约了成本也提高了偶联的效率。比如,Hattori等通过重叠PCR将金颗粒连接多肽(Gold-binding peptide,LKAHLPPSRLPS)重组至Nb基因组中,既实现了Nb与金颗粒的高亲和力特异性结合,又简化了Nb纯化的步骤,同时也节约了Nb的制备和标记成本[41]。
值得注意的是Nb结合固相载体的密度与其活性位点的有效性这一矛盾问题。Nb的小体积决定了其空间位阻也较小,因而可以高密度地结合于固相载体。这虽然有利于检测灵敏度的提高,然而,Nb的这种高密度结合特性也致使其与抗原结合的有效CDRs等活性结构域的数目降低。比如,PSA特异的纳米抗体cAbPSA-N7能够以28 fmol/mm2的高密度结合于固相载体,以其为基础的血清中 PSA的免疫检测阈值也低于10 ng/mL。然而,高密度结合于固相载体上的真正可结合PSA的活性位点只有30%[34]。如果能更好地优化协调Nb结合密度与活性位点之间的关系,相信会有更高灵敏度的检测结果出现。
随着Nb制备技术的日益成熟以及各种标记新技术的不断出现和完善,相信以Nb为基础的酶联免疫和免疫胶体金等体外快速检测技术,从基础研究走向现场或者床边检测 (Point of care testing,POCT)的应用将会很快实现。
2.2 纳米抗体在疾病体内无创伤诊断中的应用
Nb与靶点结合的高亲合力、高特异性和优良的组织穿透能力,使其可以被用作靶向示踪分子进行特异的放射免疫显像或靶向超声造影。因此,以Nb为基础的病灶组织特异的靶向示踪成为分子成像领域重要的研究方向。
放射免疫显像是指将放射性核素通过一定方法标记到抗体上,利用抗体与抗原的免疫结合,特异定位到表达一定抗原的病灶组织上,通过核素发出的射线进行肿瘤特异性显像。Gainkam等通过小鼠皮下接种皮肤鳞癌细胞A431 (表皮生长因子受体表达阳性)建立肿瘤模型,而后静脉注射放射性金属标记的表皮生长因子受体 (Epidermal growth factor receptor,EGFR)特异性纳米抗体99mTc-7C12。注射后 1 h,99mTc-7C12可以借助抗原 (皮肤鳞癌细胞)与纳米抗体 7C12的特异性结合逐渐浓聚在肿瘤内部。通过高分辨的微型计算机断层成像及针孔单光子发射计算机断层成像定量分析表明,相比正常组织对显像剂的吸收值(1.16±0.14)%IA/cm3,99mTc-7C12呈现出较高的肿瘤摄取值(4.55±0.24)%IA/cm3。由于 Nb体积小,99mTc-7C12对肿瘤渗透力强,血中清除速度快,因此可用于癌症的早期辅助诊断[42]。人表皮生长因子受体-2 (Human epidermal growth factor receptor 2,HER2)是迄今为止乳腺癌中研究较为透彻的基因之一,是乳腺癌发生发展、诊断治疗及预后评价的重要靶点。Vaneycken等通过酶联免疫亲和,表面等离子体共振和流式细胞等技术分析显示,HER2特异的纳米抗体 2Rs15d可以作为一种新的免疫成像示踪分子。放射性核素99mTc通过三羰基锝[99mTc(H2O)3(CO)3]+在 50 ℃孵育90 min的方法标记2Rs15d,纯化后的标记复合物静脉注射入乳腺癌模型裸鼠体内,1 h后针孔单光子发射计算机断层影像定量与体内分布分析显示,99mTc-2Rs15d在模型裸鼠肿瘤部位具有较高的特异性的肿瘤摄取值以及快速的血液清除特性,提示2Rs15d可以进一步发展为乳腺癌临床分子成像诊断的靶向示踪分子[43]。以上基础研究显示了以Nb为基础的放射免疫成像在疾病的早期检测诊断中的广阔应用前景。然而,基础研究和临床实际应用还有一定差距。目前,需要改进的是Nb与放射性核素的标记技术,主要涉及到生物学、医学和化学等学科领域。成功的标记主要依赖于放射性核素、标记方法的选择等因素。放射性核素的种类非常多,在选择用于放免显像的核素时,从与Nb的配伍标记角度出发,一般要考虑两个因素:1)核素合理的物理半衰期;Nb定位到病灶组织是一个生物过程,如果使其在靶部位的浓积和在正常组织的背景之比达到最大,需要一定的时间。由于Nb的半衰期较短,一般在十几分钟至几小时不等[42-45]。因此,核素的半衰期不能过短。但是,使用半衰期过长的核素又会给病人带来不必要的辐射。一般认为,半衰期在6–200 h比较合适。2)核素应为无载体形式;Nb的氨基酸构成一般不足 140个,其与核素结合的特定位点有限。因此,只有无载体形式的核素才能得到具有高比活度的标记抗体,这也是获得良好显像的前提。目前,131I、111In和99mTc是研究和应用最多的3个核素。近年来,由于背景清除较快的Nb等小分子抗体的引入以及新的标记方法的采用,99mTc半衰期较短的问题也逐渐被克服,因此,其在核医学研究中的使用也最多。放射性核素标记抗体的方法分为直接和间接法。直接标记法是放射性核素直接与抗体分子形成价键结合而实现标记。这种标记方法步骤简单,易于实现,但能用于直接标记法的核素有限。间接标记法则是通过联接剂将核素标记在抗体之上,使用的双功能联接剂分为多元胺基羧酸类,如乙二胺四乙酸 (Ethylene diamine tetraacetic acid,EDTA)、二乙烯三胺五乙酸(Diethylene triamine pentacetic acid,DTPA)、三乙四胺六乙酸 (Triethylene tetramine hexaacetic acid,TTHA)等;大环类配体,如四氮杂环十四烷四乙酸 (1,4,8,11-Tetraazacyclotetradecane-1,4,8,11-tetraacetic acid,TETA)、三氮杂环壬烷三乙酸(1,4,7-triazacyclononane-1,4,7-triacetic acid,NOTA)、四氮杂环十二烷四乙酸(1,4,7,10-Tetraazacyclododecane-1,4,7,10-tetraacetic acid,DOTA)等;含硫氮配体,如二硫二氮N2S2、四硫二氮N2S4等。在保持Nb免疫括性的前提下,提高标记率和标记物的稳定性至关重要,因为它直接影响着标记物的生物分布和体外显像质量。Xavier等采用68Ga标记纳米抗体2Rs15d,优化标记后的复合物无需纯化即可用于乳腺癌的显像检测[44]。2Rs15d与NOTA耦合后与核素68Ga室温孵育5 min,能够实现纳米抗体2Rs15d的快速有效标记。(68)Ga-NOTA-2Rs15d 的标记率可达97%以上,放射性比活度在55–200 MBq/nmol。
靶向超声造影是指将特异性抗体或配体连接到超声造影剂表面,使其能主动地与病变组织上相应的抗原或受体靶向结合,并通过超声造影技术显示靶灶部位分子水平病理变化,从而产生特异性的分子显像。Hernot等通过亲和素桥连构建了血管内皮细胞粘附分子1 (Vascular cell adhesion molecule-1,VCAM-1)特异性纳米抗体靶向的超声微泡 μB-cAbVCAM1-5。体外动态的流场实验分析显示,纳米抗体 cAbVCAM1-5可以在5 dynes/cm2强力的急流场中结合VCAM-1。体内靶向结合实验将构建好的微泡 μB-cAbVCAM1-5静脉注射MC38肿瘤细胞移植小鼠,10 min后测定肿瘤处的回声强度,结果显示肿瘤处的回声明显增强,与对照组比具有显著性差异[46]。流式细胞分析证实每 μm2微泡表面可以结合 104个纳米抗体,由于纳米微粒造影剂直径更小和其固有的活体内稳定性使得这种造影剂在血循环中具有更长的半衰期[45-46]。Lanza等用靶向纳米造影剂显像猪血管成形术后的颈动脉,发现受到过度牵拉的那段血管平滑肌回声显著增强,而对血管壁内皮信号无明显影响,该结果有力地证实了纳米级造影剂具有穿越血管内皮间隙使血管外靶组织显像的能力[47]。尽管这种新的无创伤性成像技术在肿瘤的早期定性定位诊断领域表现出良好的发展前景,但仍有很多技术需要优化和发展,比如靶向超声造影剂自身的组成修饰以及与 Nb的连接技术,这也是靶向超声造影剂成功构筑的关键。目前,第3代超声造影剂的外膜多为脂质,其厚度更薄 (约 1–3 nm),且更易靶向修饰,能够与Nb偶联制备成靶向超声造影剂,并尽可能最大程度上保持偶联物的生物学活性。将特异性 Nb连接到超声造影剂表面的方式主要包括共价连接和非共价连接,生物素-亲和素偶联法是应用最广泛的非共价连接方法,共价连接则以氨基修饰法和巯基修饰法常见。
靶向超声造影剂能够从分子水平特异识别并结合于病灶,在靶点产生特异性显影,因而能更加显著地提高对早期病变的诊断能力。以单抗修饰为基础的常规微米级造影剂很难通过血管内皮细胞间隙,到达肿瘤细胞表面,因此减小微泡粒径,开发纳米级造影剂有望突破血池内显影的局限性。相比常规单抗,以纳米抗体修饰超声微泡构筑的靶向造影剂,由于其分子量小,血管等组织穿透力强、渗透性好,静脉注入后实际到达靶细胞的浓度高以及不易被肝脏清除等优势,能够产生足够高的信号强度,收到较为理想的显像效果,有望研制出一种穿透力强的小型化靶向声学造影剂。这将有可能克服目前超声靶向显像存在的缺陷,进一步提高其靶向显像效果,从而真正实现肿瘤等恶性疾病的早期靶向声学显像。
3 结语
近几年,以Nb为基础的分子检测和诊断研究正处于推向市场的前期。基于纳米抗体的免疫传感技术,集纳米抗体与生物传感两者诸多优点于一身,不仅可以提高检测的灵敏度和测试精度、减少分析时间,也能使得测定过程变得简单,易于自动化,更能实现个体细胞水平的检测和诊断。对于肿瘤等病变组织细胞的体内靶向无创伤分子成像,信噪比是一个十分关键的指标。因此,构建小型化、穿透力强、易于工程技术制备和改造的分子便成为肿瘤靶向显影最为关键的技术之一。Nb的诸多优点使其在肿瘤靶向显像诊断中具备了广阔的临床应用前景。如何有效地增强靶部位的信号,降低正常组织的本底吸收,提高显像质量是以Nb为基础的靶向分子显像快速走向临床应用的前提。同时,也要考虑到Nb与核素或超声造影剂的连接方式、反应产率、制作成本以及连接物在生理条件下的稳定性等。为保持抗体的免疫学活性,常规单抗与核素或双功能螯合剂的共轭结合可以利用抗体 Fc片段的羧化物作为特异的螯合位点,从而避免对抗体Fab段的活性影响。然而,由于Nb等小分子抗体一般不具有Fc片段,因此,发展一种对Nb活性损伤较小的偶联策略尤为重要。另外,对酪氨酸的修饰有时会减少蛋白质的活性。因此,在选择偶联的位点时,也要考虑到这一问题。在未来的十年或许更短时间内,相信随着对Nb更加深入的研究和临床试验,基于Nb的免疫传感与靶向分子成像技术将会实现对疾病的动态诊断和检测,甚至将疾病的诊断与治疗及预后评价实时联系起来,针对不同患者或同一患者的不同阶段,采取合适的治疗方案,益于早日实现个体化诊疗新模式。
[1]Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains. Nature, 1993, 363(6428): 446–448.
[2]van der Linden RH, Frenken LG, de Geus B, et al.Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies. Biochim Biophys Acta,1999, 1431(1): 37–46.
[3]Perez JM, Renisio JG, Prompers JJ, et al. Thermal unfolding of a llama antibody fragment: a two-state reversible process. Biochemistry, 2001, 40(1):74–83.
[4]Dumoulin M, Conrath K, Van Meirhaeghe A, et al.Single-domain antibody fragments with high conformational stability. Protein Sci, 2002, 11(3):500–515.
[5]Rasmussen SG, Choi HJ, Fung JJ, et al. Structure of a nanobody-stabilized active state of the beta(2)adrenoceptor. Nature, 2011, 469(7329): 175–180.
[6]Muyldermans S. Single domain camel antibodies:current status. J Biotechnol, 2001, 74(4): 277–302.
[7]Muyldermans S, Lauwereys M. Unique single-domain antigen binding fragments derived from naturally occurring camel heavy-chain antibodies. J Mol Recognit, 1999, 12(2): 131–140.
[8]Muyldermans S, Atarhouch T, Saldanha J, et al.Sequence and structure of VH domain from naturally occurring camel heavy chain immunoglobulins lacking light chains. Protein Eng,1994, 7(9): 1129–1135.
[9]Desmyter A, Transue TR, Ghahroudi MA, et al.Crystal structure of a camel single-domain VH antibody fragment in complex with lysozyme. Nat Struct Biol, 1996, 3(9): 803–811.
[10]Muruganandam A, Tanha J, Narang S, et al.Selection of phage-displayed llama single-domain antibodies that transmigrate across human blood-brain barrier endothelium. FASEB J, 2002,16(2): 240–242.
[11]Cortez-Retamozo V, Backman N, Senter D, et al.Efficient cancer therapy with a nanobody-based conjugate. Cancer Res, 2004, 64(8): 2853–2857.
[12]Zhang J, Tanha J, Hirama T, et al. Pentamerization of single-domain antibodies from phage libraries: a novel strategy for the rapid generation of high-avidity antibody reagents. J Mol Biol, 2004,335(1): 49–56.
[13]Harmsen MM, van Solt CB, Fijten H, et al. Passive immunization of guinea pigs with llama single-domain antibody fragments against foot-and-mouth disease. Vet Microbiol, 2007,120(3/4): 193–206.
[14]Vuchelen A, O'Day E, De Genst E, et al. (1)H,(13)C and (15)N assignments of a camelid nanobody directed against human alpha-synuclein.Biomol NMR Assign, 2009, 3(2): 231–233.
[15]Flajnik MF, Kasahara M. Origin and evolution of the adaptive immune system: genetic events and selective pressures. Nat Rev Genet, 2010, 11(1):47–59.
[16]Arbabi Ghahroudi M, Desmyter A, Wyns L, et al.Selection and identification of single domain antibody fragments from camel heavy-chain antibodies. FEBS Lett, 1997, 414(3): 521–526.
[17]Frenken LG, van der Linden RH, Hermans W, et al.Isolation of antigen specific llama VHH antibody fragments and their high level secretion by Saccharomyces cerevisiae. J Biotechnol, 2000,78(1): 11–21.
[18]Joosten V, Roelofs MS, van den Dries N, et al.Production of bifunctional proteins by Aspergillus awamori: llama variable heavy chain antibody fragment (V(HH))R9 coupled to Arthromyces ramosus peroxidase (ARP). J Biotechnol, 2005,120(4): 347–359.
[19]Rahbarizadeh F, Rasaee MJ, Forouzandeh M, et al.Over expression of anti-MUC1 single-domain antibody fragments in the yeast Pichia pastoris.Mol Immunol, 2006, 43(5): 426–435.
[20]Rothbauer U, Zolghadr K, Tillib S, et al. Targeting and tracing antigens in live cells with fluorescent nanobodies. Nat Methods, 2006, 3(11): 887–889.
[21]Huang L, Gainkam LO, Caveliers V, et al. SPECT imaging with 99mTc-labeled EGFR-specific nanobody for in vivo monitoring of EGFR expression. Mol Imaging Biol, 2008, 10(3):167–175.
[22]Broisat A, Hernot S, Toczek J, et al. Nanobodies targeting mouse/human VCAM1 for the nuclear imaging of atherosclerotic lesions. Circulation research, 2012, 110(7): 927–937.
[23]Campuzano S, Salema V, Moreno-Guzman M, et al.Disposable amperometric magnetoimmunosensors using nanobodies as biorecognition element.Determination of fibrinogen in plasma. Biosens Bioelectron, 2013, 52: 255–260.
[24]Hassanzadeh-Ghassabeh G, Saerens D,Muyldermans S. Generation of anti-infectome/anti-proteome nanobodies. Methods Mol Biol,2011, 790: 239–259.
[25]Roovers RC, van Dongen GA, van Bergen en Henegouwen M. Nanobodies in therapeutic applications. Curr Opin Mol Ther, 2007, 9(4):327–335.
[26]Revets H, De Baetselier, Muyldermans S.Nanobodies as novel agents for cancer therapy.Expert Opin Biol Ther, 2005, 5(1): 111–124.
[27]Swain MD, Anderson G, Zabetakis D, et al.Llama-derived single-domain antibodies for the detection of botulinum A neurotoxin. Anal Bioanal Chem, 2010, 398(1): 339–348.
[28]Harmsen MM, De Haard HJ. Properties,production, and applications of camelid single-domain antibody fragments. Appl Microbiol Biotechnol, 2007, 77(1): 13–22.
[29]Muyldermans S, Baral TN, Retamozzo VC, et al.Camelid immunoglobulins and nanobody technology. Vet Immunol Immunopathol, 2009,128(1/3): 178–183.
[30]Vincke C, Loris R, Saerens D, et al. General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold. J Biol Chem, 2009,284(5): 3273–3284.
[31]Hultberg A, Temperton NJ, Rosseels V, et al.Llama-derived single domain antibodies to build multivalent, superpotent and broadened neutralizing anti-viral molecules. PLoS ONE, 2011,6(4): e17665.
[32]Gibbs WW. Nanobodies. Sci Am, 2005, 293(2):78–83.
[33]Coppieters K, Dreier T, Silence K, et al. Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis Rheum, 2006,54(6): 1856–1866.
[34]Huang L, Reekmans G, Saerens D, et al.Prostate-specific antigen immunosensing based on mixed self-assembled monolayers, camel antibodies and colloidal gold enhanced sandwich assays. Biosens Bioelectron, 2005, 21(3): 483–490.
[35]Saerens D, Kinne J, Bosmans E, et al. Single domain antibodies derived from dromedary lymph node and peripheral blood lymphocytes sensing conformational variants of prostate-specific antigen. J Biol Chem, 2004, 279(50):51965–51972.
[36]Adams H, Brummelhuis W, Maassen B, et al.Specific immuno capturing of the staphylococcal superantigen toxic-shock syndrome toxin-1 in plasma. Biotechnol Bioeng, 2009, 104(1): 143–151.
[37]Saerens D, Stijlemans B, Baral TN, et al. Parallel selection of multiple anti-infectome Nanobodies without access to purified antigens. J Immunol Methods, 2008, 329(1/2): 138–150.
[38]Deckers N, Saerens D, Kanobana K, et al.Nanobodies, a promising tool for species-specific diagnosis of Taenia solium cysticercosis. Int J Parasitol, 2009, 39(5): 625–633.
[39]Spielberg F, Kabeya CM, Ryder RW, et al. Field testing and comparative evaluation of rapid,visually read screening assays for antibody to human immunodeficiency virus. Lancet, 1989,1(8638): 580–584.
[40]Beggs M, Novotny M, Sampedro S. A selfperforming chromatographic immunoassay for the qualitative determination of human chorionic gonadotrophin (HCG)in urine and serum. Clin Chem, 1990, 36: 1084–1085.
[41]Hattori T, Umetsu M, Nakanishi T, et al. A high-affinity gold-binding camel antibody:antibody engineering for one-pot functionalization of gold nanoparticles as biointerface molecules.Bioconjug Chem, 2012, 23(9): 1934–1944.
[42]Gainkam LO, Huang L, Caveliers V, et al.Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med, 2008, 49(5): 788–795.
[43]Vaneycken I, Devoogdt N, Van Gassen N, et al.Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J,2011, 25(7): 2433–2446.
[44]Xavier C, Vaneycken I, D'Huyvetter M, et al.Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med, 2013, 54(5): 776–784.
[45]Broisat A, Hernot S, Toczek J, et al. Nanobodies targeting mouse/human VCAM1 for the nuclear imaging of atherosclerotic lesions. Circ Res, 2012,110(7): 927–937.
[46]Hernot S, Unnikrishnan S, Du Z, et al.Nanobody-coupled microbubbles as novel molecular tracer. J Control Release, 2012, 158(2):346–353.
[47]Lanza GM, Abendschein DR, Hall CS, et al.Molecular imaging of stretch-induced tissue factor expression in carotid arteries with intravascular ultrasound. Invest Radiol, 2000, 35(4): 227–234.

