酿酒酵母中与钙离子稳态调控因子ScRCH1细胞质膜定位相关的转录因子基因的筛选检测
杜敬彩,曹春蕾,赵 刚,赵运英,蒋伶活
(江南大学生物工程学院粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
钙离子是生物的一种必需营养因子,可以调控生长、繁殖和程序性细胞死亡,以及心脏的肌肉收缩和口中的味觉[1]。钙稳态(Homeostasis)和钙调磷酸酯酶信号途径在真核细胞中是高度保守的。例如,酵母细胞中钙通道(Channel),钙泵(Pump)和钙交换器(Exchanger)在哺乳动物的心肌细胞中均有对等的同功蛋白,且作用方式基本相似[2]。哺乳动物细胞中酵母CRZ1的同功蛋白是T细胞中激活的核因子(Nuclear factor activated in T cells,NFAT),它被钙调磷酸酯酶激活后,调控细胞分化、心脏发育、受精作用、记忆和肌肉收缩[3]。细胞中钙稳态是被严格调控的,细胞质中钙浓度被保持在一个最佳的浓度。在外界不同钙离子环境下,酿酒酵母细胞质中的钙离子浓度一般维持在50~200 nmol/L[2]。钙稳态的调控是通过质膜和细胞器膜上的钙转运体(Transporter)和钙泵的共同作用来实现的[4]。在酿酒酵母中,细胞外钙离子通常通过未知的转运体“X”和“M”进入细胞质[7]。质膜上的钙通道(由 CCH1、MID1和ECM7)组成,控制钙离子流入细胞质,以应答内质网胁迫和信息素(Pheromone);而哺乳动物细胞TRP通道的同源蛋白—酵母液泡膜蛋白YVC1可以从液泡释放钙离子到细胞质中,以应答低渗休克(Hypotonic shock)[5]。细胞质中钙离子的瞬间升高可以适当地激活钙/钙调磷酸酶信号途径,从而诱导液泡膜上钙泵基因pmc1和内质网/高尔基体膜上钙泵基因pmr1的表达,这对细胞应对外界胁迫是至关重要的。然而,持续的细胞质钙离子积累对细胞来说是有害的。过多的细胞质钙离子通常通过PMC1钙泵和Ca2+/H+交换器VCX1被引入液泡,以及被PMR1钙泵引入内质网/高尔基体中[6]。
最近,我们发现了一个人体溶质转运蛋白SLC10家族成员SLC10A7的白念珠菌同系物CaRCH1[7]。CaRCH1 的功能与白念珠菌对钙离子、锂离子和唑类药物的耐受性有关,负调节胞质内钙离子稳态。酿酒酵母中也存在一个与SLC10A7同源的基因ymr034c,之前的转座子突变筛选研究认为ymr034c与唑类药物的抗性有关[8]。然而,目前为止未见有对ymr034c其他功能的报道。我们发现ymr034c是白念珠菌Carch1的同功基因,它们的氨基酸组成序列有52.7%同源性,因此将其命名为Scrch1。我们的初步研究发现,高钙离子浓度条件下,ScRCH1-GFP定位于细胞质膜上。本研究对酿酒酵母基因组中编码转录相关蛋白的223个基因进行系统筛选,发现6个基因与ScRCH1的表达和细胞质膜定位有关。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究所用到的酿酒酵母菌株有野生型BY4743(MATa/α ura3Δ0/ura3Δ0;his3Δ1/his3Δ1;leu2Δ0/leu2Δ0;lys2Δ0/LYS2;MET15/met15Δ0)和以BY4743为背景的酿酒酵母双倍体单基因缺失株文库(购自美国 Invitrogen公司)。
1.1.2 培养基 ①LB培养基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH 7.0。配置固体培养基时加入1.5%(w/v)的琼脂粉;②YPD培养基:蛋白胨2%,葡萄糖2%,酵母提取物1%。配置固体培养基时加入2%(w/v)的琼脂粉;③SD-Ura培养基:酵母氮源0.67%,葡萄糖2%,灭菌后加入过滤灭菌过的10×必需氨基酸混合母液(不含尿氨酸)。
1.1.3 试剂 基因克隆相关用限制性内切酶和T4连接酶等试剂购自NEB公司;酵母转化用ssDNA、LiAc和 PEG 3350等试剂购自 Sigma公司;Taq DNA聚合酶和Trans1-T1大肠埃希菌感受态细胞购自北京全式金公司;CaCl2等其他试剂购自国药集团。
1.1.4 主要实验仪器 PCR反应仪(德国艾本德公司)、全温摇瓶柜(太仓强乐实验设备厂)、台式冷冻离心机(日本日立公司)、立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)、凝胶成像系统(Bio-Rad)、荧光显微镜(Nikon 80i)、数显恒温水浴锅(金坛市医疗仪器厂)。
1.2 方法
1.2.1 ScRch1-GFP融合蛋白表达质粒的构建首先通过PCR扩增含有785 bp启动子序列和没有终止密码子的Scrch1基因ORF的一段DNA片段,PCR产物的大小为2087 bp,所用引物为Scrch1-F(CGTTCGACCCATATGTGTCC,下划线为BamHⅠ位点)和Scrch1-TAG(ACGC CCTTGGTTGT GTATATGG,下划线为SphⅠ位点)。然后,将这个片段克隆到pGFP33(Michael N.Hall,Switzerland赠送)的BamHⅠ和SphⅠ位点,构建出ScRCH1-GFP融合蛋白的表达质粒pGFP33-ScRCH1。
1.2.2 酵母细胞转化 挑取活化的酵母单菌落接种于3 mL YPD液体培养基中,30℃震荡过夜培养;取1 mL菌液于离心管中,室温下5000 r/min离心 30 s,弃上清;管中细胞用 100 μL OSB buffer(50 μL 1 mol/L LiAc,20 μL 1 mol/L DTT,6.75 μL 10 mg/mL ssDNA)预混液重悬;加入适量质粒 DNA(200 ng ~2 μg),160 μL 50%PEG,并充分混匀;于42℃水浴热激30 min;取出离心管,室温下5000 r/min离心30 s后,去上清,用500 μL灭菌水洗1次菌体,涂布于所需营养选择培养基上,30℃培养箱中培养3~4 d,挑取酵母转化子,在SD-URA固体培养基上划线纯化得到的酵母转化子。
1.2.3 细胞预处理和荧光显微镜观察 挑取带有pGFP33-ScRCH1质粒的酵母单菌落,接种到含有3 mL SD-URA液体培养基的试管中,30℃震荡过夜培养。分别取100 μL过夜培养液,加入到2份含有900 μL新鲜YPD液体培养基中,在30℃继续培养2 h至对数生长期,然后向其中1份培养物加入终浓度为0.2 mol/L CaCl2,继续培养2 h荧光显微镜下观察ScRCH1-GFP融合蛋白的亚细胞定位情况。每个样品随机选取大约有100~200个酵母细胞进行观察,拍摄DIC和荧光照片。每个菌株随机选取2个独立的转化子做荧光定位实验。
1.2.4 酿酒酵母基因组中编码转录因子基因的生物信息学分析 酿酒酵母双倍体单基因缺失株文库包括大约4757个非必需基因的缺失株[9]。SGD数据库(The Saccharomyces Genome Database)检索结果显示,这4757个非必需基因中,共有223个基因编码转录相关的蛋白,包括转录因子、转录辅助因子和转录调节因子等,它们共同调控细胞内不同基因的转录表达(表1)。
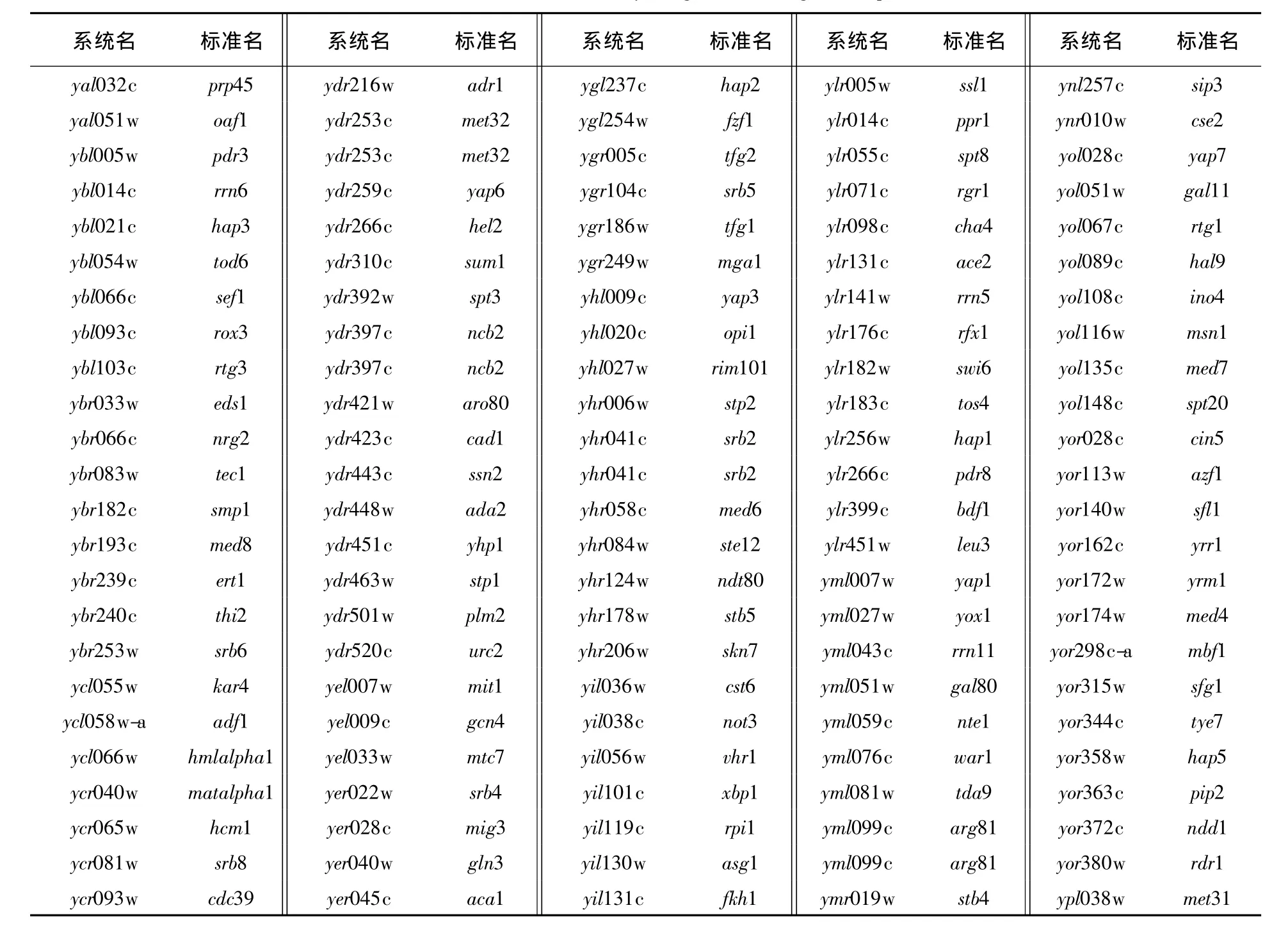
表1 编码酵母细胞转录因子的223个非必需基因Table 1 List of the 223 nonessential yeast genes encoding transcription factors

续表
2 结果与分析
2.1 转录因子基因对ScRch1-GFP亚细胞定位的影响
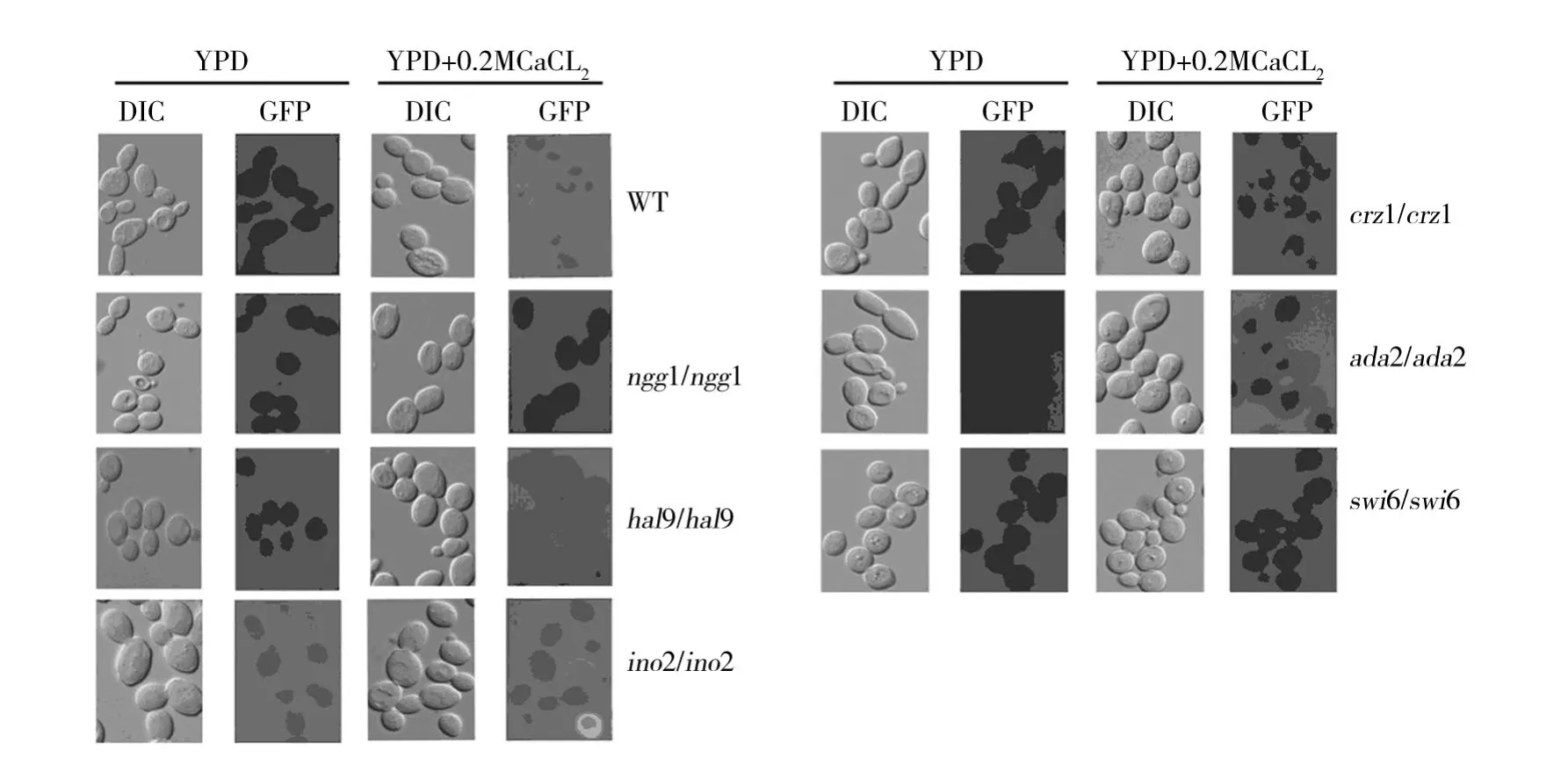
图1 ScRch1-GFP在野生型(WT)菌株和6个双倍体基因缺失菌株中的亚细胞定位(1000×)Fig.1 Subcellular localization of ScRCH1-GFP in the wild type and 6 mutant strains(1000 × )
在经0.2 mol/L CaCl2处理的野生型酵母细胞中ScRCH1-GFP定位于细胞质膜上(图1)。为了研究Scrch1基因表达的调控机理,将ScRCH1-GFP质粒导入到上述223个编码转录因子的双倍体单基因缺失株中。然后,利用荧光定位的方法检测0.2 mol/L CaCl2处理前后 ScRCH1-GFP融合蛋白在细胞中的定位情况。荧光显微镜观察结果表明,在不外加钙离子的YPD培养基中,野生型酵母细胞中没有观察到ScRCH1-GFP定位的信号(图1左边第1排)。同样,在不外加钙离子的YPD培养基中,222个编码转录因子基因的缺失株与野生型菌株一样都没有ScRCH1-GFP的细胞质膜荧光定位(数据未显示)。结果显示,未经钙离子处理时,这223个基因中唯一1个基因ino2的缺失株中,ScRCH1-GFP已经定位到细胞质膜上(图1左边第4排)。
0.2mol/L CaCl2处理2 h后,野生型酵母细胞中ScRCH1-GFP定位到了细胞质膜上(图1左边第1排)。相比之下,这223个基因中有5个基因ngg1、hal9、crz1、ada2和 swi6的单基因缺失株细胞中,没有观察到ScRCH1-GFP的细胞质膜荧光定位(图1左边第2~3排,右边第1~3排),但是ino2的单基因缺失株细胞中,ScRCH1-GFP的仍然定位在细胞质膜上(图1左边第4排)。
3 讨论
上述实验结果表明,编码酿酒酵母细胞转录因子的 ino2、ngg1、ada2、hal9、crz1 和 swi6 六个基因的缺失影响了ScRCH1-GFP的正常细胞质膜荧光定位,它们在细胞中的已知调控功能不同(表2)。ino2是异源二聚体转录激活因子 INO2/INO4螺旋-环-螺旋的组分,通过与肌糖/胆碱-响应元件(ICREs)结合调节磷脂生物合成相关基因的表达[10]。但是,在 Scrch1启动子上没有找到INO2的结合位点ICRE序列,因此,INO2不可能直接调控Scrch1的表达。ScRCH1是一个细胞质膜蛋白,它的细胞质定位也许与磷脂有关,推测INO2调控ScRCH1的胞质定位可能是间接通过调控磷脂生物合成相关基因来完成的。NGG1也被称为ADA3,是3个修饰染色质的组蛋白乙酰转移酶(histone acetyltransferase,HAT)复合物SAGA、SLIK和ADA的组分之一,这3个复合物的催化亚基为GCN5,可以正向和负向调控一系列由RNA聚合酶II转录的基因的表达[11]。NGG1的C-端和ADA2相互作用形成 NGG1-ADA2-GCN5复合物[12]。我们还发现与NGG1存在同一个复合物中的ADA2,它也是3个复合物SAGA、SLIK和ADA的组分之一[11],且发现 ADA2和 NGG1在调控ScRCH1-GFP细胞质膜定位方面的功能一致。由此可见,组蛋白乙酰转移酶复合物可能正向调控Scrch1基因的转录表达,其功能的丧失可能导致Scrch1基因不能被转录,从而细胞内不能合成ScRCH1蛋白,因此也就没有细胞质膜的定位。
HAL9是一个待证实的含有锌指结构的转录因子,它的过表达可以增加Na+/Li+泵基因ena1的表达,从而提高细胞对Na+/Li+的耐受性[13]。推测HAL9对Scrch1基因的调控机理可能类似于它对ena1的调控。SWI6可以与SWI4和MBP1形成复合物在G1/S过渡期间调控转录,SWI6的核定位受细胞壁胁迫诱导的MPK1p磷酸化的调控[14]。SWI6对Scrch1基因的调控机理有待进一步研究。CRZ1是钙离子激活的钙调磷酸酯酶信号途径的转录因子,通过基因启动子上的CDRE序列调控目的基因的表达,维持细胞内钙离子稳态。在Scrch1启动子上发现了一个潜在的与CRZ1结合的CDRE序列,因此,CRZ1可能是直接调控Scrch1的表达。总之,这6个转录因子基因的发现为Scrch1基因的表达调控机理的研究奠定了基础,有助于对酵母细胞内钙离子稳态的调控机理的进一步了解。

表2 与ScRCH1亚细胞膜定位有关的6个转录因子编码基因Table 2 List of 6 transcriptional factor-encoding genes involved in ScRCH1 subcellular localization

续表
[1]Medler KF.Calcium signaling in taste cells:regulation required[J].Chem Senses,2010,35(9):753-765.
[2]Cui J,Kaandorp JA,Sloot PM,et al.Calcium homeostasis and signaling in yeast cells and cardiac myocytes[J].FEMS Yeast Res,2009,9(8):1137-1147.
[3]Wu H,Peisley A,Graef IA,et al.NFAT signaling and the invention of vertebrates[J].Trends Cell Biol,2007,17(6):251-260.
[4]Cui J,Kaandorp JA,Ositelu OO,et al.Simulating calcium influx and free calcium concentrations in yeast[J].Cell Calcium,2009,45(2):123-132.
[5]Denis V,Cyert MS.Internal Ca(2+)release in yeast is triggered by hypertonic shock and mediated by a TRP channel homologue[J].J Cell Biol,2002,156(1):29-34.
[6]Cyert,MS.Calcineurin signaling in Saccharomyces cerevisiae:how yeast go crazy in response to stress[J].Biochem Biophys Res Commun,2003,311(4):1143-1150.
[7]Jiang L,Alber J,Wang J,et al.The Candida albicans plasma membrane protein Rch1p,a member of the vertebrate SLC10 carrier family,is a novel regulator of cytosolic Ca2+homoeostasis[J].Biochemical Journal,2012,444(3):497-502.
[8]Kontoyiannis DP.Genetic analysis of azole resistance by transposon mutagenesis in Saccharomyces cerevisiae[J].Antimicrob Agents Chemother,1999,43(11):2731-2735.
[9]Zhao Y,Du C,Zhao G,et al.Activation of calcineurin is mainly responsible for the calcium sensitivity of gene deletion mutations in the genome of budding yeast[J].Genomics,2013,101(1):49-56.
[10]Gardenour KR,Levy J,Lopes JM.Identification of novel dominant INO2c mutants with an Opi-phenotype[J].Mol Microbiol,2004,52(5):1271-1280.
[11]Pray-Grant MG,Schieltz D,McMahon SJ,et al.The novel SLIK histone acetyltransferase complex functions in the yeast retrograde response pathway[J].Mol Cell Biol,2002,22(24):8774-8786.
[12]Horiuchi J,Silverman N,Marcus GA,et al.ADA3,a putative transcriptional adaptor,consists of two separable domains and interacts with ADA2 and GCN5 in a trimeric complex[J].Mol Cell Biol,1995,15(3):1203-1209.
[13]Byrne KP,Wolfe KH.The Yeast Gene Order Browser:combining curated homology and syntenic context reveals gene fate in polyploid species[J].Genome Res,2005,15(10):1456-1461.
[14]Kim KY,Truman AW,Caesar S,et al.Yeast Mpk1 cell wall integrity mitogen-activated protein kinase regulates nucleocytoplasmic shuttling of the Swi6 transcriptional regulator[J].Mol Biol Cell,2010,21(9):1609-1619.

