菌种类型及EDTA二钠用量对生物甲烷生成的影响
夏大平,司 青,苏现波,胥帅帅,马俊强
(1.河南理工大学,河南焦作 454003;2.瓦斯地质与瓦斯治理国家重点实验室培育基地,河南 焦作 454003)
化石燃料的枯竭让世界陷入能源危机,各国都在寻找一种可再生的清洁能源,其中煤制生物甲烷在美国粉河盆地和圣胡安盆地的成功开发利用使人们认识到生物气对提高煤层含气量及资源量具有重要意义,学者们对生物制甲烷也进行了较多的研究,证明了在适宜的实验室条件下煤可以被微生物降解转化成生物气[1-12]。产甲烷菌株是煤制生物甲烷的核心,产甲烷菌的种类和数量不但是生物制甲烷最基础的研究课题,也为其遗传育种和生理生化的研究提供了重要的微生物资源[12-18]。为了解产甲烷菌在煤发酵产生生物气方面的作用,探讨生物成因煤层气的形成机理及其影响因素,本研究以白腐真菌和矿井水中的厌氧菌群为菌种来源,对本源菌进行富集和鉴定,研究鹤壁煤和矿井水中本源微生物的生长繁殖特性,并采取EDTA二钠处理重金属含量较高的煤,以激活厌氧发酵体系中微生物的代谢活性,证明其作用[19-22]。
1 材料与方法
1.1 材料
1.1.1 产气基质 以山西省华晋焦煤集团沙曲矿的焦煤和河南省鹤壁煤业集团中泰矿的瘦煤为产气基质。于回采工作面采集新鲜煤样,带回实验室后用粉碎机粉碎,筛选出粒度为60~80目的煤粉;然后将煤粉放入高压灭菌锅内121℃下灭菌30 min;最后将煤样转移至无菌的样品袋中,并将样品袋放入70℃的恒温干燥箱中烘干至恒重,备用。
1.1.2 菌种 白腐真菌:由河南理工大学生物技术实验室提供,将菌种接种到PDA固体斜面培养基上,并置于4℃冰箱保存;厌氧发酵菌群:所用的厌氧发酵菌群分别为取自沙曲矿和中泰矿业的矿井水,采用无菌的塑料桶在工作面排水沟中采集新鲜矿井水,待桶内装满后迅速封闭,回到实验室后置于4℃冰箱内保存。
1.1.3 培养基 ①白腐菌富集培养基;②产甲烷菌富集培养基:L11.0 g,S10.4 g,L24.0 g,J 1.0 g,L30.1 g,Y 1.0 g,L40.5 g,矿井水 1000 mL;③反硝化菌分离计数培养基:硝酸钾1.0 g,乙酸钠 1.0 g,磷酸二氢钾 1.0 g,氯化亚铁 0.05 g,氯化钙 0.2 g,硫酸镁 1.0 g,BTB 1.0 mL(1%,用酒精溶解),琼脂20.0 g,超纯水 1 L,pH≈7.3。
1.1.4 实验仪器 高压灭菌锅;多功能智能厌氧系统;电热恒温培养箱;厌氧工作站;X射线衍射仪;气相色谱仪;菌种鉴定所用主要仪器:倒置荧光显微镜,台式高速离心机,此外,还有PCR仪、凝胶电泳仪、凝胶成像系统等;厌氧发酵实验装置(图1):采用三角瓶和乳胶管为材料,利用排水集气法收集发酵产生的气体,并定期观察排出的水量多少。

图1 实验装置示意图Fig.1 Experimental device
1.2 方法
1.2.1 产甲烷菌鉴定 利用种属特异性PCR法快速鉴定矿井水中是否含有产甲烷菌。步骤如下:①产甲烷菌培养:配制产甲烷菌富集培养基,于121℃高压蒸汽锅内灭菌20 min,在厌氧状态下将矿井水接种到培养皿中,每组矿井水接种到3~4个培养皿中作为平行样,并用已灭过菌的涂布棒涂抹均匀。接种完毕后冲入氮气。将厌氧罐放入35℃电热恒温培养箱中10~20 d以扩增产甲烷菌;②矿井水中细菌总DNA提取:用少量的无菌超纯水将培养基上的菌落冲洗至2 mL离心管中,通过分光光度计测量在600 nm波长下菌液的OD值,并用无菌超纯水调节菌液的OD浓度值在1.0×109左右,使菌液浓度符合DNA提取试剂盒的要求;③PCR扩增:使用产甲烷菌16S rDNA特异性引物:Met 83F(5V-ACKGCTCAGTAACAC-3V),Met 1340R(5V-CGGTGTGTGCAAGGAG-3V)扩增目的基因。PCR扩增体系如下:10×Taq 聚合酶反应缓冲液2.5 μL;dNTP(20 mmol/L)2.5 μL;5'端引物(25 pmol/μL)1 μL;3' 端引物(25 pmol/μL)1 μL;Mg2+(2.5 mmol/L)2 μL;DNA 模板 1 μL;Taq DNA 聚合酶(5 U/μL)0.2 μL;dd H2O 14.8 μL;总体积 25 μL。反应条件:94℃预变性3 min;94℃变性30 s,58℃复性30 s,72℃延伸90 s,经30个循环后,最后再72℃延伸10 min。扩增反应在PCR仪中进行。
1.2.2 反硝化菌分离计数 采用稀释平板涂布法对矿井水中的反硝化菌进行计数。将接种好的培养基置于35℃恒温培养箱内,培养3~4 d后,观察培养基上蓝色和具有蓝色晕圈的单菌落,即为反硝化细菌。
1.2.3 以沙曲矿矿井水为菌种源的产甲烷实验以沙曲矿的焦煤为发酵基底,以同矿区的矿井水和实验室保存的白腐菌菌液为菌种来源,分别向培养基中添加不同浓度梯度的EDTA二钠,研究煤样在不同浓度梯度的EDTA二钠下的产甲烷规律。

表1 沙曲矿矿井水为菌种源的产甲烷实验Table 1 The methanogenic experiment by taking Shaqu mine water as strains source
1.2.4 以中泰矿业矿井水为菌种源的产甲烷实验 以沙曲矿的焦煤为发酵基底,以鹤壁中泰矿业的矿井水和实验室保存的白腐菌液为菌种来源,分别向产甲烷菌富集培养基中添加不同浓度梯度的EDTA二钠,研究煤样在不同梯度浓度EDTA二钠下的产甲烷规律。发酵产甲烷实验开始前,预先将煤样进行灭菌,并用产甲烷菌富集培养基富集矿井水中的产甲烷菌6 d,实验所用材料及其配比见表2。

表2 以鹤壁中泰矿业矿井水为菌种源的产甲烷实验Table 2 Methanogenic experiment by taking mine water of China and Thailand mining in Hebi as strains source
1.2.5 分析项目与测试方法 ①产甲烷菌鉴定:为了检验矿井水中是否存在产甲烷菌,将PCR扩增产物与上述样品缓冲液(loading buffer)混合后,在2%的琼脂糖凝胶中电泳,以DNA marker为对照。将电泳后的琼脂糖凝胶放入凝胶成像系统中,观察1200 bp处是否有明亮的DNA条带出现,若有,说明该矿井水中含有产甲烷菌,否则为不含;②产气量测定:采用排水集气法收集发酵产生的气体,通过测量排出水量的大小反映产气量;③气体组分及浓度测定:用气相色谱仪检验发酵产生的气体。TCD检测器,5A柱,硅胶柱,进样器50℃,检测器100℃,热丝150℃,载气为Ar,手动进样,进样量为1 mL;④反硝化菌分离与计数:由于反硝化菌在生长过程中会分泌出碱性物质,故可采用BTB培养基利用稀释平板计数法对反硝化菌进行计数并观察。
2 结果与分析
2.1 沙曲矿矿井水为菌种源的产甲烷结果
于发酵后第40天测试各样品发酵所产生的气体组分及其浓度,具体结果见表3。
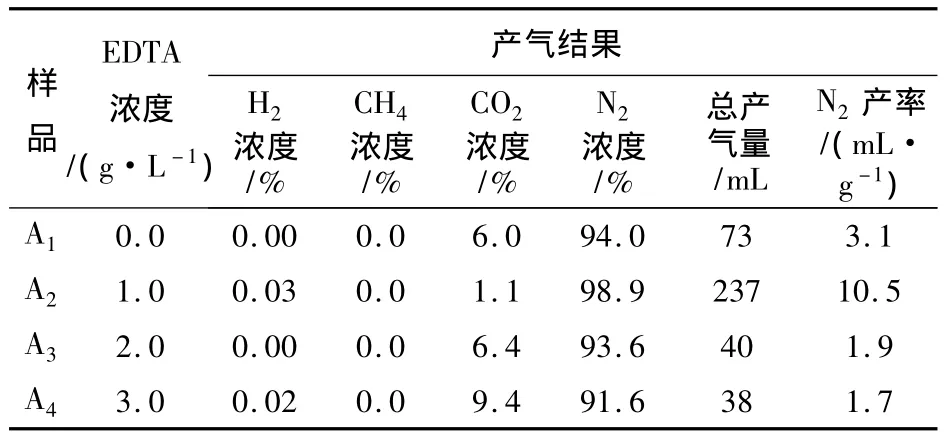
表3 产气结果Table 3 The results of gas production
由表3可知,所有样品均没有产生CH4。分析认为,沙曲矿的矿井水中可能不存在产甲烷菌。采用种属特异性PCR法快速鉴定沙曲矿矿井水中是否含有产甲烷菌,并以中泰矿业的矿井水样品为对照,各样品的DNA凝胶电泳结果见图2。
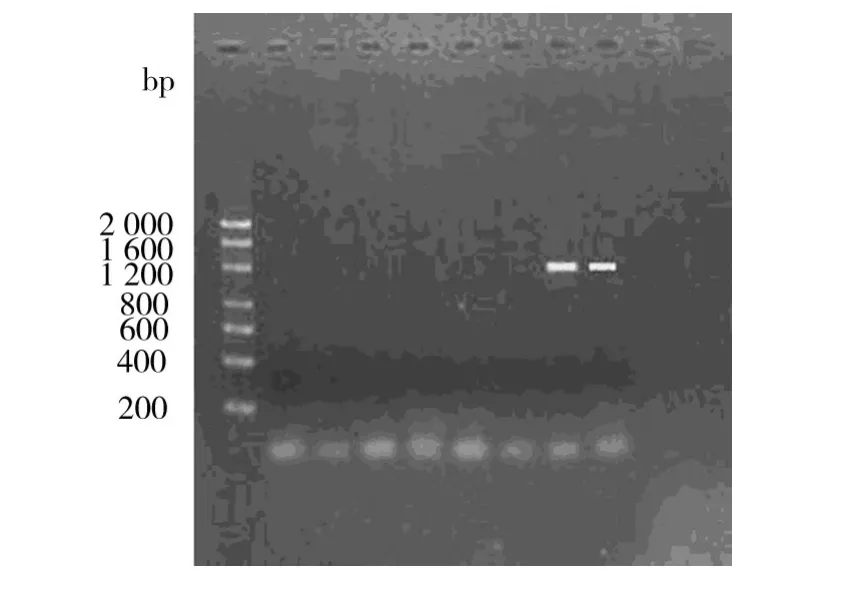
图2 PCR扩增结果Fig.2 The results of PCR amplification
由图2可见,以鹤壁中泰矿业的矿井水为菌种来源时,在对矿井水细菌的DNA提取和PCR扩增后,凝胶电泳图谱中在1200 bp处出现了产甲烷菌特有的DNA片段;而以沙曲矿的矿井水为菌种来源,未见有产甲烷菌应有的条带。上述结果说明中泰矿业的矿井水中有产甲烷菌,而沙曲矿矿井水中不含有产甲烷菌,故在本次产甲烷实验中所有样品均未产出CH4是必然的。
由已知资料可知,沙曲矿矿井水pH为8.47,而中泰矿业矿井水的pH为7.19。因此,分析认为沙曲矿矿井水中不含产甲烷菌的原因主要是沙曲矿的水环境偏碱性,超出了产甲烷菌适宜的生长范围。
同时,由表3可以看出,尽管所有样品中均未有CH4产生,但是都产生了一部分的N2,尤其以A2号样品产出的N2量最大,达到10.5 mL/g。分析认为,这主要是由于矿井水中的反硝化细菌在厌氧发酵过程中进行了反硝化作用,生成了大量N2。采用稀释平板涂布法对沙曲矿矿井水中的反硝化进行计数,得出反硝化菌数目为1.75×103个/mL,各稀释度矿井水中反硝化菌的菌落生长情况见图3。

图3 各稀释度矿井水中反硝化菌的菌落生长情况Fig.3 The growth of denitrifying bacteria colony at different dilution
2.2 中泰矿业矿井水为菌种源的产甲烷结果
于发酵后第40天测试各样品产生的气体组分及浓度,结果见表4。
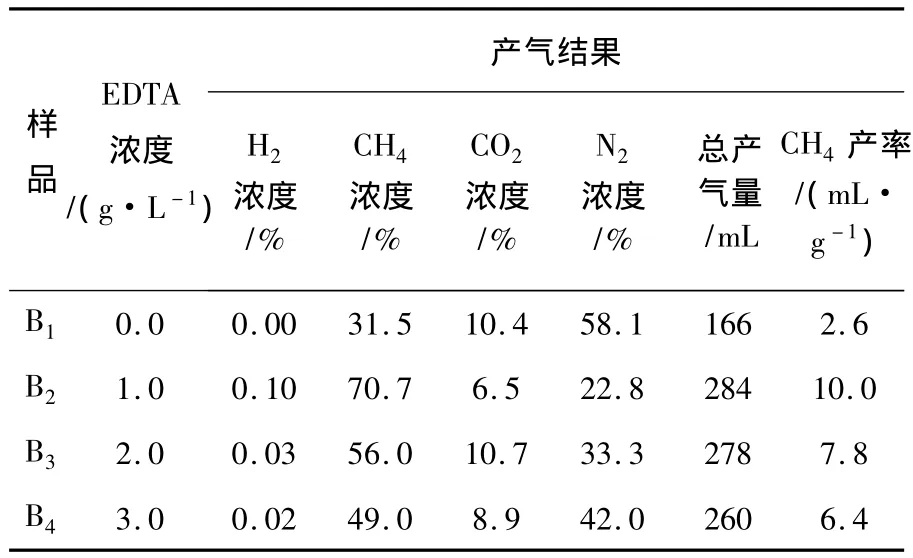
表4 产气结果Table 4 The results of gas production
根据表4绘出,EDTA二钠和CH4产率的关系见图4。
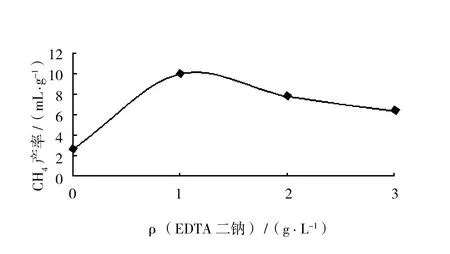
图4 EDTA二钠浓度与CH4产率关系图Fig.4 The relevance between edetate disodium concentration and methane production rate
由图4可见,以中泰矿业的矿井水为菌种源时,所有的样品中均有CH4产出,且CH4产率随着EDTA二钠浓度的增加呈现出先增大后减小的趋势。由表4可见,当EDTA二钠用量为1.0 g/L时,CH4产率达到最大,为10.0 mL/g,是不加ED-TA二钠时的3.8倍。可见,适量的EDTA二钠可以显著增加CH4产率。分析认为,EDTA二钠的作用主要有以下两点:一方面,EDTA二钠可以和溶液中的重金属离子络合成稳定的络合物,阻止重金属离子被厌氧发酵过程中产生的硫化物沉淀,避免产甲烷菌等微生物因溶液中重金属离子浓度不足而代谢活性减慢;另一方面,煤中含有重金属元素,会对产甲烷菌等微生物造成毒性抑制,EDTA二钠可以络合煤中的一部分重金属,从而减轻了重金属的抑制效应。由此可见,EDTA二钠在溶液中具有维持重金属离子平衡的功能,使重金属离子的含量既不致于过低而影响微生物的生长代谢活性,又不致于过高而对微生物产生毒性抑制。此外,由图4可见,当EDTA二钠用量超过1.0 g/L时,CH4产率呈现出降低的趋势,此时EDTA二钠表现出一定地负面效应。这是因为溶液中过量的EDTA二钠会与微生物细胞膜表面上的金属离子结合,导致菌体死亡。
由表4可见,气体组分中仍然有较高含量的N2,这也是反硝化菌的代谢结果。利用稀释平板涂布法对中泰矿业矿井水中的反硝化菌进行分离计数,得出其中反硝化菌数目为8.50×102个/mL,远低于沙曲矿的矿井水中反硝化菌的数目。
2.3 发酵前后发酵液的pH值分析
测试各样品在发酵前后液体的 pH值,见表5。
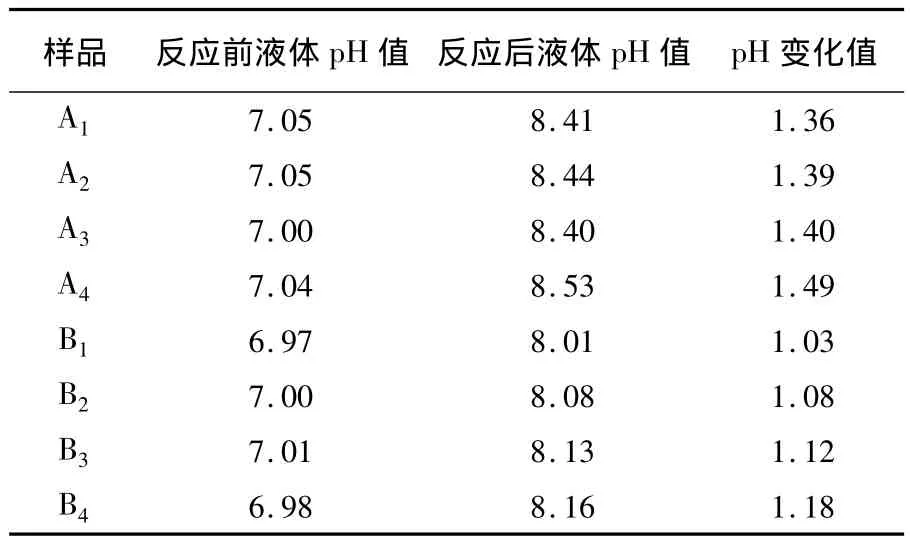
表5 反应液pH变化情况表Table 5 The change of pH value in reactive fluid
由表5可见,所有样品在发酵后其液体的pH值均显著升高。分析认为,主要原因有以下3个方面:①反硝化菌和产甲烷菌等以发酵水解菌降解煤所产生的酸性物质(如甲酸、乙酸、丙酸等)为碳源进行生长代谢,从而降低了溶液被酸化的程度;②产甲烷菌以发酵过程中产生的CO2为碳源,通过CO2还原途径产生CH4,吸收了一部分的CO2;③反硝化菌在进行反硝化的过程中分泌出大量碱性物质,也使得溶液的pH值升高。
3 讨论
分别以沙曲矿及中泰矿业矿井水为主要菌种来源,以沙曲矿的焦煤为发酵基底,从反硝化菌、重金属元素的角度去研究生物甲烷形成的影响因素,得出以下结论:①沙曲矿矿井水中未检测到产甲烷菌,一方面是由于矿井水的pH值较高,不适宜产甲烷菌生长,另一方面是因为矿井水中的反硝化菌含量较多,从多个角度抑制了产甲烷菌的存活;②反硝化菌会在厌氧发酵的过程中进行反硝化作用生成大量N2,使CH4浓度降低,且会消耗酸性代谢产物、分泌碱性物质,使溶液的pH值升高;③EDTA二钠可以维持溶液中重金属离子浓度的平衡,使其含量既不会过低,又不会过高,因而可以显著提高CH4产率,但是当EDTA二钠浓度过高时,又会造成菌体死亡,降低产气率。
[1]毛胜勇,苏勇,杨翠凤,等.仔猪结肠中产甲烷菌群多样性及其与环境因子的相关性[J].微生物学报,2011,51(10):1390-1397.
[2]夏大平,陈鑫,苏现波,等.氧化还原电位对低煤阶煤生物甲烷生成的影响[J].天然气工业,2012,32(11):107-110.
[3]李明宅,张摇辉.煤的厌氧降解产气作用[J].天然气工业,1998,25(4):487-494.
[4]刘洪林,刘春涌,王红岩,等.西北低阶煤中生物成因煤层气的成藏模拟实验[J].新疆地质,2006,4(2):149-152.
[5]王爱宽,秦勇.褐煤本源菌在煤层生物气生成中的微生学特征[J].中国矿业大学学报,2011,40(6):888-893.
[6]王爱宽,秦勇.生物成因煤层气实验研究现状与进展[J].煤田地质与勘探,2010,38(5):23-27.
[7]苏现波,陈鑫,王惠风,等.不同厌氧发酵工艺对煤制氢的影响[J].煤炭转化,2013,36(2):16-19.
[8]苏现波,徐影,吴昱,等.盐度、pH对低煤阶煤层生物甲烷生成的影响[J].煤炭学报,2011,36(8):1302-1306.
[9]Scott A R,Kaise W R,Ayers W B.Thermogenic and secondary biogenci gases,San Juan Basin,Colorado and New Mexico Implications for coalbed gas producibility[J].AAPG Bulletin,1994,78(8):1186-1209.
[10]Faison B D.The chemistry of low rank coal and its relationship to the biochemical mechanisms of coal biotransformation[J].In:Crawford D L,Microbial Transformations of Low RankCoals.CRC(Chemical Rubber Company),1992:1-26.
[11]Hinck M L,Ferguson J,Puhaakka J.Resistance of EDTA and DTPA to aerobic biodegradation[J].Water Science and Technology,1997,35(2-3):25-31.
[12]汪涵,林海,董颖博,等.外源产甲烷菌降解褐煤产气实验[J].石油勘探与开发,2012,39(6):764-768.
[13]马万里,Josquin Tibbits,Mark Adams.一种可用于 PCR 扩增的直接提取土壤细菌DNA的方法[J].土壤通报,2004,35(1):56-58.
[14]张万芹,康冀川,王开功.产甲烷细菌分离纯化特征的研究[J].兴义民族师范学院学报,2010,2:113-116.
[15]周叶锋,廖晓兰.影响甲烷排放量的两种细菌——产甲烷细菌和甲烷氧化菌的研究进展[J].农业环境科学学报,2007,26(增刊):340-346.
[16]庞德公,杨红建.产甲烷菌的分离纯化培养及其培养基对于菌株的选择作用[J].中国畜牧兽医,2010,37(6):32-35.
[17]林海,隋梦琪,汪涵.微生物增产煤层气菌种的驯化[J].煤炭学报,2012,37(8):1359-1363.
[18]郝鲜俊,洪坚平,高文俊.产甲烷菌的研究进展[J].贵州农业科学,2007,35(1):111-113.
[19]李美群,邓洁红,熊兴耀,等.产甲烷菌的研究进展[J].酿酒科技,2009,(5):90-93.
[20]AIder A C,Siegrist H,Gujer W,et al.Behaviour of NTA and EDTA in biological wastewater treatment[J].Water Research,1990,24(6):733-742.
[21]Gerike P,Fischer W K.A correlation study of biodegradability determinations with varous chemicals in vatious tests[J].Ecotoxicology and Environmental Safety,1979,3(2):159-173.
[22]Wilkinson S G..Cell walls of pseudomonas species sensitive to ethylene diaminetetraacetic acid[J].Journal of Bacteriology,1970,104:1035-1044.