枯草芽胞杆菌孢子表面展示外源蛋白的研究
孙腾云,田 瑞,张天喜,陈华友
(江苏大学生命科学研究院,江苏 镇江 212013)
表面展示系统是运用微生物自身功能把外源蛋白或多肽展示在噬菌体或细胞的外表面。固定化后的蛋白或多肽片段相对于游离状态的蛋白或多肽不仅结构更稳定,且具有蛋白纯化更简单、便于回收再利用等优点。Smith GP于1985年最早运用表面展示技术使抗原展示在纤维状噬菌体M13外表面,把抗原蛋白基因与编码蛋白PIII的基因III连接在一起,让其共表达,蛋白PIII由2个结构域通过一段接头区域连接起来而构成,抗原蛋白就表达在接头区域,从而把抗原展示在噬菌体的末端表面[1]。这项技术发展到现在,人们不仅把蛋白或多肽片段展示在噬菌体表面,而且拓展到展示在细菌、酵母、孢子表面[2-4]。若想把外源蛋白或者多肽片段锚定在生命体外表面,首先需要找到合适的载体蛋白,然后把外源蛋白跟载体蛋白连接起来,为了便于外源蛋白折叠以获得正确的构象,在载体蛋白和外源蛋白间常常连接一段接头蛋白[5]。无论是把外源蛋白展示在病毒表面还是菌体或者孢子表面,共同的策略都是把外源蛋白基因与编码菌体表面蛋白或者衣壳蛋白的基因连接起来,构建融合基因,让外源蛋白基因与菌体表面蛋白基因或衣壳蛋白基因共表达。由于枯草芽胞杆菌孢子表面展示技术相对于其他展示系统具有许多优点,因此成为最近十几年的研究热点。
1 枯草芽胞杆菌孢子表面展示的优点
枯草芽胞杆菌是益生菌,已用做食品、动物饲料和水产养殖添加菌[6]。枯草芽胞杆菌目前研究较为详尽,常被用来作为外源基因表达的宿主。王关林等合成了人efg因子,克隆到pUS168上,用重组质粒转化枯草芽胞杆菌突变菌株WYBS2001,得到 hEFG 含量为 7.6 ng/mL[7]。但是枯草芽胞杆菌作为外源蛋白的表达宿主还面临着一系列的问题,如:构建的质粒不太稳定,自身分泌蛋白酶较多等。最近十几年新兴了一种利用枯草芽胞杆菌的孢子展示外源蛋白的技术。2003年Duc L H等最早把抗原多肽片段展示在枯草芽胞杆菌孢子表面[4],相对于把蛋白或多肽片段展示在噬菌体或细菌营养细胞、酵母细胞表面,孢子表面展示具有以下优点:首先,孢子具有独特的抗逆性,可以抵抗高温、强酸、强碱、辐射等不良环境的影响而长时间存活,人们曾经从2500~4000万年前琥珀内的蜜蜂肠道中发现一枚具有萌发为正常营养细胞能力的芽胞[8];其次,当用噬菌体或细菌营养细胞、酵母细胞作为表面展示载体时,外源蛋白必须穿过细胞膜,这就要求外源蛋白表达后必须快速在细胞质内折叠且具有疏水序列,从而顺利通过细胞膜,而很多蛋白并不具有以上特征,但是枯草芽胞杆菌孢子的形成是内生的,展示在孢子表面的外源蛋白并不需要穿过细胞膜;再次,枯草芽胞杆菌孢子表面有数个可以用于表面展示的孢子衣壳蛋白,这就为把多聚体蛋白展示在其表面提供了条件;最后,其胞内有一套完整的需要消耗ATP的分子伴侣体系,在芽胞的形成过程中,不仅可以帮助自身蛋白正确折叠,还可以帮助连接在衣壳蛋白上的外源蛋白正确折叠。
2 枯草芽胞杆菌孢子的结构
枯草芽胞杆菌孢子为近似椭圆球形的颗粒,大致可以分为3层:最内层的核心,中层的皮质和最外层的衣壳。芽胞核心内主要贮存着枯草芽胞杆菌的遗传物质-染色体和质粒,DNA分子并不是独立存在的,而是与一种酸溶性的小分子蛋白(SASPs)紧密结合在一起,这些小分子蛋白占了芽胞总重的20%以上,SASPs可以保护与其紧密结合的DNA免受高温、化学物质和辐射的损害,对DNA具有保护作用。芽胞核心内还储存着正常细胞质内的组件,如RNA、酶、核糖体,只是这些都是处在非活化状态的,只有外界环境刺激芽胞发芽时才会活化[9-10]。核心被内层孢子膜包裹,该膜可以阻止分子进入孢子核心,对核心内的遗传物质具有保护作用。在孢子休眠时核心处于半结晶状态,一旦孢子在适宜的环境下发芽,就会恢复成正常的具有良好流动性的细胞膜[11-12]。
内层孢子膜被厚厚的一层由肽聚糖组成的孢子皮质包裹,其主要作用是保持孢子处于脱水状态[13-15]。皮质又被外层孢子膜包裹。
最外层是芽胞衣壳,它由超过70种芽胞衣壳蛋白经过复杂的相互作用组成,其主要作用是防止外界有害物质进入芽胞内[16]。芽胞衣壳又可分为2层:外层为颜色较深的外层芽胞衣壳,内层为颜色较浅的内层衣壳。2层之间有很多的芽胞衣壳蛋白CotE,负责所有外层衣壳蛋白和部分内层衣壳蛋白的组装。在衣壳和皮质之间分布着芽胞衣壳蛋白SpoIVA,敲除该基因发现芽胞衣壳可以正常合成,但不能与皮质结合,说明其起到连接皮质和衣壳的作用[17]。
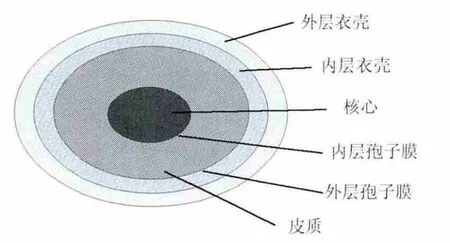
图1 枯草芽胞杆菌孢子结构示意图Fig.1 Structure of the spore showing the different compartments
3 枯草芽胞杆菌孢子表面展示的原理
3.1 以大肠埃希菌—枯草芽胞杆菌穿梭质粒为基础的方法
通过克隆的方法先把载体蛋白基因置于穿梭质粒上,该载体蛋白基因上游含有完整的表达调控序列,再把外源蛋白基因连接在载体蛋白基因的后面,把重组质粒导入枯草芽胞杆菌,然后诱导芽胞的形成,外源蛋白就会随着载体蛋白的表达而共表达,最后随载体蛋白一起展示在孢子的表面[5,18]。
3.2 基因整合的方法
该方法与基因敲除的原理相似。首先,构建一个分别含有枯草芽胞杆菌淀粉酶基因上游部分序列和下游部分序列的大肠埃希菌质粒,两端序列之间还含有红霉素抗性基因。利用克隆的方法,先把含有完整调控序列的载体蛋白基因放在2段淀粉酶基因片段之间的多克隆位点上,再把外源蛋白基因连接在载体蛋白基因后面,用限制性内切酶对环状的质粒进行处理,使之形成链状结构,再把该DNA片段导入枯草芽胞杆菌,该片段上的淀粉酶基因片段就会与基因组上的淀粉酶基因进行同源重组,从而把连有外源蛋白基因的载体蛋白基因整合到基因组上,通过红霉素抗性和淀粉平板筛选阳性转化子。诱导芽胞形成时外源蛋白就会随着载体蛋白的表达而共表达[4,19-20]。
4 枯草芽胞杆菌孢子表面展示所用载体蛋白
已报道的常用作孢子表面展示的载体蛋白有CotB、CotC和CotG。其中对CotB进行大肠埃希菌表达,可以获得46 ku的蛋白,但是在对孢子进行SDS-PAGE分析时发现孢子中的CotB为66 ku,后经过酵母双杂交等技术发现,CotB经过了翻译后修饰,在这个过程中存在与CotG和CotH之间的相互作用[19]。除了以上3种孢子外层衣壳蛋白,最近几年还有一些孢子蛋白陆续地被证明可作为孢子表面展示载体蛋白。李倩等用CotX为分子载体成功地把绿色荧光蛋白(GFP)展示在孢子表面,证明CotX也可以作为孢子表面展示的分子载体。Potot S等以一种内层孢子衣壳蛋白草酸脱羧酶(OxdD)为外源蛋白载体,在芽胞表面展示了具有活性的植酸酶和大肠埃希菌β-葡萄糖醛缩酶,这是迄今为止唯一1例证明孢子内层衣壳蛋白也可作为蛋白载体的报道。Hinc K等[21]以CotZ为外源蛋白载体,成功地把脲酶展示在孢子表面,说明以CotZ为蛋白载体可以把大分子外源蛋白展示在孢子表面[22]。
Hinc K等为了比较CotB、CotC和CotG三种孢子衣壳蛋白展示外源蛋白的能力和方位不同,分别以3种外源蛋白为蛋白载体在孢子表面展示脲酶,当以CotB为载体蛋白时,脲酶展示在孢子的表面,一个孢子上平均有1000个融合蛋白;当以CotC为载体蛋白时,脲酶展示在孢子外层衣壳,一个孢子上平均有7000~15000个融合蛋白;当以CotG为载体蛋白时,结果与CotC为载体蛋白时相似,但是有部分融合蛋白被翻译后加工[23]。
5 枯草芽胞杆菌孢子表面展示系统的主要应用
5.1 作为抗原载体应用于制作口服疫苗
Duc,L.H等最先以CotB为载体蛋白把破伤风毒素碳末端(TTFC)的459个氨基酸片段展示在枯草芽胞杆菌孢子表面[4]。以CotB-TTFC重组芽胞喂食小鼠或鼻腔注射后,可在小鼠血清内检验到抗TTFC IgG。Uyen NQ等[24]又分别用正在发芽的芽胞和已经把TTFC展示在孢子表面的芽胞喂食小鼠,发现后者血清内的抗体明显高于前者,说明展示在孢子表面的抗原效果更好。李倩等以CotX蛋白载体分别把对虾白斑病毒VP28和VP19展示在孢子表面,对虾口服重组芽胞后也可以产生免疫反应,说明以该系统制得的疫苗对节肢动物门的动物也有效。
5.2 作为对酶进行固定化的载体
最近几年有许多把酶展示在孢子表面,从而对酶进行固定化的报道。对于一些化工酶,如何在催化反应后进行回收再利用成为一个难题,而把酶固定在孢子表面后,不仅可以增加酶的稳定性,还可以通过离心回收孢子而对酶进行回收再利用。CotG常被作为蛋白载体把有活性的酶展示在孢子表面。徐晓曼等把N-乙酰-D-神经酰胺醛缩酶融合表达在孢子蛋白CotG的碳端,为了便于N-乙酰-D-神经酰胺醛缩酶自由折叠而形成正确的构象,两段蛋白之间加上一段由2段蛋白间加上一段由5个甘氨酸和1个丝氨酸组成的接头蛋白。经过催化条件优化后,用重组孢子催化N-乙酰-D-神经酰胺,16 h 后,可以把0.2 mol/L N-乙酰-D-神经酰胺转化为0.16 mol/L N-乙酰-D-神经酸。通过离心把重组孢子和反应物分离,对孢子五次循环利用对孢子5次循环利用,发现其酶活损失很小[5]。Kwon S J等以CotG为蛋白载体把具有活性的大肠埃希菌β-半乳糖苷酶展示在孢子表面,大肠埃希菌β-半乳糖苷酶为大分子量的酶,每个亚基的分子量为116 ku,而且只有在四聚体的时候才具有活性。从而证明该孢子表面展示系统也适用于多亚基的大分子量酶[25]。Wang N等[26]证明CotC也可以用来展示具有活性的酶,家蚕乙醇脱氢酶连接在CotC碳端,获得展示在孢子上的融合蛋白 CotC-BmADH,且具有很高的活性。
5.3 制作口服或者靶向药物
Feng F[27]把人胰岛素原融合表达在孢子蛋白CotC的碳端,2段蛋白间引入一段肠激酶位点(Asp-Asp-Asp-Asp-Lys),以重组孢子喂食家蚕,孢子上的人胰岛素原在家蚕肠道内肠激酶的作用下释放,在家蚕血淋巴内可以检测到大量的人胰岛素原。该实验为口服糖尿病药物提供了一种方案,有待进一步的临床实验检验。Mao L等[28]以CotC把人血清白蛋白展示在孢子表面,以重组芽胞喂食小鼠,持续30 d后分析小鼠血液,发现其中血清白蛋白的量明显增高,该实验应用于临床为人体补充血清白蛋白提供了一个新的策略。Nguyen V A T等[29]把链霉亲和素与CotB一起融合表达,构建融合孢子SA1,链霉亲和素可以与生物酰化的西妥昔单抗、紫杉醇结合而使其一起连接在孢子表面,西妥昔单抗可以识别结肠癌细胞HT29上的表皮生长因子受体,从而把一起结合的紫杉醇也带向结肠癌细胞,紫杉醇可以抑制癌细胞的分裂和增值。通过在芽胞表面展示适当的生物酰化的抗体作为识别癌细胞的特异生物标签,重组芽胞可以普遍作为抗癌药物的靶向运输载体。
5.4 为解决重金属污染提供新思路
Hinc K等[30]在CotB的后边连上由18个组氨酸残基组成的多肽,获得重组孢子,利用组氨酸残基可以与镍离子特异结合的特点对污染环境的镍进行吸收。重组芽胞相对野生芽胞结合镍离子能力强,且该结合不易受温度和pH的影响,通过简单的清洗方法即可将与重组孢子结合的镍离子洗脱下来。

表1 枯草芽胞杆菌孢子表面展示外源蛋白研究进展Table 1 Research progress on surface display heterologous proteins on Bacillus subtilis spores
6 讨论
枯草芽胞杆菌孢子表面展示技术获得越来越多应用的同时,还有很多新的应用等待人们去开发,许多问题等待解决。可用于表面展示的孢子衣壳蛋白很少,新的载体蛋白还有待去寻找;展示在孢子上的酶活性普遍较低,如何提高酶的活性成为研究的重点。迄今为止,尚无关于成功展示多酶复合体的报道,有待后续研究者继续努力。
针对孢子表面展示系统存在的问题,本课题组进行了一系列探索。为提高展示在孢子表面酶的活性,进行了如下探究:①调整外源蛋白和载体蛋白之间连接的接头蛋白的长度,找到最易于外源蛋白结合的接头蛋白;②在孢子表面展示多酶复合体。多酶复合体是多种酶靠非共价键相互嵌合形成的一个大分子结构。化学反应需要这些酶之间通过协同作用完成,反应体系中前一反应的产物为后一反应的底物,反应依次进行,最终把底物转化为产物,单是一种酶无法完成催化反应。把组成多酶复合体的酶一起展示在孢子表面,从而形成具有类似多酶复合体的结构,为解决多酶复合体的表达提供了一种新的思路。实验策略是把一个酶的基因序列与CotC连接起来,然后整合在枯草芽胞杆菌基因组上;把另外一个酶的基因序列与CotG连接起来,通过穿梭质粒导入枯草芽胞杆菌,诱导孢子形成,2种酶同时都被展示在孢子表面;③在孢子表面展示与枯草芽胞杆菌亲缘关系较近的来源的酶,如来源于革兰阳性菌的酶。
[1]Smith G P.Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J].Science,1985,228(4705):1315-1317.
[2]Pratt D,Tzagoloff H,Beaudoin J.Conditional lethal mutants of the small filamentous coliphage M13:II.Two genes for coat proteins[J].Virology,1969,39(1):42-53.
[3]Grant R A,Lin T C,Konigsberg W,et al.Structure of the filamentous bacteriophage fl.Location of the A,C,and D minor coat proteins[J].Journal of Biological Chemistry,1981,256(1):539-546.
[4]Duc L H,Hong H A,Fairweather N,et al.Bacterial spores as vaccine vehicles[J].Infection and immunity,2003,71(5):2810-2818.
[5]Xu X,Gao C,Zhang X,et al.Production of N-acetyl-dneuraminic acid by use of an efficient spore surface display system[J].Applied and environmental microbiology,2011,77(10):3197-3201.
[6]陈天游,董思国,田万红,等.枯草芽胞杆菌活菌体外拮抗6种肠道致病菌的研究[J].微生物学杂志,2004,24(5):74-76.
[7]王关林,易庆,方宏筠.人 egf基因在突变枯草芽胞杆菌WYBS2001中的转化、分泌表达及其产物功能研究[J].遗传学报,2003,30(2):97-102.
[8]Cano R J,Borucki M K.Revival and identification of Bacterial spores in 25-to 40-million-year-old Dominican amber[J].Science,1995,268(5213):1060-1064.
[9]Setlow P,Waites W M.Identification of several unique,lowmolecular-weight basic proteins in dormant spores of Clostridium bifermentans and their degradation during spore germination[J].Journal of Bacteriology,1976,127(2):1015.
[10]Setlow P.Spores of Bacillus subtilis:their resistance to and killing by radiation,heat and chemicals[J].Journal of applied microbiology,2006,101(3):514-525.
[11]Stewart G,Eaton M W,Johnstone K,et al.An investigation of membrane fluidity changes during sporulation and germination of Bacillus megaterium KM measured by electron spin and nuclear magnetic resonance spectroscopy[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,1980,600(2):270-290.
[12]Cortezzo D E,Setlow P.Analysis of factors that influence the sensitivity of spores of Bacillus subtilis to DNA damaging chemicals[J].Journal of applied microbiology,2005,98(3):606-617.
[13]Driks A.Bacillus subtilis spore coat[J].Microbiology and Molecular Biology Reviews,1999,63(1):1-20.
[14]Henriques A O,Moran C P.Structure and assembly of the bacterial endospore coat[J].Methods,2000,20(1):95-110.
[15]Piggot P J,Coote J G.Genetic aspects of bacterial endospore formation[J].Bacteriological Reviews,1976,40(4):908.
[16]Aronson A I,Fitz-James P.Structure and morphogenesis of the bacterial spore coat[J].Bacteriological Reviews,1976,40(2):360.
[17]Driks A,Roels S,Beall B,et al.Subcellular localization of proteins involved in the assembly of the spore coat of Bacillus subtilis[J].Genes & development,1994,8(2):234-244.
[18]Kim J H,Lee C S,Kim B G.Spore-displayed streptavidin:a live diagnostic tool in biotechnology[J].Biochemical and biophysical research communications,2005,331(1):210-214.
[19]Zilhao R,Serrano M,Isticato R,et al.Interactions among CotB,CotG,and CotH during assembly of the Bacillus subtilis spore coat[J].Journal of bacteriology,2004,186(4):1110-1119.
[20]Potot S,Serra C R,Henriques A O,et al.Display of recombinant proteins on Bacillus subtilis spores,using a coat-associated enzyme as the carrier[J].Applied and environmental microbiology,2010,76(17):5926-5933.
[21]Hinc K,Iwanicki A,Obuchowski M.New stable anchor protein and peptide linker suitable for successful spore surface display in B.subtilis[J].Microbial cell factories,2013,12(1):22.
[22]李倩,宁德刚,吴春笃.以CotX为分子载体在枯草芽胞杆菌芽胞表面展示绿色荧光蛋白[J].生物工程学报,2010,26(2):264-269.
[23]Hinc K,Isticato R,Dembek M,et al.Expression and display of UreA of Helicobacter acinonychis on the surface of Bacillus subtilis spores[J].Microb Cell Fact,2010,9:2.
[24]Uyen N Q,Hong H A,Cutting S M.Enhanced immunisation and expression strategies using bacterial spores as heat-stable vaccine delivery vehicles[J].Vaccine,2007,25(2):356-365.
[25]Kwon S J,Jung H C,Pan J G.Transgalactosylation in a watersolvent biphasic reaction system with β-galactosidase displayed on the surfaces of Bacillus subtilis spores[J].Applied and environmental microbiology,2007,73(7):2251-2256.
[26]Wang N,Chang C,Yao Q,et al.Display of Bombyx mori alcohol dehydrogenases on the Bacillus subtilis spore surface to enhance enzymatic activity under adverse conditions[J].PloS one,2011,6(6):e21454.
[27]Feng F,Hu P,Chen L,et al.Display of Human Proinsulin on the Bacillus subtilis Spore Surface for Oral Administration[J].Current microbiology,2013:1-8.
[28]Mao L,Jiang S,Li G,et al.Surface display of human serum albumin on Bacillus subtilis spores for oral administration[J].Current microbiology,2012,64(6):545-551.
[29]Nguyen V A T,Huynh H A,Hoang T V,et al.Killed Bacillus subtilis spores expressing streptavidin:a novel carrier of drugs to target cancer cells[J]Journal of drug targeting,2013(0):1-14.
[30]Hinc K,Ghandili S,Karbalaee G,et al.Efficient binding of nickel ions to recombinant Bacillus subtilis spores[J].Research in microbiology,2010,161(9):757-764.
[31]Hwang B Y,Kim B G,Kim J H.Bacterial surface display of a co-factor containing enzyme,ω-transaminase from Vibrio fluvialis using the Bacillus subtilis spore display system[J].Bioscience,biotechnology,and biochemistry,2011,75(9):1862-1865.
[32]Mauriello E M F,Duc L H,Isticato R,et al.Display of heterologous antigens on the Bacillus subtilis spore coat using CotC as a fusion partner[J].Vaccine,2004,22(9):1177-1187.
[33]李倩.以CotX为分子载体表面展示WSSV囊膜蛋白Vp19和Vp28的枯草芽胞杆菌重组芽胞的研究[D].镇江:江苏大学,2010.

