季鏻盐支载手性咪唑啉酮不对称催化1,3-偶极环加成反应研究
聂鑫,林子涵,卢翠芬,杨桂春,陈祖兴
(湖北大学化学化工学院,湖北 武汉430062)
0 引言
手性咪唑啉酮是一类重要的有机小分子催化剂,自Mac-Millan[1]报道以来,被广泛地应用于Diels-Alder环加成反应[2],1,3-偶极环加成反应[3],傅克烷基化反应[4],吲哚烷基化反应[5]以及环氧化反应[6]等不对称催化反应中,具有良好的不对称催化效果.
为了方便催化剂的分离纯化和回收使用,将手性咪唑啉酮支载到不溶性的交联聚苯乙烯[7-8]和有机硅载体[9]及可溶性载体聚乙二醇[10]上,取得了较好的催化效果.芳基季鏻盐在CH2Cl2,CH3NO2,CH3CN,DMF等溶剂中,均具有很好的溶解性,是一类较好的可溶性载体,而在Et2O,MTE等溶剂中不溶,依据此特性能实现快速沉淀析出.与传统的可溶性聚合物载体相比,其分子量较小,具有较高的支载容量,方便分离回收和在线分析[11-12].
基于手性咪唑啉酮的催化活性和季鏻盐可溶性,得到季鏻盐支载咪唑啉酮可溶性的手性催化剂C(图1),催化不对称Diels-Alder反应,取得较好的催化效果[13],本文中进一步探讨该催化剂在1,3-偶极环加成反应中的不对称催化效果(图2).

图1 手性催化剂C的化学结构
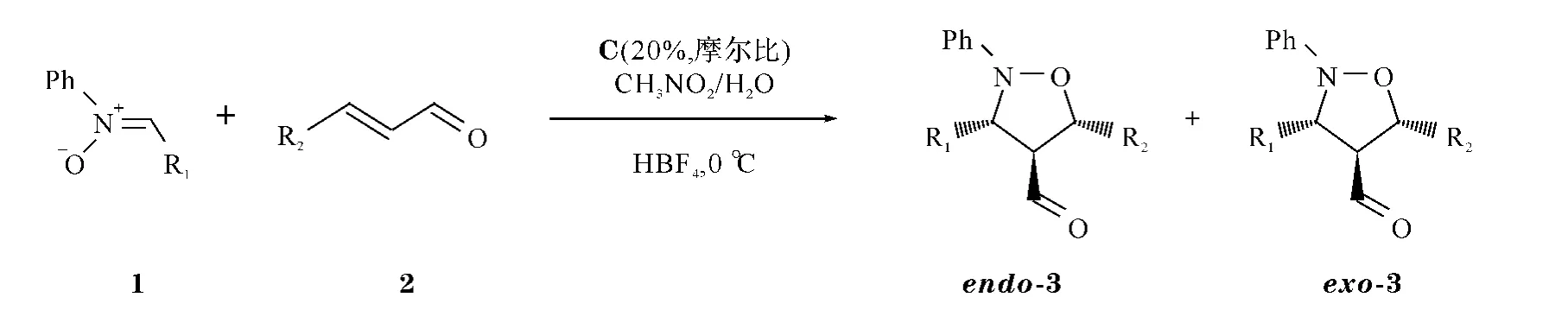
图2 催化剂C在1,3-偶极环加成反应中的催化过程
1 实验部分
1.1 仪器及试剂处理
1.1.1 仪器 熔点仪:WRS-IA数字熔点仪,上海精密科学仪器有限公司,温度未经校正;红外光谱仪:PE-Spectrum One型红外光谱仪,NaCl单晶片涂片;核磁共振仪:WIPM 400 MHz(中科开物公司),Varian Unity INOVA 600 MHz,CDCl3为溶剂,TMS为内标;高效液相色谱仪HPLC:UltiMate3000;检测柱:Chiralcel OD-H,Daicel,柱温,30℃,流动相V正己烷∶V异丙醇=95∶5,流速为0.8 min/m L,检测波长为220 nm;TLC紫外灯检测仪:河南予华仪器有限公司,254 nm和365 nm紫外光照射.
1.1.2 试剂处理 二氯甲烷:AR,五氧化二磷回流处理;乙二醇:AR,减压蒸馏;苯甲醛:AR,Na HCO3饱和溶液清洗,减压蒸馏;反式丁烯醛,甲胺水溶液,对甲苯磺酸,对溴苄醇,偶氮二甲酸二乙酯等试剂均为AR,未经处理直接使用.
1.2 实验步骤 4,2,2-季鏻盐支载手性咪唑啉酮不对称催化1,3-偶极环加成合成异恶唑烷衍生物3:向50 m L圆底烧瓶中加入催化剂 C(73 mg,0.1 mmol),硝基甲烷(5 m L),水(4μL),三氟甲磺酸(8 μL),搅拌15 min,0℃条件下加入醛(3 mmol),硝酮1(0.5 mmol)避光反应24 h.TLC监测反应,待反应结束后,浓缩溶剂,加入适量冰乙醚重结晶,过滤干燥回收催化剂,滤液经柱层析分离(乙酸乙酯/石油醚=1/50,体积比)得淡黄色油状液体3.将产物3和硼氢化钠加入乙醇中室温搅拌2 h,用高效液相色谱HPLC测定ee值.
1.2.1 5-甲基-2,3-二苯基噁唑烷-4-甲醛3a 淡黄色油状液体,产率:78%;1H NMR(400 MHz,CDCl3),δ:9.70(d,J=8.4 Hz,1 H,CHO),7.48~6.86(m,10 H,Ar H),5.08~5.07(d,J=8.0 Hz,1H,CH),4.50~4.46(m,1H,CH),3.23~3.19(m,1H,CH),1.52~1.50(d,J=4.0 Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:196.8,150.1,140.1,128.0,127.9,126.7,125.8,120.9,113.2,74.3,71.8,68.8,16.9.ee值测定:保留时间为endo构型,28.6 min(次要),24.4 min(主要);exo构型16.6 min(次要),14.1 min(主要).
1.2.2 5-甲基-2-苯基-3-对氯苯基噁唑烷-4-甲醛3b 淡黄色油状液体,产率:82%;1H NMR(400 MHz,CDCl3),δ:9.69(d,J=8.4 Hz,1H,CHO),7.46~6.97(m,9H,Ar H),5.10~5.08(d,J=8.0 Hz,1H,CH),4.54~4.47(m,1H,CH),3.17~3.10(m,1H,CH),1.54~1.53(d,J=4.0 Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:196.5,151.1,140.2,128.3,127.4,126.5,125.6,120.8,113.1,74.5,71.2,69.2,17.2.ee值测定:保留时间为endo构型,27.6 min(主要),23.4 min(次要);exo构型16.8 min(主要),14.2 min(次要).
1.2.3 5-甲基-2-苯基-3-对溴苯基噁唑烷-4-甲醛3c 淡黄色油状液体,产率:72%;1H NMR(400 MHz,CDCl3),δ:9.65(d,J=8.4 Hz,1 H,CHO),7.48~6.99(m,9 H,Ar H),5.11~5.09(d,J=8.0 Hz,1 H,CH),4.56~4.49(m,1 H,CH),3.18~3.12(m,1H,CH),1.58~1.56(d,J=4.0 Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:196.2,151.0,140.1,128.1,127.3,126.5,125.4,120.8,113.0,74.4,71.0,69.1,17.1.ee值测定:保留时间为endo构型,27.9 min(主要),22.4 min(次要);exo构型,16.8 min(主要),14.3 min(次要).
1.2.4 5-甲基-2-苯基-3-对甲氧基苯基噁唑烷-4-甲醛3d 淡黄色油状液体,产率:68%;1H NMR(400 MHz,CDCl3),δ:9.65(d,J=8.4Hz,1H,CHO),7.48~6.99(m,9H,Ar H),5.00~4.99(d,J=8.0 Hz,1 H,CH),4.47~4.45(m,1 H,CH),3.79~3.78(s,3 H,OCH3),3.20~3.19(m,1 H,CH),1.51~1.50(d,J=4.0Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:197.2,151.0,140.1,128.1,127.3,126.5,125.8,120.8,113.0,74.4,73.5,69.1,17.1,16.5.ee值测定:保留时间为endo构型29.6 min(主要)和26.4 min(次要);exo构型18.6 min(主要)和15.1 min(次要).
1.2.5 5-甲基-2-苯基-3-萘基噁唑烷-4-甲醛3e 淡黄色油状液体,产率:62%;1H NMR(400 MHz,CDCl3),δ:9.65(d,J=8.4 Hz,1 H,CHO),7.48~6.99(m,12 H,Ar H),5.11~5.09(d,J=8.0 Hz,1H,CH),4.56~4.49(m,1H,CH),3.18~3.12(m,1H,CH),1.58~1.56(d,J=4.0 Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:196.2,151.0,145.2,140.1,136.9,132.4,128.1,127.3,126.5,123.5,121.4,120.8,118.4,116.3,113.0,74.4,73.5,69.1,16.8.ee值测定:保留时间为endo构型24.6 min(主要)和20.4 min(次要);exo构型14.6 min(主要)和12.9 min(次要).
1.2.6 2,3-二苯基噁唑烷-4-甲醛3f 淡黄色油状液体,产率:67%;1H NMR(400 MHz,CDCl3),δ:9.71(d,J=8.4 Hz,1 H,CHO),7.54~7.00(m,10 H,Ar H),4.98~4.97(d,J=8.0 Hz,1H,CH),4.43~4.42(m,2 H,CH2),3.54~3.53(m,1 H,CH);13C NMR(150 MHz,CDCl3),δ:196.8,151.0,140.3,128.1,127.3,126.5,125.3,120.8,113.0,74.4,73.5,69.1.ee值测定:保留时间为endo构型26.2 min(主要)和24.8 min(次要);exo构型16.5 min(主要)和13.7 min(次要).
1.2.7 5-正丁基-2,3-二苯基噁唑烷-4-甲醛3g 淡黄色油状液体,产率:69%;1H NMR(400 MHz,CDCl3),δ:9.73(d,J=8.4 Hz,1 H,CHO),7.52~7.05(m,10H,Ar H),5.13~5.08(d,J=8.0 Hz,1H,CH),4.45~4.43(m,1H,CH),3.32~3.30(m,1H,CH),1.91~1.09(m,2H,CH2),1.76~1.69(m,2 H,CH2),0.95~0.98(t,J=4.0 Hz,3H,CH3);13C NMR(150 MHz,CDCl3),δ:196.4,151.1,140.3,128.1,127.3,126.5,125.6,120.8,113.0,74.4,73.5,71.0,25.8,16.5,13.5.ee值测定:保留 时间为endo构型27.6 min(次要)和22.4 min(主要);exo构型19.6 min(次要)和15.5 min(主要).
2 结果与讨论
2.1 反应条件探讨 以1a与反式丁烯醛的1,3-偶极环加成反应为模版反应(如图3),探讨季鏻盐支载手性咪唑啉酮A在不同溶剂、不同酸以及不同温度条件下的不对称催化反应活性(表1).
由表1中序号1~5可知,在不同溶剂条件下,以季鏻盐支载咪唑啉酮催化剂C催化硝酮1a与反式丁烯醛的1,3-偶极环加成反应,其中硝基甲烷具有较高的产率和立体选择性(产率:78%,endo/exo=85/15,ee(endo)=78%);以硝基甲烷为溶剂,探讨不同的酸性添加物对催化反应的影响,比较序号5~9可知,当酸为三氟甲磺酸时,产率最高,立体选择性也最好,三氟乙酸的催化效果次之;最后以硝基甲烷为溶剂,三氟甲烷磺酸为酸性添加物,在不同的温度条件下催化反应,从序号5,10,11可知,温度较低时产率较低(58%),但立体选择性较好,室温时产率与立体选择性要略微低于0℃.

图3 3a的反应过程及生成物
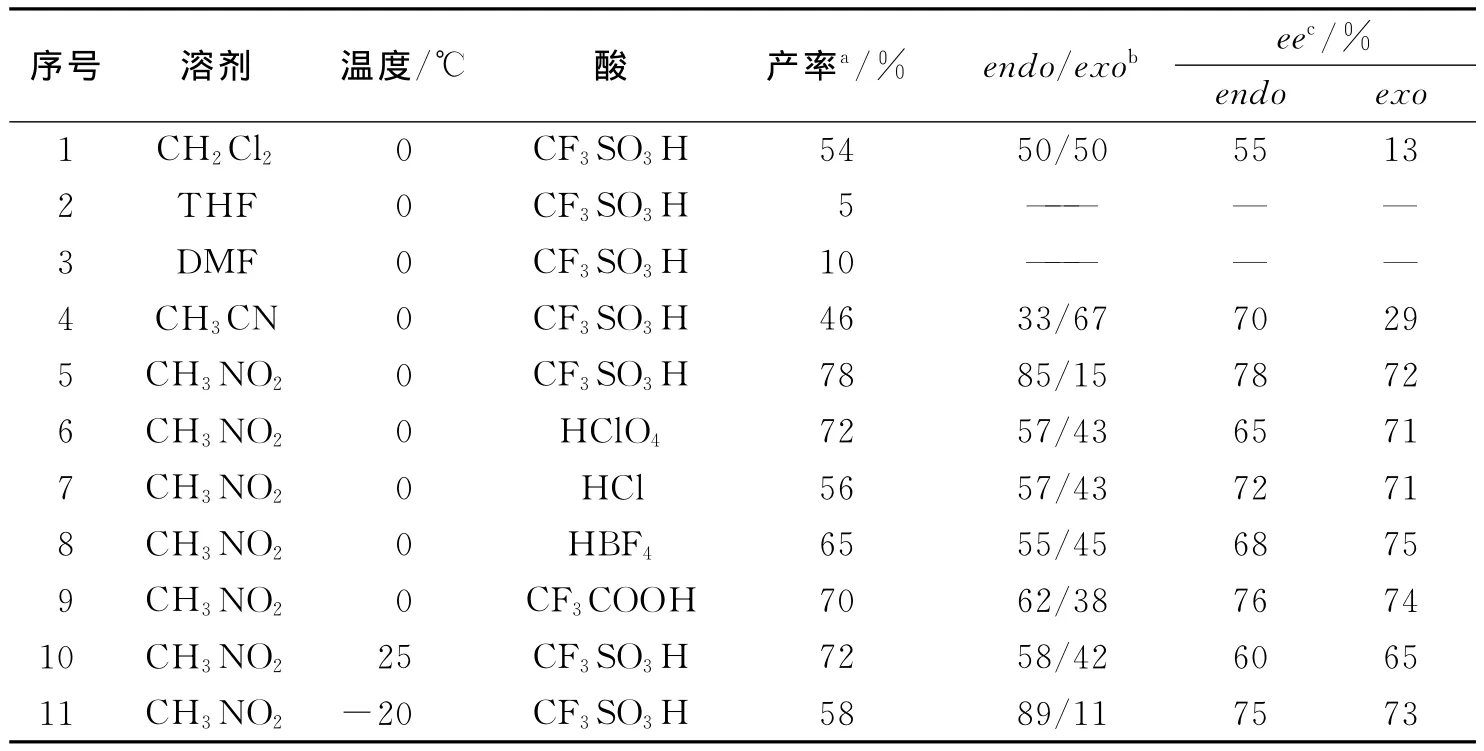
表1 不同条件下催化不对称1,3-偶极环加成反应结果
因此,综合考虑反应产率与立体选择性,最佳催化反应条件为:0℃,硝基甲烷作溶剂,三氟甲磺酸为酸性添加物.
2.2 催化底物探讨 为了进一步研究季鏻盐支载手性咪唑啉酮催化剂对于不同反应底物的适应性,使用模板反应的最佳条件,进行不同反应底物的不对称1,3-偶极环加成反应,发现均具有较好的不对称催化效果(表2).
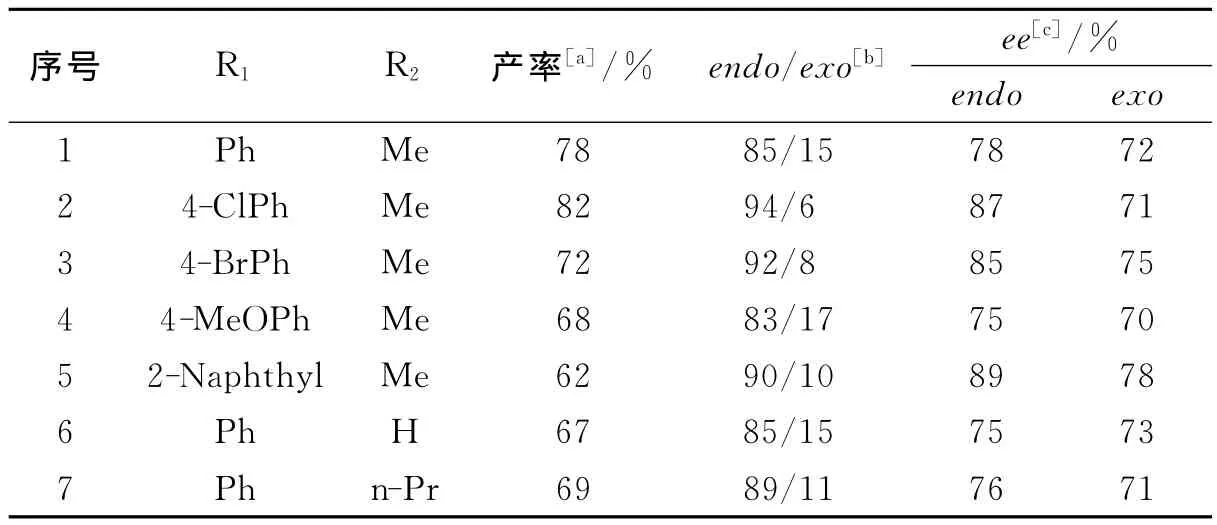
表2 不对称催化不同反应底物结果
2.3 催化剂重复使用性探讨对催化剂的回收循环使用效率进行研究,以1a与反式丁烯醛的1,3-偶极环加成反应为模版,发现通过重结晶可实现对该催化剂的回收,回收产率可达到85%~90%.催化剂重复使用4次催化效果有少许下降(表3).
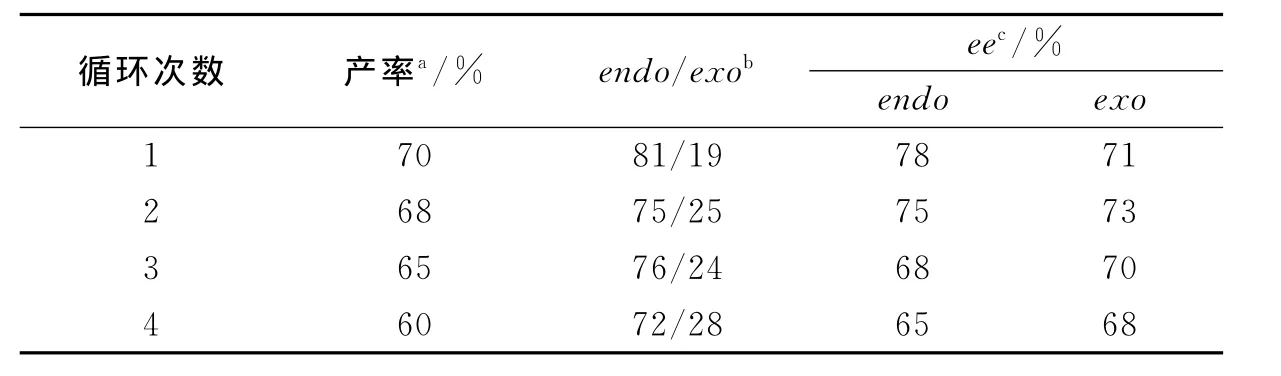
表3 催化剂回收及循环使用结果
3 结论
以可溶性芳基季鏻盐为载体,合成了芳基季鏻盐支载的手性咪唑啉酮,成功应用于硝酮偶极子与α,β-不饱和醛的不对称1,3-偶极环加成反应,得出最佳催化反应条件为0℃,硝基甲烷-水作溶剂,三氟甲磺酸为酸性添加物,其催化产物异恶唑烷酮均具有较高的产率和立体选择性,特别是该催化剂通过冰乙醚沉淀,方便分离纯化并循环利用,在重复使用4次后,其催化活性未见明显降低.
[1]Ahrendt K A,Mac Millan D W C.New strategies for organic catalysis[J].J Am Chem Soc,2000,122:4243-4244.
[2]Alan B,Mac Millan D W C.The first general enantioselective catalytic Diels-Alder reaction with simpleα,βunsaturated ketones[J].J Am Chem Soc,2002,124:2458-2460.
[3]Wendy S,Jen J,Mac Millan D W C.New strategies for organic catalysis[J].J Am Chem Soc,2000,122:9874-9875.
[4]Lee S,Mac Millan D W C.Organocatalytic ainyl and Friedel-Crafts alkylations with trifluoroborate salts[J].J Am Chem Soc,2007,129:15438-15439.
[5]Austin J F,Mac Millan D W C.Enantioselective organocatalytic indole alkylations[J].J Am Chem Soc,2002,124:1172-1173.
[6]Brown S P,Brochu M P,Mac Millan D W C.The direct and enantioselective organocatalyticα-oxidation of aldehydes[J].J Am Chem Soc,2003,125:10808-10809.
[7]Sami A,Selk J T,Petri M.Asymmetric organocatalytic Diels-Alder reactions on solid support[J].Adv Synth Catal,2002,344:941-945.
[8]Naoki H,Shinichi I.Novel polymer-supported organocatalyst via ion exchange reaction[J].Tetrahedron Lett,2010,51:1205-1208.
[9]Jiao Y S,Chang A W,Wei W.Heterogeneous organocatalysis at work[J].Chem Eur J,2011,17:6206-6213.
[10]Alessandra P,Maurizio B,Mauro C,et al.Enantioselective 1,3-dipolar cycloadditions of unsaturated aldehydes promoted by a poly(ethylene glycol)-supported organic catalyst[J].Eur J Org Chem,2004:567-573.
[11]Julia H,Patrick H Toy.Phosphonium ion tagged chiral phosphoric acids and their application in Friedele Crafts reactions of indoles[J].Tetrahedron,2011,67:4103-4109.
[12]Marie N R,Jean C P,Andre B C.Tetraarylphosphonium salts as soluble supports for oxidative catalysts and reagents[J].J Org Chem,2009,74:8510-8515.
[13]Lin Zihan,Chen Zuxing,Yang Guichun,et al.Recyclable tertaaryphosphonium supported chiral imidazolidin-4-one organocatalyst for Diels-Alder reactions[J].Catalysis Communications,2013,35:1-5.

