PEG支载手性二胺催化不对称多米诺迈克尔-羟醛缩合反应
潘小燕,卢翠芬,聂俊琦,陈祖兴,杨桂春
(湖北大学化学化工学院,湖北 武汉430062)
0 引言
手性催化剂广泛应用于不对称催化反应中,取得良好的催化效果[1-2],为方便催化剂的分离纯化、回收和重复使用等,将催化剂支载于聚苯乙烯、聚乙二醇(PEG)、硅胶及树状化合物等载体上,取得良好的催化效果[3-4].为此,以天然L-酪氨酸为手性原料,通过酚羟基将其支载在PEG上,经过系列支载化反应得到PEG支载双(S)-3-(4-氧苯基)甲基丙烷-1,2-二胺手性催化剂1(图1),以水为溶剂,应用于β-酮酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合绿色反应中,探讨其催化效果(图2).
1 实验部分
1.1 仪器及试剂处理 核磁共振仪(NMR):Varian Unity INOVA(600 MHz)及WIPM(400 MHz),指定的氘代试剂为溶剂,TMS为内标;高效液相色谱仪(HPLC):Dionex Ultimate 3000;红外光谱仪(IR):PE-Spectrum One型红外光谱仪,NaCl单晶片涂片或KBr压片;熔点仪:WRS-IA数字熔点仪,上海精密科学仪器有限公司,温度未经校正;TLC紫外灯检测仪:河南予华仪器有限公司,254 nm和365 nm紫外光照射;旋光光度仪:WZZ-2B型自动旋光仪,比旋光度的计算公式:[α]Dt=α/(c×l)(t:25℃,D:钠光589.3 nm,c:所测物质的浓度,g/m L,l:样品管的长度,dm).四氢呋喃(THF)、三乙胺均经钠丝干燥处理,二氯甲烷(DCM)用P2O5干燥处理,DMF用氢化钙干燥处理,其他试剂直接使用.

图1 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺手性催化剂1的制备
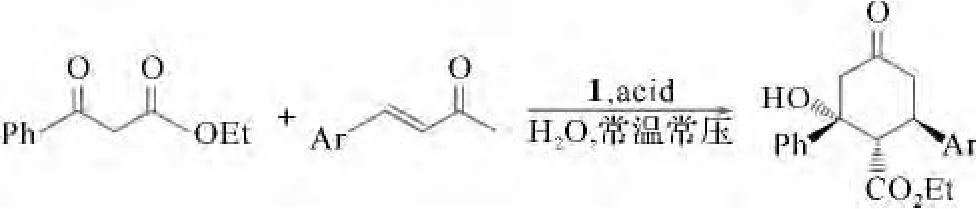
图2 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺催化不对称多米诺迈克尔-羟醛缩合反应
1.2 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺手性催化剂1的合成
1.2.1 化合物2的合成 在150 m L单颈圆底烧瓶中,加入干燥的PEG3400(10 g,5.8 mmol-OH)和DCM(50 m L)及Et3N(4.8 m L,34.8 mmol),冰浴下逐滴加入甲基磺酰氯(1.4 m L,17.4 mmol),滴加完毕,撤冰浴,回流反应6 h后,用饱和NaCl溶液(50 m L×2)洗涤,合并有机相,无水 MgSO4干燥,过滤,浓缩滤液后用无水冰乙醚沉淀,过滤,冰乙醚洗涤固体至TLC(乙酸乙酯∶石油醚=1∶4,体积比)检测PEG键合产物中无小分子杂质,真空干燥得浅黄色粉末2(10.4 g),产率99%;IR(NaCl),v:1 343,1 148 cm-1;1H NMR(600 MHz,CDCl3),δ:3.53~3.77(m,(OCH2CH2)n),3.11~3.16(m,4 H),1.42(t,J=6.8 Hz,6 H);13C NMR(150 MHz,CDCl3),δ:71.4~69.1,46.1,8.8.
1.2.2 化合物3的合成 在150 m L单颈圆底烧瓶中,加入Boc-L-酪氨酸甲酯(20 g,67.8 mmol)和甲胺醇溶液(80 mL,20%~30%),室温搅拌,待反应完全后(约3~4 h),旋干溶剂,粗产物用冰乙醚重结晶,真空干燥得白色固体物3(19.9 g),产率100%;mp:183.5~183.6℃;[α]D20:+7.1(c=2.20,CH3OH);IR(NaCl),v:3 318,1 689,1 652 cm-1;1H NMR(600 MHz,DMSO),δ:7.02(d,J=8.1 Hz,2H),6.65~6.67(d,J=8.1 Hz,2H),4.01~4.05(m,1H),2.83(dd,J=4.38,13.62 Hz,1H),2.58~2.65(m,4H),1.33(s,9H);13C NMR(150 MHz,DMSO),δ:173.0,156.6,156.0,130.9,129.1,115.7,78.8,57.0,37.9,29.1,26.5.
1.2.3 化合物4的合成 在150 m L单颈圆底烧瓶中,加入化合物2(10 g)和无水DMF(50 m L)、化合物3(3.31 g,11.2 mmol)、Cs2CO3(3.67 g,11.2 mmol)及少量18-冠醚-6,65℃反应12 h.减压去DMF,残余物加DCM(20 m L)溶解,过滤除不溶物,滤液用饱和NaCl溶液(50 m L×2)洗涤,合并有机相,无水MgSO4干燥,过滤,浓缩滤液,加无水冰乙醚沉淀,过滤,冰乙醚洗涤至TLC(乙酸乙酯∶石油醚=1∶4,体积比)检测PEG键合产物中无小分子杂质,真空干燥得白色粉末化合物4(10.0 g).产率90%;IR(NaCl),v:3 384,3 359,1 672,1 650,842 cm-1;1H NMR(400 MHz,CDCl3),δ:7.09(d,J=8.4 Hz,2 H),6.83(d,J=8.4 Hz,2 H),4.23~4.27(m,1H),3.47~3.85(m,(OCH2CH2)n),2.97~2.98(m,2H),2.71~2.73(m,3H),1.40(s,9H);13C NMR(150 MHz,CDCl3),δ:171.8,157.8,155.3,130.2,129.1,114.8,79.9,67.5~70.8,61.7,56.2,37.9,28.3,26.1.
1.2.4 化合物5的合成 在250 m L单颈圆底烧瓶中,加入化合物4(10 g)和干燥的THF(100 m L),冰浴下缓慢滴加四氢铝锂(1.15 g,30.4 mmol)的THF(10 m L)悬浮液,滴加完毕,撤冰浴,室温下至反应完全.冰浴下逐滴2 mol/L的HCl溶液淬灭反应,过滤,依次用THF、DCM、CH3OH洗涤,去溶剂,加入DCM(100 m L)溶解,用饱和NaCl溶液(50 m L×2)洗涤,合并有机相,无水 MgSO4干燥,过滤,浓缩滤液,加无水冰乙醚沉淀,过滤,冰乙醚洗涤至TLC(乙酸乙酯∶石油醚=1∶2,体积比)检测PEG键合产物中无小分子杂质,真空干燥得白色粉末化合物5(7.74 g),产率78%;IR(NaCl),v:3 433,1 700,1 512,1 467,842 cm-1;13C NMR(150 MHz,CDCl3),δ:157.2,155.4,129.3,127.6,113.6,86.3,63.2~72.0,58.0,53.2,40.1,38.5,27.6.
1.2.5 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺手性催化剂1的合成 在250 m L单颈圆底烧瓶中,加入化合物5(5 g)和DCM(50 m L),冰浴条件下逐滴加入TFA(5 m L),滴加完毕,撤冰浴,室温反应至完全.去TFA,反应混合物用DCM(50 m L)溶解,依次用饱和的Na HCO3溶液(50 m L×2)和饱和的NaCl溶液(50 m L×2)洗涤,收集有机相,无水MgSO4干燥,过滤,浓缩滤液,加无水冰乙醚沉淀,过滤,冰乙醚洗涤至TLC(乙酸乙酯∶石油醚=1∶2,体积比)检测PEG键合产物中无小分子杂质,真空干燥得白色粉末PEG支载手性1,2-二胺催化剂1(4.0 g).产率82%;IR(NaCl),v:3 524,1 612,1 512,1 456,849 cm-1;1H NMR(600 MHz,CDCl3),δ:7.28~7.32(m),7.10~7.14(m),6.85~6.86(m),4.10(s),3.85(s),3.48~3.77(m),2.43~3.16(m);13C NMR(150 MHz,CDCl3),δ:157.9,130.3,130.0,114.8,67.6~72.6,61.8,53.3,48.8,38.0,28.5.
1.3 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺1催化多米诺迈克尔-羟醛缩合反应一般实验步骤 在带有磨口玻璃塞的反应管中依次加入β-酮酯(6,1.0 mmol)、α,β-不饱和酮(7,0.5 mmol)、催化剂1(20%,摩尔比)、乙醛酸(20%,摩尔比)及H2O(2 m L),室温搅拌一定时间,过滤,依次用H2O及冰乙醚洗涤,收集得白色固体即粗产物环己酮8a~8f(图3).滤液减压蒸馏去溶剂,加DCM萃取,浓缩,加无水冰乙醚沉淀及洗涤,回收手性催化试剂1且回收率在90%以上.
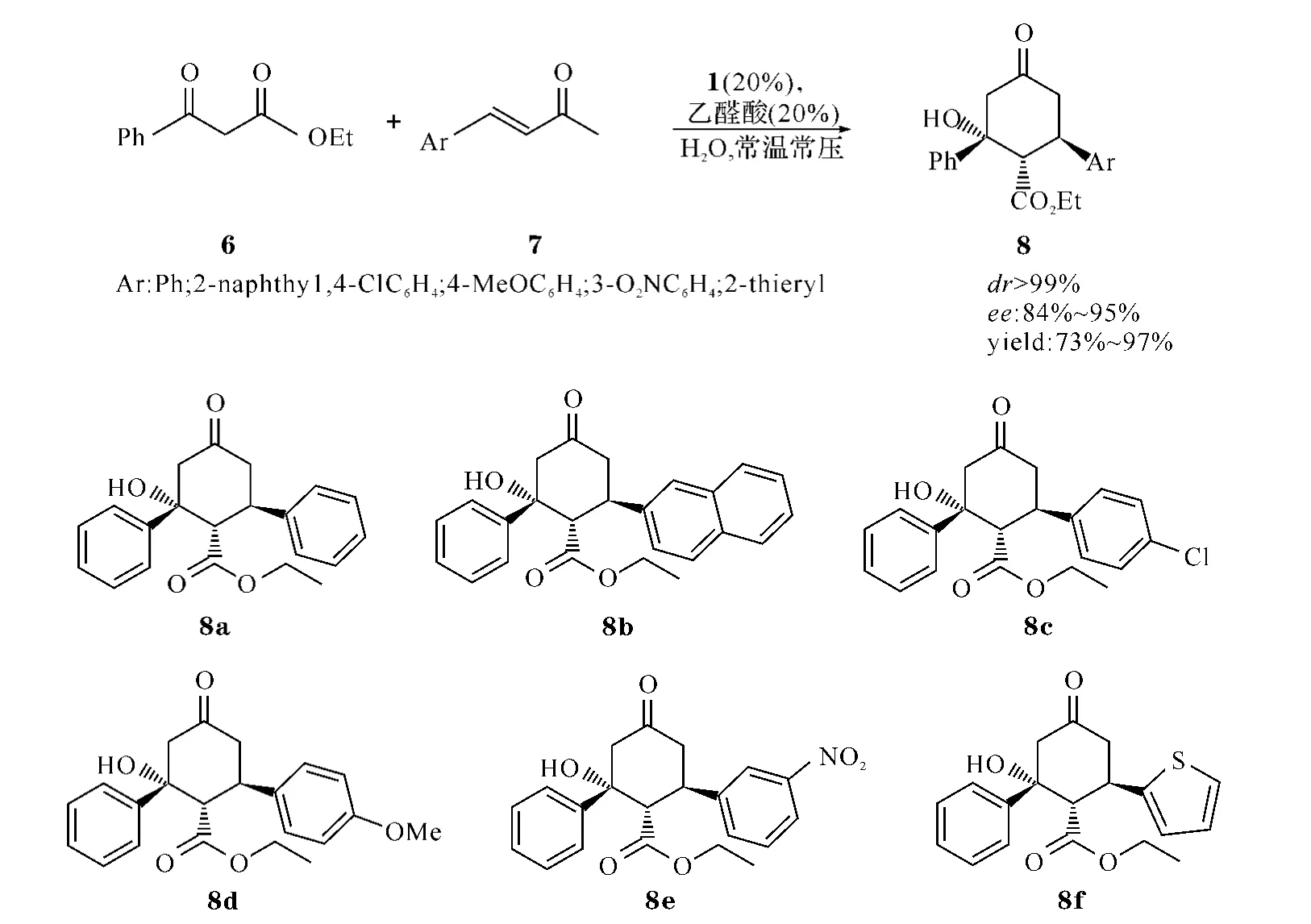
图3 粗产物环已酮8的合成方法及其衍生物(8a~8f)的结构
补充其他数据如下:
1.3.1 (3R,4S,5R)-3-羟基-4-乙氧羰基-3,5-二苯基环己酮(8a) 白色固体,mp:214~215℃;[α]D20=-11.3(c=0.4,DCM);1H NMR(400 MHz,CDCl3):δ7.51(d,J=7.6 Hz,2H,Ar H),7.26~7.35(m,8 H,Ar H),4.44(s,1 H,OH),3.81(m,1 H,CH2CH),3.51~3.58(m,3H,CHCO2Et,CH2CH3),2.68~2.80(m,4H,CH2COCH2),0.53(t,J=6.6 Hz,3H,CH2CH3);13C NMR(100 MHz,CDCl3),δ:205.9,174.3,144.4,140.5,128.9,128.6,127.8,127.7,127.7,124.8,77.5,60.8,56.9,54.2,47.6,43.5,13.4.
1.3.2 (3R,4S,5R)-3-羟基-3-苯基-4-乙氧羰基-5-萘基环己酮(8b) 白色固体,mp:211~214 ℃;+5.6(c=0.6,DCM);1H NMR(400 MHz,CDCl3),δ:7.80~7.85(m,3H,Ar H),7.73(s,1H,Ar H),7.48~7.55(m,5 H,Ar H),7.36(t,J=7.7 Hz,2 H,Ar H),7.27(t,J=6.3 Hz,1H,Ar H),4.48(s,1 H,OH),3.99(dt,J=5.5,11.8 Hz,1H,CH2CH),3.71(d,J=11.8 Hz,1 H,CHCO2Et),3.38~3.54(m,2H,CH2CH3),2.72~2.89(m,4 H,CH2COCH2),0.36(t,J=7.1 Hz,3 H,CH2CH3);13C NMR(100 MHz,CDCl3),δ:206.0,174.3,144.2,137.8,133.5,132.9,128.7,128.6,127.9,127.8,127.8,126.7,126.5,126.2,125.2,124.8,77.6,60.8,56.6,54.2,47.7,43.6,13.3.
1.3.3 (3R,4S,5R)-3-羟基-3-苯基-4-乙氧羰基-5-(4-氯苯基)环己酮(8c) 白色固体,mp:228~229℃;[α]D20=-10.2(c=0.6,DCM);1H NMR(400 MHz,CDCl3),δ:7.49(d,J=7.7 Hz,2H,Ar H),7.23~7.37(m,7H,Ar H),4.36(s,1H,-OH),3.80(dt,J=5.8,11.7 Hz,1H,CH2CH),3.52~3.62(m,3H,CHCO2Et,CH2CH3),2.64~2.79(m,4H,CH2COCH2),0.58(t,J=7.1 Hz,3H,CH2CH3);13C NMR(100 MHz,CDCl3),δ:205.6,174.1,144.0,139.0,133.5,129.1,129.1,128.6,127.9,124.7,77.4,61.0,56.7,54.1,47.5,42.8,13.5.
1.3.4 (3R,4S,5R)-3-羟基-3-苯基-4-乙氧羰基-5-(4-甲氧基苯基)环己酮(8d) 白色固体,mp:198~-9.5(c=0.6,DCM);1H NMR(400 MHz,CDCl3),δ:7.50(d,J=7.5 Hz,2H,Ar H),7.35(t,J=7.6 Hz,2H,Ar H),7.20~7.28(m,3H,Ar H),6.86(d,J=8.7 Hz,2H,Ar H),4.41(s,1H,-OH),3.79(s,3H,-OCH3),3.72~3.78(m,1H,CH2CH),3.51~3.61(m,3H,CHCO2Et,CH2CH3),2.66~2.79(m,4 H,CH2COCH2),0.57(t,J=7.1 Hz,3 H,CH2CH3);13C NMR(100 MHz,CDCl3),δ:206.0,174.4,159.2,144.5,132.7,128.7,128.6,127.7,124.8,114.4,77.4,60.8,57.2,55.5,54.2,48.0,42.7,13.5.
1.3.5 (3R,4S,5R)-3-羟基-3-苯基-4-乙氧羰基-5-(3-硝基苯基)环己酮(8e) 白色固体,mp:215~216-20(c=0.6,DCM);1H NMR(400 MHz,CDCl3),δ:8.26(s,1H,Ar H),8.16(d,J=8.2 Hz,1H,Ar H),7.62(d,J=7.5 Hz,1H,Ar H),7.50~7.55(m,3H,Ar H),7.38(t,J=7.6 Hz,2H,Ar H),7.26~7.31(m,1 H,Ar H),4.32(d,J=2.5 Hz,1 H,-OH),3.97(dt,J=6.4,11.5 Hz,1 H,CH2CH),3.49~3.65(m,3 H,CHCO2Et,CH2CH3),2.71~2.84(m,4H,CH2COCH2),0.54(t,J=7.1 Hz,3 H,CH2CH3);13C NMR(100 MHz,CDCl3),δ:204.7,173.7,148.7,143.7,142.7,134.4,130.0,128.7,128.0,124.7,122.9,122.3,77.5,61.1,56.4,54.0,47.2,42.9,13.5.
1.3.6 (3R,4S,5R)-3-羟基-3-苯基-4-乙氧羰基-5-噻吩环己酮(8f) 白色固体,mp:189~191℃;[α]D20=-16.8(c=0.6,DCM);1H NMR(600 MHz,CDCl3),δ:7.48(d,J=7.3 Hz,3 H,Ar H),7.35(t,J=7.8 Hz,2H,Ar H),7.23(d,J=5.2 Hz,1H,Ar H),6.90~6.93(m,2H,Ar H),4.37(s,1H,OH),4.16(dt,J=4.5,11.9 Hz,1H,CH2CH),3.61~3.70(m,2H,CH2CH3),3.51(d,J=11.9 Hz,1H,CHCO2Et),2.67~2.77(m,4H,CH2COCH2),0.66(t,J=7.1 Hz,3H,CH2CH3);13C NMR(150 MHz,CDCl3),δ:204.8,174.2,144.5,144.1,128.6,127.8,126.9,125.2,124.8,124.5,77.2,61.0,58.5,54.1,48.7,38.8,13.5.
2 结果与讨论
2.1 PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺1手性催化剂溶解性 PEG支载二胺手性催化剂1在丙酮、CH2Cl2、THF,DMSO、DMF、水等良溶剂中有较好的溶解性,在乙醚、乙醇及甲醇等不良溶剂中不溶,因而该催化剂在良溶剂中进行均相催化反应,在不良溶剂中可重结晶,方便分离纯化和重复使用.
2.2 催化条件探讨 以水为溶剂,在添加剂酸的作用下,探讨添加剂种类、反应时间、反应温度及催化剂的用量等因素对PEG支载手性二胺催化(E)-4-苯基-3-丁烯-2-酮与苯甲酰乙酸乙酯多米诺迈克尔-羟醛缩合反应的影响,结果见表1.
图4 PEG支载手性二胺催化β-酮酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合反应条件优化

表1 PEG支载手性二胺催化β-酮酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合反应条件优化
根据上表结果所示,PEG支载手性二胺催化多米诺迈克尔-羟醛缩合反应的优化条件为:添加剂为乙醛酸及用量为20%,反应温度为25℃,催化剂量为20%,反应时间为7 d,具有良好的催化效果.
2.3 PEG支载手性二胺催化β-酮酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合反应 催化剂1的量为20%(摩尔比),以乙醛酸(20%(摩尔比))为添加剂,25℃条件下催化苯甲酰乙酸乙酯与α,β-不饱和酮的反应,反应时间为7 d,其结果见表2.从表2可看出,PEG支载手性二胺催化剂高立体选择性地催化苯甲酰乙酸乙酯与苯环上含有供电子基团、吸电子基团和稠环及杂环的α,β-不饱和酮之间的多米诺迈克尔-羟醛缩合反应,具有良好的催化效果.

图5 PEG支载手性二胺催化β-酮酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合反应
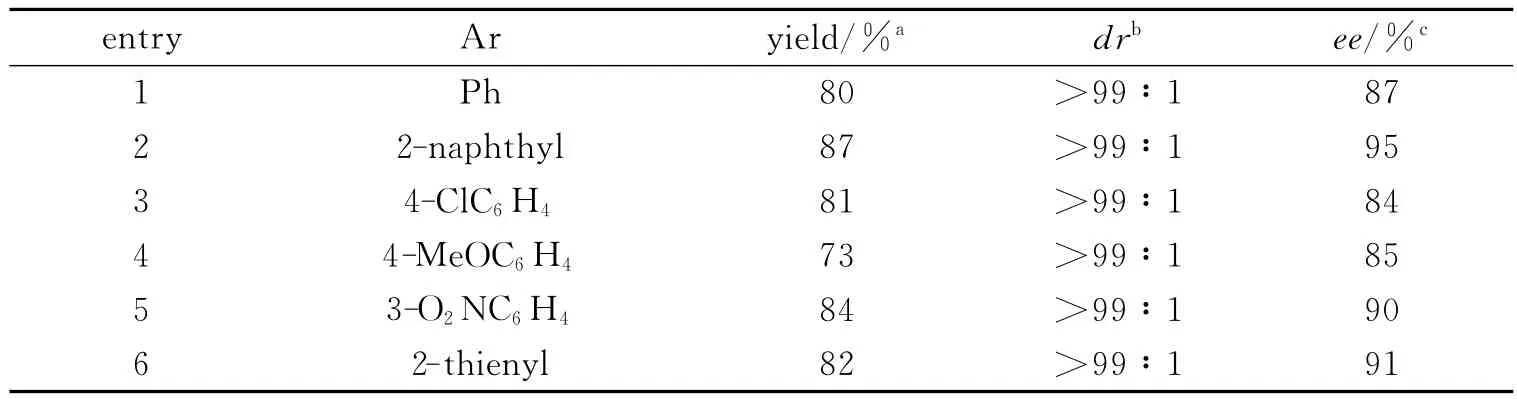
表2 PEG支载手性二胺催化苯甲酰乙酸乙酯与α,β-不饱和酮的多米诺迈克尔-羟醛缩合反应
3 催化剂的回收及重复使用
小分子手性催化剂难以回收循环使用,而本文中合成的PEG支载的手性二胺催化剂,催化苯甲酰乙酸乙酯与(E)-4-苯基-3-丁烯-2-酮的多米诺迈克尔-羟醛缩合反应之后,通过萃取及冰乙醚重结晶,就可回收纯化手性催化剂,并进行重复使用,结果于表3,从表3可知,催化剂重复使用4次后,催化产率有所下降,但立体选择性变化不明显.

表3 催化剂的循环使用结果
4 结论
综上所述,我们将Boc保护的(S)-2-(4-羟基苄基)-N-甲基乙酰胺支载在PEG上,合成了PEG支载双(S)-3-(4-氧苯基)-N1-甲基丙烷-1,2-二胺手性催化剂,该手性试剂以水为溶剂高收率、高立体选择性催化了不同的α,β-不饱和酮与β-酮酯之间的多米诺迈克尔-羟醛缩合反应,得到具有多个手性中心的光学纯度的化合物,同时实现了手性催化试剂的回收循环使用,符合绿色手性合成化学的发展趋势.
[1]Bennani Y L,Stephen H.Trans-1,2-Diaminocyclohexane derivatives as chiral reagents,scaffolds,and ligands for catalysis:applications in asymmetric synthesis and molecular recognition[J].Chem Rev,1997,97:3161-3195.
[2]Anniina E,Inkeri M,Petri M P.Iminium Catalysis[J].Chem Rev,2007,107:5416-5470.
[3]Toshimasa S,Yamato K,Kazumasa O,et al.Reusable polymer-supported 2,2′-biarylpyridine-copper complexes for Huisgen[3+2]cycloaddition in water[J].Heterocycles,2012,85:615-626.
[4]Mai W P,Gao L X.PEG-supported dipyridyl ligand for palladium-catalyzed Suzuki and Suzuki-type reactions in PEG and aqueous media[J].Synlett,2006,16:2553-2558.
[5]Arróniz C,Escolano C,Luque F J,et al.First asymmetric cascade reaction catalysed by chiral primary aminoalcohols[J].Org Biomol Chem,2011,9:5079-5085.

