非酒精性脂肪性肝病患者的炎症细胞因子水平与氧化应激参数的变化
方文军,陆 帅,陈寒蓓,苏 青
(1.上海交通大学医学院附属新华医院内分泌科,上海 200092;2.上海交通大学医学院附属新华医院崇明分院内分泌科,上海 202150)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)在西方国家是最常见的慢性肝脏疾病,患病率为25% ~30%[1];随着经济的发展,我国NAFLD患病率增长迅速,上海、广州等地区成人NAFLD患病率高达15%,在美国和我国等亚洲国家的儿童和青少年中的患病率甚至达到2%~10%[2]。因此,NAFLD已成为一种呈现全球化趋势的常见慢性肝病。NAFLD在病理上可分为单纯性肝脂肪变性、脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和脂肪性肝硬化,部分发展为肝细胞癌。炎症细胞因子和氧化应激在单纯性肝脂肪变性形成及进展为脂肪性肝炎过程中可能起着重要作用。本研究观察NAFLD患者炎症细胞因子和氧化应激参数的变化。
1 资料与方法
1.1 一般资料
2010年1月至2012年12月上海交通大学医学院附属新华医院内分泌门诊和体检中心诊断为NAFLD患者182例,其中男性134例,女性48例,平均年龄(46.7±9.1)岁;健康对照组50例,男性40例,女性 10例,平均年龄(46.1±7.7)岁。NAFLD组患者排除标准:(1)合并严重的心、肺、肾病,2型糖尿病,结缔组织疾病和恶性肿瘤;(2)进展至肝硬化期;(3)近3个月内使用过二甲双胍、胰岛素增敏剂及降脂、保肝药物;(4)妊娠妇女、吸烟者。所有患者签署了知情同意书。
1.2 病例入选标准
采用2006年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组制定的标准[3]。(1)无饮酒史或饮酒折合成乙醇量男性每周<140 g,女性每周<70 g;(2)除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;(3)除原发疾病临床表现外,可有乏力、消化不良、肝区隐痛、肝脾肿大等非特异性症状及体征;(4)可有体质量超重和或内脏性肥胖、空腹血糖增高、血脂紊乱、高血压等代谢综合征相关组分;(5)血清转氨酶和γ-谷氨酰转肽酶水平可有轻至中度增高(<5倍正常值上限),通常以丙氨酸氨基转移酶增高为主;(6)肝脏影像学表现符合弥漫性脂肪肝的影像学诊断标准;(7)肝活体组织检查组织学改变符合脂肪性肝病的病理学诊断标准。凡具备以上第1~5项和第6或第7项中任何一项者即可诊断为NAFLD。
1.3 观察指标
所有研究对象禁食10 h以上,次日清晨测量身高、体质量、血压,空腹抽血检测血清 TNF-α、IL-6、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(GGT)、超敏C反应蛋白(high-sensitivity C-reactive protein,hsCRP)、游离脂肪酸(free fatty acids,FFA)、空腹胰岛素(fasting insulin,FINS)、餐后2 h胰岛素(2 hour postprandial insulin,2hINS)、空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(two hours postpr-andial blood glucose,2hPG)、血脂和尿酸(uric acid,UA),测定肝、脾CT比值。
1.4 检测方法
TNF-α、IL-6均采用化学发光法测定(试剂盒购自德国西门子公司),MDA采用硫代巴比妥法测定(试剂盒购自南京建成生物科技有限公司),SOD采用比色法测定(试剂盒购自福州福缘生物科技有限公司),FFA采用美国Dionex Summit高压液相色谱仪测定,超敏CRP水平采用颗粒增强免疫沉淀法测定(试剂盒购自芬兰Orion Diagnostira公司),INS采用放射免疫法测定,计算稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR):HOMA -IR=FPG ×FINS/22.5。
1.5 统计学分析
2 结 果
2.1 2组基线特征和相关代谢指标对比
NAFLD 患者 BMI、2hPG、FINS、2h INS、HOMAIR、TC、LDL-C、TG、UA、FFA、hsCRP、ALT、AST、GGT显著高于健康对照组(均P<0.05),肝/脾CT比值明显低于健康对照组(P<0.01),2组血压、FPG、HDL-ch无统计学差异(P >0.05),见表1。
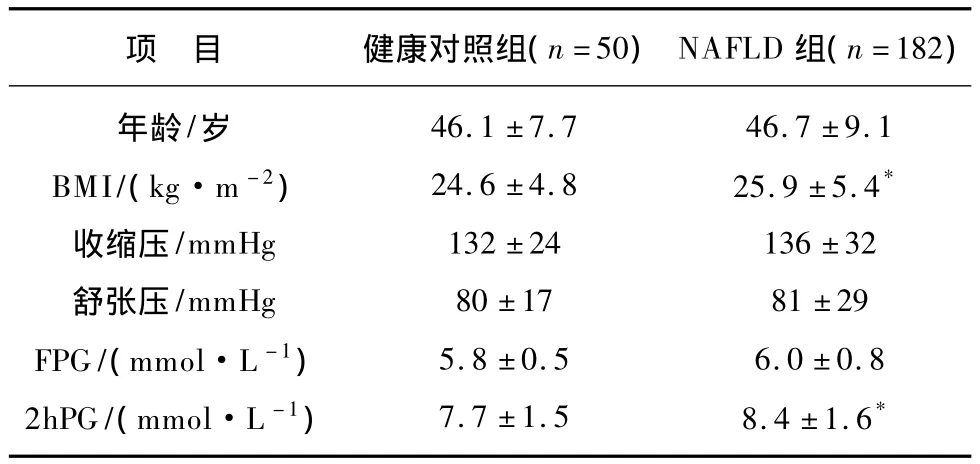
表1 2组基线特征和相关代谢指标对比Tab.1 Baseline data and metabolic parameters
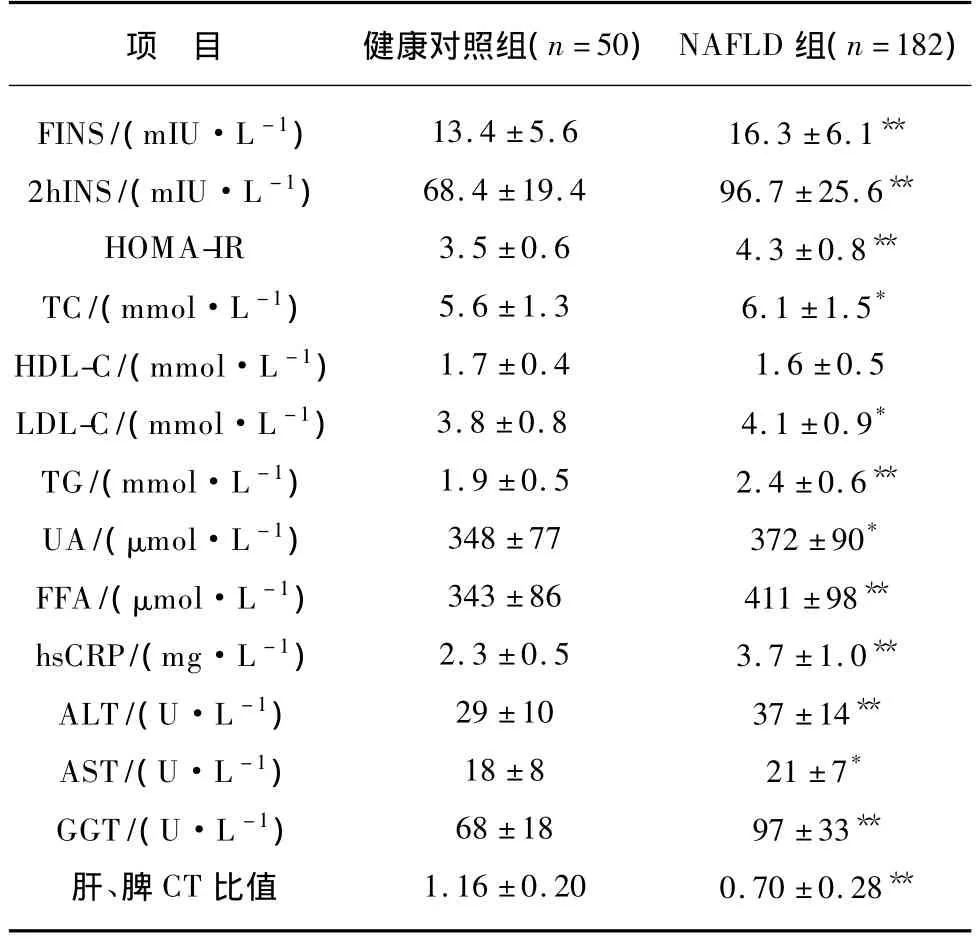
(续表1)
2.2 2组炎症细胞因子与氧化应激参数的比较
NAFLD组患者血清TNF-α、IL-6和MDA均显著高于健康对照组(P<0.01),而SOD水平低于健康对照组(P <0.01),见表2。

表2 2组炎症细胞因子水平与氧化应激参数的比较Tab.2 The levels of inflammatory cytokines and oxidative stress parameters in two groups
2.3 相关因素的分析
经Pearson相关分析显示,NAFLD患者血清TNF-α 水平与 HOMA-IR、FFA、TG、BMI、2hINS 呈正相关(r=0.279、0.303、0.233、0.168、0.345,P=0.000、0.000、0.001、0.024、0.000);血清 IL-6 水平同样与 HOMA-IR、FFA、TG、BMI、2hINS 呈正相关(r=0.257、0.312、0.285、0.179、0.275,P=0.000、0.000、0.000、0.010、0.000);血清 MAD 水平与ALT、AST 呈正相关(r=0.314、0.196,P=0.000、0.009);而血清 SOD水平与 ALT呈负相关(r=-0.268,P=0.000)。
3 讨 论
NAFLD被认为是一种与肥胖、高胰岛素血症、糖代谢异常关系密切的病理综合征,美国临床内分泌医师学会(AACE)将其归为代谢综合征(metabolic syndrome,MS)组分之一,有人将NAFLD视为MS在肝脏的表现[4]。本研究中观察到 NAFLD 组 患 者 BMI、2hPG、FINS、2hINS、HOMA-IR、TC、LDL-C、TG、UA 和 FFA 明显高于健康对照组,可见NAFLD与胰岛素抵抗(insulin resistance,IR)、MS关系密切。
目前对于NAFLD的发病机制尚不十分清楚,胰岛素抵抗、脂肪酸代谢障碍、线粒体功能障碍、氧化应激以及脂肪细胞因子网络的调节紊乱是引起肝脂肪变性直至进展至非酒精性脂肪性肝炎的重要原因。然而对于这些因素是如何相互作用并引起NASH的分子发病机制尚不完全清楚,当前比较认可的是Day等[5]提出的“二次打击”学说:第一次打击主要为胰岛素抵抗导致的肝脏脂肪沉积、肝细胞脂肪变性,第二次打击是在肝脏脂肪沉积基础上引起氧化应激及脂质过氧化,造成肝细胞线粒体和肝细胞本身的持续损伤和炎症的形成。第二次打击增加了肝细胞对凋亡和坏死的易感性,进一步促进肝纤维化和肝硬化的发生和发展。
本研究观察到NAFLD患者炎症细胞因子TNF-α、IL-6及脂质过氧化产物MDA显著增高,抗氧化物 SOD下降,与多数研究结果相符[6-10]。TNF-α、IL-6是重要的致炎细胞因子,主要由吞噬细胞产生,NAFLD患者存在脂肪组织和肝脏免疫功能紊乱,聚集着异常增多的巨噬细胞,是炎症细胞因子的主要来源。另外,脂肪细胞和肝细胞也可分泌TNF-α 和 IL-6,后者介导巨噬细胞浸润[11],这一现象在肥胖患者更为明显。TNF-α通过激活NF-κB或JNK信号转导通路抑制肝细胞胰岛素受体底物1(insulin receptor substate-1,IRS-1)和IRS-2的磷酸化,导致肝细胞胰岛素抵抗。IL-6通过诱导细胞因子信号转移抑制因子(suppressors of cytokine siganaling 3,SOCS3)的表达,促进局部(如肝脏)和全身的胰岛素抵抗[12]。因此,炎症细胞因子是肥胖患者产生胰岛素抵抗的重要因素。炎症细胞因子诱导胰岛素抵抗而导致NAFLD的发生与发展,NAFLD形成后分泌更多的炎症细胞因子,并于NASH时达到峰值[13-14],可能与此期肝细胞内NF-κB等信号通道激活以及肝脏发生Th-1极化产生大量的 TNF-α 和 IL-6 有关[15-16],加剧胰岛素抵抗,进而引起糖尿病和动脉粥样硬化疾病。
大量的游离脂肪酸(free fatty acids,FFA)进入肝脏导致肝脏脂肪沉积、肝细胞脂肪变性,过多的FFA促进内质网的氧化应激产生大量活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen,RNS),导致脂质过氧化,消耗抗氧化物质如超氧歧化酶SOD。MDA是脂质过氧化反应过程中不饱和脂肪酸氧化分解释放出的反应性醛,是脂质过氧化反应的终产物,可严重破坏生物膜、蛋白质、核酸等大分子物质,导致细胞肿胀、坏死,MDA的含量反映机体脂质过氧化的程度,也间接反映肝损伤的程度[17]。MDA还间接地激活氧化还原敏感性转录因子如NF-κB或活化蛋白-1(AP-1),由此促进了Kupffer细胞和其他非主质细胞对细胞毒性、促炎症反应和/或纤维生成介质的合成,促进肝纤维化和肝硬化的发生和发展,故慢性氧化应激可能是促使单纯性肝细胞脂肪变性进展至NASH的重要原因;抗氧化剂维生素 E、S-腺苷蛋氨酸等降低NASH的ALT、GGT与炎症细胞因子也印证了氧化应激在NAFLD的进展中作用[18-19]。氧化应激反应激活线粒体途径产生炎症介质引起细胞凋亡和肝损伤;FFA还可以使得溶酶体功能异常,改变凋亡受体基因表达,因此脂凋亡是NAFLD发病过程中的关键因素,与炎症进展和纤维化有关[20]。
hsCRP作为全身炎症的敏感标志物,主要受循环中的IL-6和TNF-α的调节,与糖尿病及心血管疾病患病明显相关,hsCRP升高提示NAFLD患者存在血管病变。
NAFLD与胰岛素抵抗、MS三者关系复杂、可能互为因果。胰岛素抵抗是NAFLD的基本特征,通过多种直接或间接的机制与NAFLD的发生发展密切相关。而炎症细胞因子的分泌变化是影响组织对胰岛素敏感性的重要因素。肝脏脂肪沉积产生氧化应激,损害肝细胞,导致NASH并进而发展为脂肪性肝硬化。然而NAFLD患者发展为肝硬化或死于肝脏相关并发症比率不高,主要还是合并MS而由此引起的并发症才是影响NAFLD患者预后的重要因素。不过,NAFLD的发病机制仍不明了,需要进一步的研究。
[1]Ong JP,Younossi ZM.Epidemiology and natural history of NAFLD and NASH[J].Clin Liver Dis,2007,11:1-16.
[2]Papandreou D,Rousso I,Mavromichalis I.Update on non-alcoholic fatty liver disease in children[J].Clin Nutr,2007,26:409-415.
[3]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2006年2月修订)[J].现代消化及介入治疗,2007,12(4):266-268.
[4]Henao-Mejia J,Elinav E,Jin C,et al.Inflammasomemediated dysbiosis regulates progression of NAFLD and obesity[J].Nature,2012,482:179-185.
[5]Day CP,James OF.Steatohepatitis:a tale of two“hits”[J]?Gastroenterology,1998,114:842-845.
[6]Videla LA,Rodrigo R,Orellana M,et al.Oxidative stress-related parameters in the liver of non-alcoholic fatty liver disease patients[J].Clini Sci(Lond),2004,106(6):261-268.
[7]Tahan V,Eren F,Avsar E,et al.Rosiglitazone attenuates liver inflammation in a rat model of nonalcoholic steatohepatitis[J].Dig Dis Sci,2007,52:3465-3472.
[8]Jarrar MH,Baranova A,Collantes R,et al.Adipokines and cytokines in non-alcoholic fatty liver disease[J].Aliment Pharmacol Ther,2008,27:412-21.
[9]Tilg H.The role of cytokines in non-alcoholic fatty liver disease[J].Dig Dis,2010,28:179-185.
[10]Das SK,Balakrishnan V.Role of cytokines in the pathogenesis of non-alcoholic fatty liver disease[J].Indian J Clin Biochem,2011,26:202-209.
[11]Marra F,Bertolani C.Adipokines in liver diseases[J].Hepatology,2009,50(3):957-969.
[12]Farrell GC.Signalling links in the liver:knitting SOCS with fat and inflammation[J].J Hepatol,2005,43(1):193-196.
[13]Hui JM,Hodge A,Farrell GC,et al.Beyond insulin resistance in NASH:TNF-alpha or adiponectin?[J].Hepatology,2004,40:46-54.
[14]Wieckowska A, Papouchado BG, Li Z, et al.Increased hepatic and circulating interleukin-6 levels in human nonalcoholic steatohepatitis[J].Am J Gastroenterol,2008,103:1372-1379.
[15]Choi S, Diehl AM. Role of inflammation in nonalcoholic steatohepatitis[J].Curr Opin Gastroenterol,2005,21:702-707.
[16]Shoelson SE,Herrero L,Naaz A.Obesity,inflammation,and insulin resistance[J].Gastroenterology,2007,132:2169-2180.
[17]Koruk M,Taysi S,Savas M C,et al.Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steatohepatitis[J].Acta Clin Lab Sci,2004,34:57-62.
[18]Chang CY,Argo CK,Al-Osaimi AM,et al.Therapy of NAFLD:antioxidants and cytoprotective agents[J].J Clin Gastroenterol,2006,40(Suppl):S51-60.
[19]Pacana T,Sanyal AJ.Vitamin E and nonalcoholic fatty liver disease[J].Curr Opin Clin Nutr Metab Care,2012,15:641-648.
[20]Ibrahim SH,Kohli R,Gores GJ.Mechanisms of lipotoxicity in NAFLD and clinical implications[J].JPGN,2011,53:131-140.

