并加法制备超细二氧化硅
李志林,张少卿,石俊青
(河北大学化学与环境科学学院,河北保定 071002)
超细二氧化硅是一种高新技术的无机精细化学品,由于它具有不寻常的颗粒特征,即极小的粒径、较大的比表面积和优良的化学性能,表现出良好的亲水性、补强性、增稠性、消光性和防粘结性,从而广泛应用于橡胶、涂料、医药、油墨等领域,是工业上不可缺少的原料[1]。目前,制备二氧化硅的方法可分为干法和湿法两种,干法包括气相法[2]和电弧法,湿法主要有微乳液法[3]、凝胶法[4]和沉淀法[5]。 化学沉淀法具有原料廉价易得、生产流程简单、能耗低的优点,使得该法成为目前主要的生产方法。但是传统沉淀法反应得到的产物纯度不高、均匀性差、比表面积小、相对其他4种方法质量较差,因此有必要改良传统的沉淀法[6]。采用单向进料沉淀时,由于投料量大,即使搅拌速度特别快,仍未能避免料液的黏度随着pH的降低而显著升高带来的料液流动性急速降低的不利影响[7]。故笔者采用了双向并加法加入Na2O·3.27SiO2和H2SO4制备形状较好、粒度分布均匀、孔径为2~20 nm的超细二氧化硅,并考察了原料加入速度、表面活性剂、洗涤剂等对实验的影响。
1 实验部分
1.1 主要原料与仪器
硅酸钠(模数3.27,质量分数为27.38%),浓硫酸(分析纯,质量分数为95%~98%),邻苯二甲酸二丁酯(分析纯)。
3020-Ⅱ型氮气吸附脱附比表面积仪;KYKY-2800B型扫描电子显微镜;Nicolet-380型红外光谱仪;Y-2000型X射线衍射仪。
1.2 制备过程
底液的配制:量取50 mL蒸馏水与一定量的表面活性剂混合均匀作为底液。
原料的配制:量取Na2O·3.27SiO2和H2SO4,均稀释到物质的量分数为10%,85℃保温,待用。
将底液加入到烧瓶中,85℃时,采用并加法同时加入Na2O·3.27SiO2和H2SO4,搅拌反应2 h后,停止搅拌,陈化2 h,将沉淀分为两份,抽滤,分别用水、乙醇洗涤,干燥,煅烧,得到二氧化硅粉末。考察了原料加入速度、表面活性剂、洗涤剂对实验的影响。
2 结果与讨论
2.1 原料加入速度对吸油值的影响
采用化工行业标准HG/T 3072—2008《橡胶配合剂沉淀水合二氧化硅邻苯二甲酸二丁酯(DBP)吸收值的测定》的要求测定吸油值。样品作为填料,吸油值高,表明基体分子能够进入的孔隙体积越大,SiO2分子与基体分子的结合能力越强,补强性也就越高[8]。 图 1为改变 Na2O·3.27SiO2加入速度二氧化硅吸油值的变化。由图1可以看出:改变Na2O·3.27SiO2加入速度对吸油值的影响较大,合适的加入速度可以改善产品的质量。

图1 改变Na2O·3.27SiO2加入速度二氧化硅吸油值的变化
2.2 洗涤剂对二氧化硅质量的影响
2.2.1 对形状、粒度的影响
图2是未添加表面活性剂的二氧化硅粉体的SEM照片。从图2可以看出,二氧化硅消光剂是由许多粒子堆积形成,二氧化硅的颗粒大部分呈圆形或椭圆形,形状较好,粒度分布比较均匀。图2a是用水洗涤的二氧化硅粉体,图2b是用乙醇洗涤的二氧化硅粉体。可以看出,图2b的形状、粒度分布与图2a相比较好且较均匀。这是由于,用水洗涤后残留在颗粒间的微量水会通过氢键而使颗粒团聚在一起,而用乙醇可以减少这种液桥作用,从而获得团聚少的粉体[9]。

图2 未添加表面活性剂的二氧化硅粉体的SEM照片
2.2.2 对比表面积、孔径的影响
图3为样品的N2吸附-脱附曲线。由图3可知,在相对压力P/P0小于0.7的范围内,等温线比较平坦;当相对压力大于0.7后,等温线急剧上升,这与样品中含有一定量的中孔和较大的孔隙有关,因此导致了毛细管凝聚现象的发生,使得等温线在高压区吸附和脱附分支并不重叠[10]。采用BET方程和BJH模型计算样品的比表面积和孔径分布,用水洗涤的SiO2粉体比表面积为214.1 m2/g,平均孔径为15.78 nm;用乙醇洗涤的SiO2粉体比表面积为222.7 m2/g,平均孔径为16.95 nm。

图3 N2吸附-脱附曲线
2.3 表面活性剂对孔径、比表面积的影响
图4分别为未添加、加入OP-10、加入AEO-3、加入CTAB且均用乙醇洗涤的样品的N2吸附-脱附曲线。由图4可以看出,在未添加表面活性剂的条件下,样品的比表面积、孔径较好。孔径在2 nm以下的微孔,高分子很难渗入其中,对补强没有意义,而孔径在2~20 nm的中孔和孔径在20~60 nm的大孔与高分子作用较强,对补强性特别重要[11]。

图4 N2吸附-脱附曲线
2.4 FT-IR、XRD 分析
图5为未添加表面活性剂、乙醇洗涤的SiO2粉体100℃烘干后与溴化钾压片的FT-IR谱图。由图5可以看出:3453.29 cm-1处的峰为Si—OH的反对称伸缩振动峰,1644.83 cm-1处是物理吸附水的弯曲振动吸收峰,1136.99 cm-1处强而宽的吸收带为Si—O—Si反对称伸缩振动峰,956.43 cm-1处为 Si—OH弯曲振动吸收峰,809.72 cm-1处为Si—O—Si对称伸缩振动峰,465.52 cm-1处的吸收峰对应于Si—O—Si键的弯曲振动,与SiO2标准FT-IR谱图吻合。
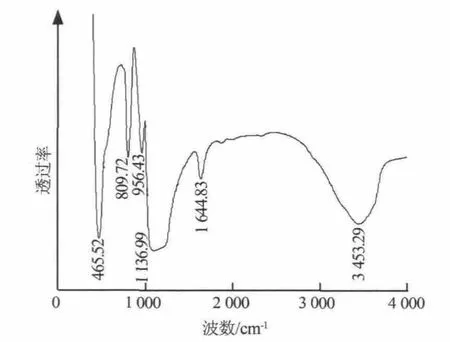
图5 SiO2粉体的红外光谱图
图6为未添加表面活性剂、乙醇洗涤的SiO2粉体100℃烘干后的XRD谱图。由图6可以看出:2θ=23°处有一个较宽泛的馒头峰是非晶态的SiO2物质的特征峰,这与卡片JCPDS(29-0085)完全一致。由此证明:二氧化硅粉体是由非晶态的无定形二氧化硅组成。

图6 SiO2粉体的XRD谱图
2.5 热处理分析
多孔SiO2颗粒干燥时,水分最初因毛细管作用向表面移动,并维持表面完全润湿,先是大孔中的水分减少,接着才到较小孔中的水分[12]。此时若采用较高温度下快速干燥常会导致干燥产物强度降低,产生开裂。因此采用分步干燥的方法,即先将物料在85℃下干燥2 h,然后再升温到100℃干燥2 h,以此来减小水分蒸发过快导致SiO2颗粒微孔结构塌陷而强度降低的不利影响。
3 结论
1)以Na2O·3.27SiO2和 H2SO4为原料,采用并加法制备超细二氧化硅,最佳反应条件为:Na2O·3.27SiO2加入速度为70 r/min,无表面活性剂加入,使用乙醇洗涤,85℃干燥2 h后100℃干燥2 h。2)最佳反应条件下制备的超细SiO2粉体形状较好,粒度分布比较均匀,比表面积为222.7 m2/g,平均孔径为16.95 nm。
[1]周产力,寇战峰,刘钧.超细二氧化硅的制备及应用[J].无机盐工业,2001,33(4):22-24.
[2]王欣,安杉,李延国,等.气相法二氧化硅生产现状和展望[J].氯碱工业,2012,48(6):21-23.
[3]Sun Bo,Guo Yong,Xu Le,et al.Synthesis of zeolite/mesoporous silica composite microspheres by microemulsion method[J].Acta Chim.Sinica,2012,70(23):2419-2424.
[4]黄志娟,许湧深,章华桂,等.SiO2溶胶在微滴乳液聚合中的原位纳米复合[J].化工学报,2012,63(6):1902-1906.
[5]王玲燕,杜芳林.二氧化硅中空微球的制备与表征[J].青岛科技大学学报:自然科学版,2012,33(3):229-232.
[6]芳明.纳米二氧化硅的制备、表面改性和应用前景[J].精细化工原料及中间体,2011(1):19-23.
[7]向斌,韦奉,杨永锋.并流式进料沉淀法二氧化硅的制备[J].重庆大学学报,2008,31(11):1327-1332.
[8]高正楠,江小波,郭锴.KH550的水解工艺及其对SiO2表面改性的研究[J].北京化工大学学报:自然科学版,2012,39(2):7-12.
[9]霍玉秋,翟玉春.醇盐水解沉淀法制备二氧化硅纳米粉[J].微纳电子技术,2003(9):26-28.
[10]甄开吉.催化作用基础[M].北京:科学出版社,2005:47-50.
[11]何清玉,郭锴,王琳.超重力反应沉淀法制备超细二氧化硅[J].无机盐工业,2005,37(9):26-28.
[12]张继光.催化剂制备过程技术[M].北京:中国石化出版社,2006.

