棉花烟雾吸入性急性肺损伤大鼠模型的建立
韩志海,段蕴铀,姜 毅,王晓阳,方庭正,黄 燕
烟雾吸入性急性肺损伤是指在火灾等烟雾环境下因吸入有毒气体导致呼吸系统发生病理生理改变,如肺泡壁增厚、肺泡腔及肺泡间隔蛋白渗出、炎症细胞聚集、肺水肿,临床表现为呼吸困难、低氧血症、呼吸衰竭,严重者可发生急性呼吸窘迫综合征,病死率高,是呼吸及危重病科治疗中的难题,同时也是战伤研究的热点之一[1-2]。
急性肺损伤的动物模型大多以动脉血氧分压降低和肺组织病理损伤为主要标准。因烟雾吸入性肺损伤多发生于火灾中而易合并烧伤,且两者合并伤的病死率更高,所以国外的动物模型中同时予以烟雾吸入和皮肤的烧伤[3-5]来造模。本实验参考文献[5-7],予以科学改进,成功制作了大鼠棉花烟雾吸入性急性肺损伤模型。
1 材料与方法
1.1 材料 温度可调式钛合金锡炉(富迪牌,HT-B型,功率150 W,内径50 mm,深度30 mm,广东宏泰电子五金工具厂);数显温度计(宏海牌,XMT-280型,北京宏海永昌仪表技术开发中心,量程-50~500℃);集烟筒(自制,内径70 mm、高110 mm圆筒,顶端开口直径12 mm接冷却管,底端敞开,距底端5 mm的侧壁等间隔开直径5 mm的3个孔用于燃烧时吸入空气);冷却管(紫铜管,内径10 mm,壁厚1 mm,长度500 mm,两端设计接口);风扇;棉花(阳光纯棉牌新疆一级长绒棉);电子天平(JD100-3型,沈阳龙腾电子有限公司);分烟管(自制,直径30 mm、壁厚2 mm、长500 mm亚克力管,两端接内径3 mm接头,一侧管壁等距离开2个孔接内径8 mm接头);吸烟瓶(自制,内径62 mm、高180 mm圆形塑料瓶,中央剪开,瓶口开孔接分烟管,瓶身开孔接软管至废气袋);废气袋(自制,80 cm×90 cm×40 cm收纳袋,开口处接内径3 mm接头)。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(嘉美生物技术有限公司),按试剂盒说明进行操作。丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所;二辛可酸(bidnchoninic acid,BCA)蛋白定量试剂盒购自美国Bipec公司;倒置显微镜(日本,Nikon公司);酶标仪、电泳及转膜装置(美国,Bio-Rad公司)。
1.2 实验动物及分组 清洁级健康成年雄性SD大鼠共24只,体质量150~250 g,军事医学科学院实验动物中心[SCXK-(军)-2012-0004]提供,海军总医院实验动物中心[SCXK-(军)-2012-0012]饲养,各组大鼠体质量经统计分析差异无统计学意义。遵守实验动物条例处置动物,按照随机化原则将动物分组,分为对照组及3h、6h、24h组,每组6只。
1.3 烟雾吸入 连接好烟雾吸入装置后,取大鼠2只分别置入吸烟瓶中,锡炉预热至300℃恒温,称取2 g棉花放入锡炉内,立即盖上集烟筒,启动风扇,开始计时2 min,见大鼠足底皮肤逐渐出现樱红色至紫红色,并有躁动、呼吸急促、张口呼吸,至出现呼吸深慢、张口喘鸣时或满2 min时限时,予以停止吸烟;立即敞开吸烟瓶口,吸入空气7 min,可见大鼠呼吸困难表现逐渐好转。3h、6h、24h组重复上述步骤3~5次,至大鼠吸入空气7 min仍旧昏迷不醒时结束。对照组无棉花燃烧过程,重复上述步骤5次(图1)。

图1 大鼠烟雾吸入性肺损伤模型
1.4 血气分析 大鼠在脱离烟雾环境后呼吸室内空气,予以皮下注射生理盐水2 mL,自由活动及饮食。3h、6h、24h 组分别在烟雾吸入3、6、24 h 后给予腹腔注射戊巴比妥钠50 mg/kg麻醉,麻醉生效后腹主动脉取动脉血1.5 mL送检,查血液pH值、动脉血氧分压(partial pressure of oxygen in arterial,PaO2)、二氧化碳分压(pressure of carbon dioxide,PaCO2)等指标。对照组大鼠在模拟烟雾吸入24 h后予以行血气分析。
1.5 支气管肺泡灌洗液ELISA检测 抽取动脉血气后的大鼠放血致死,从大鼠胸正中线开胸后分离并夹闭气管,剥离大血管,完整取出全肺,结扎右主支气管,取长50 mm、22 G硅胶管行气管插管灌注冷无菌生理盐水行左肺灌洗,2 mL注入,回收1.5~1.8 mL,1 500 r/min 4 ℃离心10 min,支气管肺泡灌洗液(bronchoalveolar lavage fluids,BALF)上清液进行ELISA检测。
1.6 肺叶处理 分离右肺各叶,右肺上叶、下叶分别置冷冻管内,液氮冻存;右肺中叶予以4%多聚甲醛溶液浸泡72 h后石蜡包埋,切片行苏木素和伊红染色。
1.7 ELISA法检测BALF、右肺下叶肺组织匀浆中炎症介质及细胞因子水平 取大鼠BALF上清液及右肺下叶肺组织匀浆,采用双抗体夹心BCA-ELISA法检测 BALF 中白介素(Interleukin,IL)-1β、IL-8、右肺下叶匀浆中髓过氧化物酶(myeloperoxide,MPO)。采用比色法检测SD大鼠右肺下叶肺组织匀浆MDA浓度。采用BCA法检测SD大鼠BALF中总蛋白。
1.8 统计学处理 应用SPSS 18.0软件,计量资料的比较采用单因素方差分析,LSD法进行各组间的两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠动脉血气分析结果 各组间PaO2的差异有统计学意义(P<0.001),3h、6h、24h 组大鼠的PaO2均明显低于对照组(P<0.001),尤其是 3h、6h组PaO2低于60 mmHg,此时的吸入氧约为21%,计算氧合指数低于300 mmHg,符合急性肺损伤的血气诊断标准。血液pH值、HCO3-及碳氧血红蛋白(carboxyhemoglobin,HbCO)均在烟雾吸入后立即下降,但24 h后基本恢复正常。而PaCO2差异无统计学意义(表1)。
表1 各组大鼠体质量及血气分析(±s,n=6)
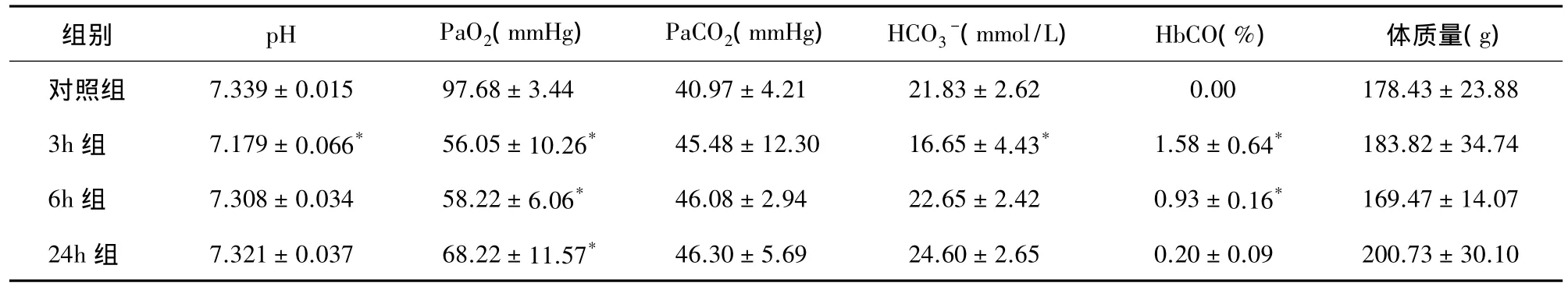
表1 各组大鼠体质量及血气分析(±s,n=6)
注:与对照组比较,*F 值依次为 17.857、30.666、7.018、28.321,*P 均<0.001
组别 pH PaO2(mmHg) PaCO2(mmHg) HCO3-(mmol/L) HbCO(%) 体质量(g)对照组 7.339 ± 0.015 97.68 ± 3.44 40.97 ± 4.21 21.83 ± 2.62 0.00 178.43 ± 23.88 3h 组 7.179 ± 0.066* 56.05 ± 10.26* 45.48 ± 12.30 16.65 ± 4.43* 1.58 ± 0.64* 183.82 ± 34.74 6h 组 7.308 ± 0.034 58.22 ± 6.06* 46.08 ± 2.94 22.65 ± 2.42 0.93 ± 0.16* 169.47 ± 14.07 24h 组 7.321 ± 0.037 68.22 ± 11.57* 46.30 ± 5.69 24.60 ± 2.65 0.20 ± 0.09 200.73 ± 30.10
2.2 大鼠BALF及肺组织匀浆中指标检测 BALF中IL-1β和肺组织匀浆中MPO在3h、6h、24h组均明显高于对照组。BALF中IL-8、总蛋白定量和肺组织匀浆中MDA浓度在6h、24h组明显高于对照组,而3h组较对照组差异无统计学意义(P>0.05),见表2。
表2 各组大鼠BALF及肺组织匀浆中炎症指标检测s,n=6)
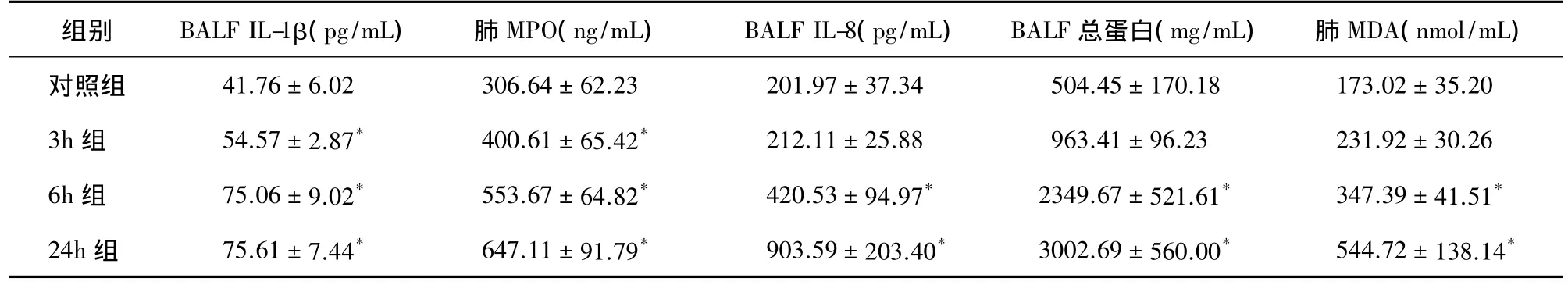
表2 各组大鼠BALF及肺组织匀浆中炎症指标检测s,n=6)
注:与对照组比较,*F 值依次为 36.24、49.38、52.46、28.06、26.82,*P 均<0.05
组别 BALF IL-1β(pg/mL) 肺MPO(ng/mL) BALF IL-8(pg/mL) BALF总蛋白(mg/mL) 肺MDA(nmol/mL)对照组 41.76 ± 6.02 306.64 ± 62.23 201.97 ± 37.34 504.45 ± 170.18 173.02 ± 35.20 3h 组 54.57 ± 2.87* 400.61 ± 65.42* 212.11 ± 25.88 963.41 ± 96.23 231.92 ± 30.26 6h 组 75.06 ± 9.02* 553.67 ± 64.82* 420.53 ± 94.97* 2349.67 ± 521.61* 347.39 ± 41.51*24h 组 75.61 ± 7.44* 647.11 ± 91.79* 903.59 ± 203.40* 3002.69 ± 560.00* 544.72 ± 138.14*
2.3 肺组织大体及病理组织观察
2.3.1 肺组织大体观 对照组大鼠肺组织颜色均匀、淡粉红色,组织质地柔软、弹性好,未见肿胀、出血及坏死;3h组大鼠肺组织轻度肿胀,粉红色为主,可见多处斑片状出血灶;6h组大鼠肺组织见明显充血、水肿,表面大部分弥漫鲜红色至深红色出血,肺叶边缘尚无明显病变;24h组大鼠肺组织极度肿胀,弥漫性充血、出血,肺组织弹性差,肺质量明显增加。见图2。
2.3.2 肺组织病理学观察 对照组大鼠肺泡结构清晰、完整,腔内无渗出,肺泡间隔无肿胀、均匀一致;3h组大鼠肺泡结构稍有破坏,肺泡腔内未见出血和渗出物,血管扩张,肺泡间隔肿胀,炎症细胞浸润;6h组及24h组大鼠肺泡结构弥漫性破坏,腔内可见透明膜及漏出的红细胞,肺泡间隔增厚,炎症细胞浸润明显,24h组较6h组病变更加严重。见图3。
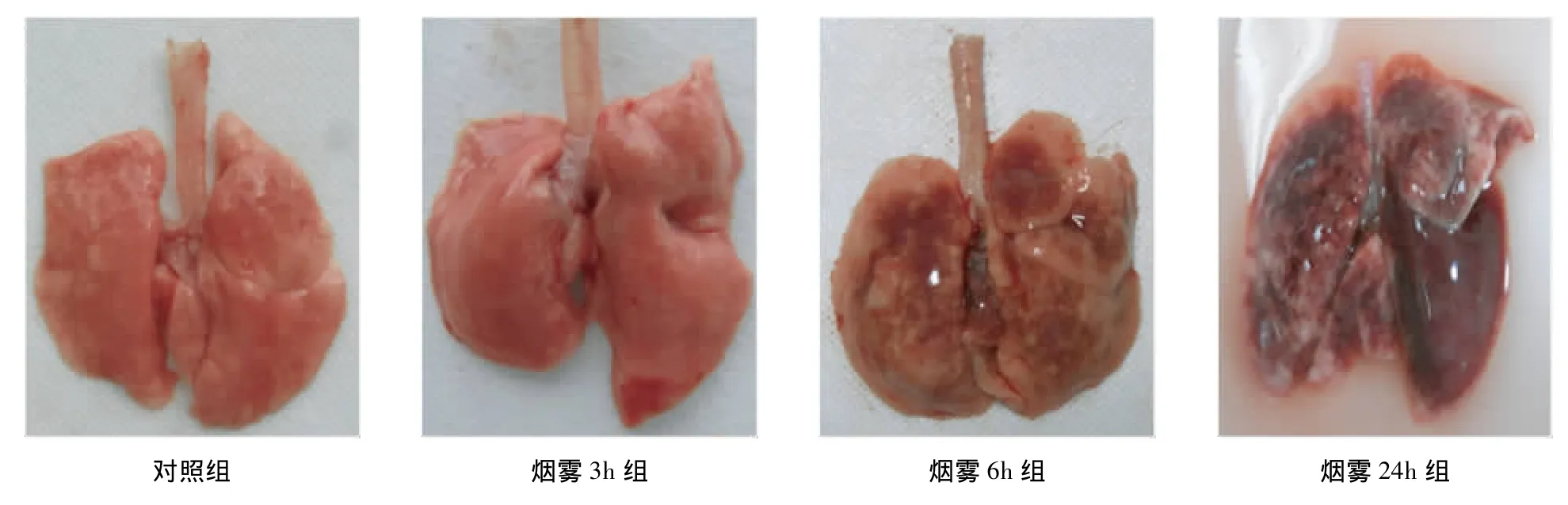
图2 肺组织大体观
3 讨论
烟雾吸入可主要归纳为以下3个致伤因素:一是热量,吸入的干热或湿热空气直接造成呼吸道黏膜、肺实质的损伤,如导致声门水肿可引起窒息[8]。二是缺氧,因缺氧或吸入窒息剂如一氧化碳引起窒息是火灾中常见的死亡原因;三是颗粒和毒性物质,其中直径小于1 μm的颗粒可以到达肺泡腔,引起呼吸道黏膜的直接损伤和广泛的全身中毒反应。烟雾吸入激活了热应激、缺氧应激、氧化应激及基因毒应激这些常见的细胞应激反应,以产生各种细胞因子来对抗和减轻损害、修复损伤,维护内环境的稳定,但在病理情况下细胞应激同样也是造成继发损伤的原因。目前认为,颗粒和毒性物质是导致烟雾吸入性肺损伤病理生理改变的“罪魁祸首”,这些物质与肺实质发生交互反应介导了炎症瀑布反应,导致肺水肿、气道塑型、气道阻塞、缺氧性肺血管收缩功能丧失和通气/血流比例失调。其中氧化应激和炎症反应是烟雾吸入性损伤中的2个关键环节。
烟雾吸入诱发的急性肺损伤研究中有很多动物模型,发烟物质的种类不同导致烟雾成分复杂,如有害气体芥子气的致伤、黑火药燃烧致伤、高分子有机聚合材料燃烧致伤等,其致伤机制也各有侧重,因为热量大部分在声门上被消耗,极少能够抵于声门或抵于隆突而到达肺组织,因此在造模中除去了热量的影响。因烟雾成分的复杂性,本实验选择了常用的棉花燃烧产烟,也部分代表了棉织料的衣服和家纺在火灾中的燃烧产烟。选择棉花作为造模的燃烧物也参考了既往的文献,大鼠吸入棉花燃烧后的烟雾,4 h即可出现肺湿干重比的升高。提示肺水肿,并且肺内中性粒细胞数也比对照组增高,类似人类烟雾性肺损伤中的炎症反应[8]。
在评价肺损伤时本研究选择动脉血氧饱和度、肺组织大体及病理切片观察等直观的指标,实验结果提示在烟雾吸入后3 h即有肺气体交换功能的降低,至24 h仍明显低于正常水平;同时肺组织大体及病理切片在烟雾吸入后3 h即出现损伤性表现,并逐渐加重,至24 h时十分明显,但此时动脉血氧分压对比致伤后3h、6h组有所升高,考虑为动脉血中一氧化碳浓度降低减轻了对氧气的竞争所致。本研究还选择了BALF中的IL-1β、IL-8、总蛋白和肺组织匀浆中MDA、MPO作为肺损伤的评价指标[9-10]。IL-1β为前炎症因子,在损伤早期由单核巨噬细胞释放,能够引起IL-8的释放;后者激活中性粒细胞募集到肺,引发炎症反应和肺损伤,当肺毛细血管-肺泡膜损伤后,血浆中蛋白释放到肺泡腔中,引起BALF中蛋白升高,引起肺水肿及透明膜的形成。MDA是脂质过氧化损伤的产物,其升高为活性氧等自由基损伤细胞的膜结构,提示氧化应激损伤加剧。MPO主要由中性粒细胞释放出来,其升高反映了炎症反应的程度。在本实验中上述指标均明显升高,提示氧化应激和炎症反应的增强,与人类的烟雾吸入性肺损伤表现[11-12]类似,说明本烟雾吸入性肺损伤模型成功建立,可以用于评价不同干预措施对大鼠棉花烟雾吸入性肺损伤的影响。
[1]王敦,冯中明,刘旭盛,等.大鼠烟雾吸入性损伤模型[J].第三军医大学学报,1989,11(5):378-380.
[2]周敏,姚斌,严尚学,等.爆炸及火药燃烧致吸入性肺损伤大鼠实验模型的建立[J].解放军医学杂志,2005,30(8):734-737.
[3]刘一凡,唐红卫,吴小利,等.黑火药烟雾致吸入性肺损伤大鼠模型的建立与评价[J].解放军医学杂志,2013,38(8):670-674.
[4]Belli S,Basaran O,Ozdemir BH,et al.Protective role of simvastatin on lung damage caused by burn and cotton smoke inhalation in rats[J].J Surg Res,2011,167(2):e283-e290.
[5]Huang PS,Tang GJ,Chen CH,et al.Whole-body moderate hypothermia confers protection from wood smoke-induced acute lung injury in rats:the therapeutic window[J].Crit Care Med,2006,34(4):1160-1167.
[6]Lee HM,Greeley GH,Herndon DN,et al.A rat model of smoke inhalation injury:influence of combustion smoke on gene expression in the brain[J].Toxicol Appl Pharmacol,2005,208(3):255-265.
[7]Zou YY,Lu J,Poon DJ,et al.Combustion smoke exposure induces up-regulated expression of vascular endothelial growth factor,aquaporin 4,nitric oxide synthases and vascular permeability in the retina of adult rats[J].Neuroscience,2009,160(3):698-709.
[8]Rehberg S,Maybauer MO,Enkhbaatar P,et al.Pathophysiology,management and treatment of smoke inhalation injury[J].Expert Rev Respir Med,2009,3(3):283-297.
[9]Tsai HH,Lee WR,Wang PH,et al.Propionibacterium acnes-induced iNOS and COX-2 protein expression via ROS-dependent NF-κB and AP-1 activation in macrophages[J].J Dermatol Sci,2013,69(2):122-131.
[10]Hogmalm A,Bäckström E,Bry M,et al.Role of CXC chemokine receptor-2 in a murine model of bronchopolmonary dysplasia[J].Am J Respir Cell Mol,2012,47(6):746-758.
[11]Grores AM,Gow AJ,Massa CB,et al.Prolonged injury and altered lung function after ozone inhalation in mice with chronic lung inflammation[J].Am J Respir Cell Mol Biol,2012,47(6):776-783.
[12]Yang S,Shen L,Jin Y,et al.Effect of Dachengqi decoction on NF-kappaB p65 expression in lung of rats with partial intestinal obstruction and the underlying mechanism[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(2):217-221.

