纳米颗粒杂化膜材料的分散、表征方法
成 坚王 铭,2樊利民
(1.杭州水处理技术研究开发中心有限公司,杭州 310012;2.浙江省海水淡化技术研究重点实验室:杭州 310012;3.巨化集团技术中心,浙江 衢州 324004)
纳米颗粒杂化膜材料是分散相至少有一维尺寸1~100 nm的复合材料。即分散相在连续相中达到纳米尺度的分散。20世纪80年代初由Rustun Roy提出[1]。分散相可以是无机粒子、纤维、纳米碳管等,连续相可以是金属材料、高分子聚合物材料等。由于纳米粒子具有纳米尺度效应、宏观量子效应、大的比表面积以及强的界面相互作用,在非复合型普通材料中分散纳米粒子后,将使其母体材料物性发生改变,并展现出许多特殊的性能,如光催化、渗透性能、材料力学/机械性能、热稳定性能等。
纳米复合材料在汽车工业、生物技术等各个领域被广泛的研究和应用。本文就纳米颗粒在成膜溶液中的分散控制技术及其相关主要分析测定方法、对纳米颗粒杂化膜材料在膜分离过程中的应用和其主要研究方法等进行评述。
1 纳米颗粒杂化膜材料性能影响因素
虽然随着纳米颗粒合成相关技术的发展,在使用含量相对较低的胶体分散体或粉末状态的医药品、化妆品、染料等领域的产业化得到了长足的发展,但在利用纳米颗粒作为原材料时,微粒子的凝集、分散行为的控制,即对粒子直径在100 nm以下的纳米颗粒的安定分散化控制十分的困难。
由于纳米颗粒在不同性质的无机或有机溶剂中,显现不同的分散、团聚能力以及异常的吸附能力,而一般来说,纳米颗粒在连续相中的分散状态又很大程度上依存于纳米颗粒的浓度、溶剂的种类、分散剂的种类和含量等,因此在纳米复合材料制备过程中如何有效地防止纳米颗粒在应用过程中的团聚,进而保持纳米颗粒在不同的母体聚合物或无机物中的分散性能和均匀程度以及其纳米尺寸,对新型纳米颗粒杂化膜材料的合成和制备研究有着非常重要的意义,也是纳米颗粒杂化膜材料性能研究的前提和基础。
2 研究纳米颗粒分散性的内容和方法
纳米颗粒的形状、颗粒群的平均粒径、粒径分布、颗粒表面特性等是影响其分散性和以其所制备的纳米颗粒杂化膜材料性能的重要因素。
2.1 纳米颗粒的形状
纳米颗粒从形状上大致可以分为表1所示的7大类[2]。
对于理想球形颗粒,颗粒尺寸即为其直径;对于不规则颗粒,尺寸的定位为等当直径,如体积等当直径、投影面积直径等。颗粒的各种大小的量纲一组合称为形状指数,如颗粒的扁平度(短径/厚度)和伸长度(长径/短径)。测得颗粒各种大小和颗粒的体积或面积之间的关系称为形状系数,如无孔隙理想球形颗粒的表面积形状系数为π,体积形状系数为π/6。除此之外,也可以用球形度等来评价颗粒的形状。

表1 纳米颗粒的形状分类Tab 1 Shape classification of nanoparticles
2.2 平均粒径和粒径分布及其表征方法
纳米颗粒群的平均粒径,比较常用的计算方法有算术平均粒径、几何平均粒径等。
2.2.1 计算
1)算术平均粒径:
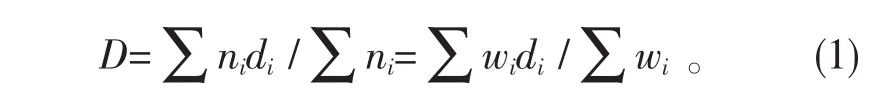
式中,di为第 i颗粒的粒径(di-1~di),ni为颗粒数,wi为第i颗粒的质量分数。
2)几何平均粒径:

此外,还有等效体积径(体积球),等效沉速径(stokes径),等效投影面积径(Feret径)等数种颗粒径评价方法。纳米颗粒群的粒径分布通常是指某一粒径或某一粒径范围的颗粒在整个粉体中占的比例。根据颗粒群粒径分布的均一度分为单分散和多分散。
2.2.2 表征
1)SEM/TEM直接观察法
通常人工合成的纳米颗粒是二次颗粒。即为一次颗粒通过表面力等作用形成的更大的二次颗粒。按照一次颗粒间的结合类型,可分为硬团聚和软团聚。对于由静电力或范德华力等弱分子间力形成的二次颗粒,可以采用机械方法等使其达到分散状态后,制成纳米粉体观测试样[3]。参见图1。

图1 纳米颗粒的存在形态Fig 1 Existing forms of nanoparticles
通过扫描电子显微镜(SEM)或透射电子显微镜(TEM)等设备对纳米颗粒进行直接观察,应用统计的方法或通过计算机图像处理技术等对纳米颗粒尺寸进行评估。此测试方法较为直观,与实际颗粒度较为吻合,也可以直接观测到纳米颗粒间是否发生团聚。但因采用机械分散法时,在强剪切力作用下纳米颗粒解团,颗粒间的吸引力仍在存在,解团后又重新发生团聚,所以分散效果不是十分理想,粉体颗粒中仍然存在一次颗粒的团聚体,影响颗粒尺寸的评估值。并且由于观测试样并不足以代表整个试样,因此缺乏统计性。
2)比表面积法
如图2所示样品A和B。

图2 团聚状态的颗粒Fig 2 Agglomeration of particles
作为一次颗粒粒径来说,样品B比样品A要小。但处于部分团聚状态的二次颗粒粒径样品B比样品A要大。因此对一次颗粒粒径需要一个客观的评价方法。基于气体吸附法的比表面积测定,便是其中之一。假定颗粒为球形的最简单模型,在比表面积Sw和颗粒直径d之间满足

式中,ρ为密度。
在某些理想情况下,可以通过测定比表面积,通过式(3)来求得颗粒直径。纳米颗粒的比表面积测量方法常用为BET多层气体吸附法,其计算方法:

式中,p和p0分别为吸附平衡状态时吸附气体的分压和吸附气体的蒸汽压,V为被吸附气体的体积,Vm为单分子层吸附气体的体积,A=(k-1)/(kVm),B=1/(kVm),Vm=1/(A+B)。
通过不同压强下,气体吸附量的对应关系可求得系数A和B,进一步得到Vm。结合吸附质分子的截面积即可计算出吸附剂纳米颗粒的表面积S:

式中,V0为气体的摩尔体积,N0为阿伏伽德罗数(6.023×1023mol-1)。
实际上的颗粒并非球形,大多数都具有十分复杂的表面构造,因此式(3)并非完全适用。但纳米颗粒与较大的颗粒表面构造相比大多较为简单,严格意义上说即使式(3)不适用,比表面积和颗粒粒径直接也存在一定的相关性。
3)动态光散色测定法
SEM/TEM直接观察法和比表面积法主要是用来评估其本身或在连续相(固相)中纳米颗粒尺寸的测定方法,其基本原理如图3所示。

图3 动态光散色测定法基本原理Fig 3 The fundamental of dynamic light scattering measurement
动态光散色测定法是一种主要用于测定评估在连续相(溶媒)中的纳米颗粒群尺寸的方法。分散在溶媒中的纳米颗粒,由于溶媒分子的热运动而作布朗运动。当激光照射到这一体系时,作布朗运动的纳米颗粒而导致光发生散色,散色光之间产生干涉现象。光散色强度浮动的持续时间在微秒~毫秒级。纳米颗粒较小时,布朗运动较大,散色光的强度随时间变化发生很大的变动。而当纳米颗粒较大时,布朗运动较小,光散色强度的变化也相应较小。通过多点测定由于扩散的纳米颗粒类型的改变而产生的光散色强度的随机浮动的自己相关函数可以求得光散色强度浮动的时间尺度,即减衰时间:
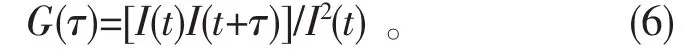
式中,G(τ)为自己相关函数,τ为延迟时间,I(t)和I(t+τ)分别为τ和t+τ时间后检出的光散乱强度。纳米颗粒群分布为单分散时,光散色强度的自己相关函数为单一减衰指数曲线:

多分散时,为各颗粒径的减衰指数曲线之和:

式中,Γ为减衰定数。
通过颗粒的减衰定数,扩散系数和流体力学半径的关系可以计算出纳米颗粒的粒径:

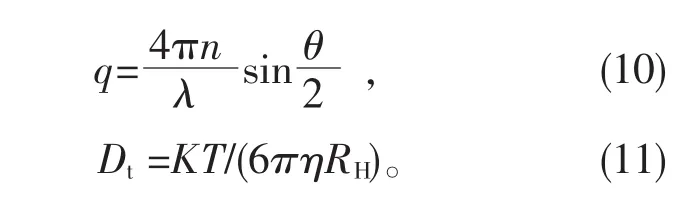
式中,Dt为并进扩散系数,q为散色矢量,n为溶媒的折射率,λ为散色光波长,K为波尔兹曼定数,T为样品的绝对温度,η为溶媒的粘度,RH为颗粒的流体力学半径。
另外,为了抽出通过间接测定散色光强度浮动的自己相关函数所求得的颗粒粒径分布,扩散系数分布等量值需要非常详细的数学解析。除了上述几种表征纳米颗粒的测定方法外,如N Fukuhara等人用 SMPS(Scanning Mobility Particle Sizer)法来测定大气环境中的纳米颗粒粒径分布[4],还有颗粒沉降法、X射线衍射仪(XRD)等,这些方法为纳米颗粒在浓厚分散溶液、气相、固相中的颗粒粒径分布等的测定提供了便利。另外不同的测试方法,往往得到不同的结果,因此在实际测试应用过程中,也需要对测试仪器以及测试方法进行选择和优化。
2.3 表面电双层结构及其表征方法
大多数分散在溶液中的纳米颗粒表面由于自身解离,如—COOH基团,晶格取代或晶格缺失,如粘土或矿物等,吸附作用,如吸附溶液中的H+,OH-等,而带有正或负离子。颗粒表面为了维持其电中性,会吸引其反离子。反离子群在颗粒表面散布聚集,形成由带电颗粒表层和其相反离子固定层,以及外围扩散层组成的扩散双电层构造(Diffused electric double layer),见图 4。

图4 双电层结构Fig 4 The structure of double electrode layer
反离子群分布受到热运动的影响,表面近端含量较高,随远离表面端距离的增加,反离子含量呈梯度减小。远离表面端足够远时,反离子所带电荷与该领域的正离子所带电荷互相抵消,保持电中性。溶液中纳米颗粒表面带电状态是决定其分散状态的安定性的重要因素。为了对表面带电状态进行量化和测定,引入ζ电位,也作为颗粒分散安定性评估的指标。由于扩散层完全剥离,裸露的颗粒带电状态无法直接测定,而随颗粒一起移动的电荷对颗粒在溶液中的分散行为又有着显著的影响。因此,实际上测定的颗粒表面ζ电位是颗粒最表层与扩散层内侧之间的滑动面的电位。随着ζ电位绝对值的增加,颗粒间的静电斥力变大,颗粒分散稳定性提高。反之,ζ电位绝对值趋向于0时,颗粒间发生团聚。
激光多普勒测定法是测定颗粒在溶液中表面电位的常用方法。其原理是基于激光照射到颗粒后产生的散色光的频率变化正比于物体运动速度的多普勒效应(Doppler effect)。通过测定颗粒泳动速度求得颗粒表面ζ电位。
颗粒泳动速度u和多普勒变化量Δv之间:
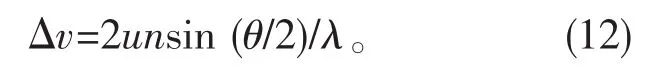
式中,n为溶媒的折射率,θ为检出角度。
u和电荷移动度(electron mobility)U之间:

式中,E为电场强度。
电荷移动度和ζ电位之间,满足Smoluchowski式:

式中,η为溶媒的粘度,ε为溶媒的介电常数。
而在实际测试过程中,为排除测试元件表面带电所引起的电渗透(electron osmosis)现象的影响,需要对测试元件内多点进行测定,解析出其静止面(图5中的虚线所示),得到颗粒表面真实的电荷移动度,求得颗粒表面ζ电位。
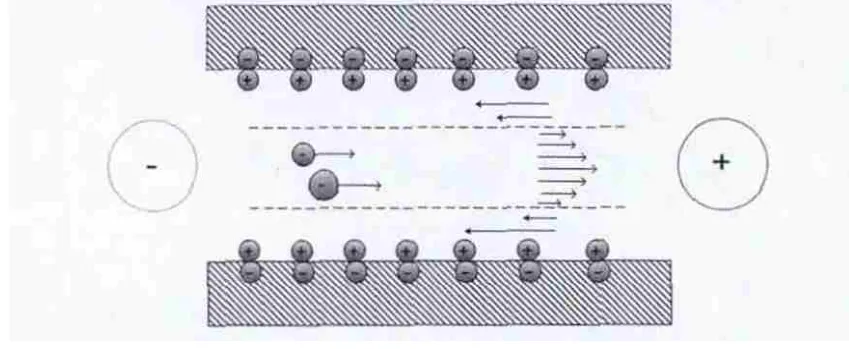
图5 溶液中颗粒表面ζ电位测试Fig 5 ζ potentiometric determination on particle surface in the solution
3 纳米颗粒在(成膜)溶液中的分散方法
颗粒粒径接近纳米级时,表现出与次微米级颗粒不同的粒子表面特性、相互作用等。在团聚分散特性上出现异常的举动行为。如H Kamiya等人用Sol-Gel法制备SiO2纳米颗粒的粒径接近数纳米时,颗粒表面因吸附的溶媒水分子所产生的水合斥力消失[5]。颗粒接近数纳米级后,即使在相同的表面电位时,由颗粒表面静电斥力引起的化学势也会变小,导致颗粒分散安定化失衡,发生团聚。根据Woodcock的提案式[6]:

式中,h为颗粒表面间距离,dp为颗粒径,φ为颗粒体积分数。
近似计算得颗粒表面间距离与粒径、粒子含量的关系:粒子径为次微米级时,颗粒体积分数达到50%~60%时,颗粒间平均表面距离才会达到数纳米级。而颗粒径为20 nm时,颗粒体积分数20%~30%,平均表面距离已经达到数纳米。一般来说,次微米级颗粒表面化学势在波尔兹曼定数与绝对温度乘积的10~20倍以上,可以完全分散。粒径为20 nm的颗粒,则需要数百毫伏以上的高表面电位才可以达到完全分散状态。而通常的方法,无法得到如此高的表面电位,因此需要了解纳米颗粒在不同分散相中的表面特征,对颗粒表面进行粉碎加工,表面修饰改性等分散处理,达到所期待的纳米级分散效果。
目前主要的几种纳米颗粒分散处理方法有超声波分散法和化学分散法。
3.1 超声波分散法
超声波分散法是用来粉碎、分散处理纳米颗粒的比较常见的方法。当超声波传播到溶液中时,会产生高压区和低压区。当超过其溶媒分子间力到达低压状态时,形成空洞。形成的空洞经过如图6所示的膨胀和收缩的反复过程后崩坏破裂时,会在微米领域内达到具有微秒级寿命的高温、高压、高速流动的极限状态。也是超声波对纳米颗粒粉碎分散作用的主要驱动力。

图6 超声波的空化作用Fig 6 Ultrasonic cavitation
空洞内存在水分子、残存气体分子,挥发性化合物在高温、高压环境下热分解,如水分子:

空洞附近的低蒸汽压有机化合物被产生的·OH自由基氧化分解,具有捕捉自由基能力的纳米颗粒(如金刚石纳米颗粒)其在被粉碎分散化的同时,亲水化能力也有显著提升。随着超声波设备性能和稳定性的提升以及成本降低,其在纳米颗粒分散处理,大分子有机物分解等领域被广泛应用。
3.2 化学分散法
使用超声波分散法、机械分散法等物理分散方法时,在强剪切力作用下纳米颗粒解团的同时,颗粒间的吸引力仍存在,或因为新的颗粒表面的产生,而具有更大的表面能,导致解团后又重新发生团聚。也因为在粉碎细化过程中,团聚和解团趋于平衡,所以颗粒无法较好的维持其纳米级分散效果。而采用化学分散法,在溶液中加入界面活性剂使其在纳米颗粒表面吸附或采用可以分裂形成自由基的低、高分子聚合物,使其在纳米颗粒表面接枝等,改变颗粒间的相互作用,提高颗粒间的排斥力,防止其发生团聚,较好地保持其稳定的纳米级分散效果。因此在纳米颗粒分散应用中,超声波通常被用于粉碎细化纳米颗粒,界面活性剂分子则用于维持其相对较长的纳米分散效果。
3.2.1 界面活性剂颗粒表面改性
界面活性剂由亲水基(hydrophilic group)和亲油基(hydrophobic group)2部分组成。如脂肪酸盐的亲油基是碳氢长链,亲水基是羧基,见图7。根据亲水基端的离子基团类型分为阴离子、阳离子、两性、非极性界面活性剂等。

图7 界面活性剂构造Fig 7 The structure of surfactants
水溶液中界面活性剂的行为如图8所示。
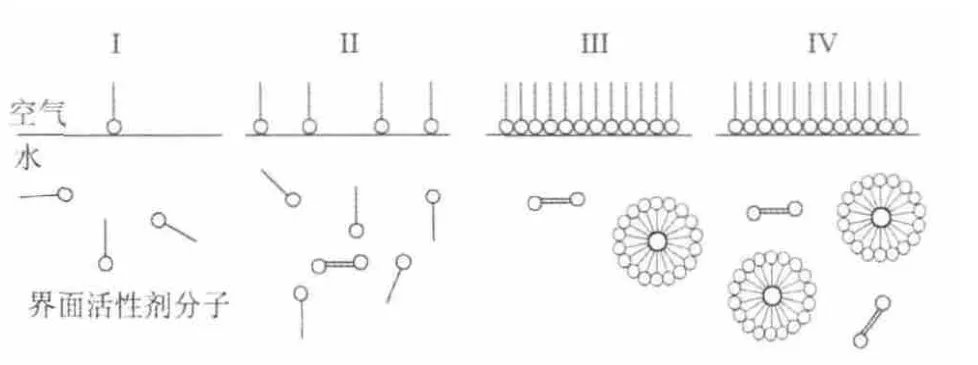
图8 水溶液中界面活性剂的行为Fig 8 The behavior of surfactants in solution
I、II阶段,界面活性剂分子含量低时,在空气和水溶液界面形成单分子膜,而水溶液中不安定界面活性剂分子逐渐增多。III、IV阶段,随着界面活性剂分子含量增大,水溶液中形成活性剂分子集合体,当到达临界胶团浓度(CMC)时,溶液中形成由界面活性剂分子组成的胶团,溶液的性质发生很大的改变。界面活性加入量继续增大,则会形成棒状、层状、球状等结构。CMC点也是界面活性剂发挥其性能的最低必要浓度的指标。随着界面活性剂的加入,界面张力随之降低,在到达CMC点后,界面张力几乎不再发生变化。
在使用界面活性剂分散处理纳米颗粒时,受到溶液的温度、界面活性剂的分子结构类型、分子链长、亲水/亲油的程度(HLB)、溶解度等诸多因素的影响,也是影响纳米颗粒在溶液中稳定性的重要因素。如离子型界面活性剂形成胶团时,其离子间斥力的影响,一般比非离子型界面活性剂的能力弱,CMC值较大。如较为常用的十二烷基磺酸钠在水中的CMC为8.2 mmol/L,而C12H25O(CH2CH2O)12H在水中的CMC仅为0.09 mmol/L。
图9为水溶液和油溶液中界面活性剂在纳米颗粒周围吸附形成单个胶团的结构。

图9 溶液中的界面活性剂胶团结构Fig 9 The structure of surfactant micelle in solution
界面活性剂的亲油基从水溶液中逃逸趋势,是形成胶团的主要驱动力。在水溶液中,颗粒四周界面活性剂分子形成亲油基朝内,亲水基朝外减小界面自由能的定向排布,而在油溶液中,则形成亲油基朝外,亲水基朝内的反定向排布。在纳米颗粒周围的吸附可以分为由范德华力引起的物理吸附和颗粒表面基团之间形成共有结合等的化学吸附。如硅烷偶联剂用于纳米颗粒表面改性时,硅烷偶联剂在纳米颗粒表面的吸附类型就属于化学吸附。
在非吸附性高分子溶液中,由于高分子链的存在对纳米颗粒的布朗运动有一定限制作用,因而一定程度上可以抑制纳米颗粒发生团聚。但由于溶液渗透压的作用,所以高分子在颗粒间逐渐难以存在,纳米颗粒间会产生弱团聚,分散稳定性较差。参见图10。
定向吸附于纳米颗粒周围的界面活性剂分子在溶液中的伸展而引起的空间位阻,界面活性剂分子链段中带有离子基团时,其在溶液中解离后所产生离子基团间的静电斥力和纳米颗粒周围的电双层效应等的共同作用是保持纳米颗粒良好纳米级分散性能的决定性因素,也是界面活性剂用于分散处理纳米颗粒时必须要考虑到的问题。参见图11。

图10 在非吸附性高分子中的颗粒状态Fig 10 Nanoparticle morphology in non-adsorptive polymer

图11 界面活性剂对纳米颗粒的分散作用Fig 11 Effect of surfactants on the dispersion of nanoparticles
如竹原淳彦等人对典型的阴离子界面活性剂C12H25OSO3Na(SLS)和非离子型界面活性剂C15H25(OC2H4)nOH(POELE)在 α-Al2O3颗粒表面的吸·脱附行为进行了研究[7]。结果表明,根据2者的吸附形态的不同,以—OSO3—单点静电相互作用为主的SLS的吸附亲和力要好于以—(OC2H4)n—氢键作用为主的POELE。
3.2.2 自由基捕捉颗粒表面改性
对于表面具有自由基捕捉活性能的纳米颗粒,如二氧化硅、金刚石、C60、CNT等,可以利用其表面的自由基捕捉效应,直接接枝低、高相对分子质量聚合体,或通过表面自由基活性聚合法控制其表面接枝聚合物链段长度,提高其在溶液中的分散性能,改善纳米颗粒与母体材料界面亲和性。
4 结束语
对纳米颗粒的几个基本属性,以及其在(成膜)溶液中的分散处理的研究内容和方法进行了介绍和阐述。随着纳米颗粒制备工艺的优化,纳米颗粒的颗粒度、纯度和结构性能得到大幅度地提升,使得其制备而得的纳米颗粒杂化膜材料的性能有着突飞猛进的提高。
作为纳米颗粒杂化膜材料的研究以及其应用的基础和前提,纳米颗粒在溶液中的分散性研究必不可少。随着世界能源短缺,水资源短缺,对膜分离技术以及膜分离材料的研究工作也提出了更高的要求,如低能耗比、高选择分离性、高产水通量、高抗污染性能等。在当今国内外水处理、液体分离膜技术基础研究以及应用研究中,有效结合无机纳米颗粒的特性和高分子聚合物材料韧性的纳米材料复合膜是一个热点。
[1]Roy R,Kpmameni S,Roy D M.Cation2ex-change properties of hydrated cements[J].Master Res Soc Symp,1984,32(2):347-351.
[2]高濂,孙静,刘阳桥.纳米粉体的分散及表面改性[J].炭黑工业,2005(4):35.
[3]Hamaker H C.London-der Waals attraction between spbericles spherical[J].Physica,1997,12(4):26-28.
[4]N Fukuhara,K Suzuki,K Takeda,et al.Characterization of encironmental Nanoparticles[J].Appl Surf Sci,2008,255(3):75-79.
[5]H Kamiya,M Mitsui,H Takano,et al.Influence of Particle Diameter on Surface Silanol Structure,Hydration Forces,and Aggregation Behavior of Alkoxide-Derived Silica Particles[J].J Am Ceram Soc,2000,83(2):287-293.
[6]L V Woodcock.Proceeding of a workshop held at Zentrum fur interdisziplinare Forschung University Bielefield[C].Dorfmuller and G Williams,1985:11-13.
[7]竹原淳彦,福崎智司.氧化铝表面的界面活性剂吸/脱附行为[R].冈山县工业技术中心:33号,2007,46-48.

