重症急性胰腺炎大鼠胃窦肌间血管活性肠肽神经元的变化
张 诚,林 中,袁 园,段泽辉
0 引 言
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见的急腹症之一[1],病死率高达15%~20%[2]。SAP时常见胃肠动力的下降,发生胃肠动力障碍,甚至出现胃肠功能衰竭。SAP伴胃肠动力障碍的发生机制十分复杂,仍未能阐明,有待研究及探讨,目前认为可能与神经因素、胃肠激素、肠道细菌、缺血再灌注损伤、炎症介质、Cajal间质细胞等有关。神经因素中肠神经系统(enteric nervous system,ENS)起主要作用。ENS调控运动的神经元包括兴奋性神经元和抑制性神经元。血管活性肠肽(vasoactineintrestinalpeptide,VIP)为重要的 ENS抑制性神经元。许多胃肠动力障碍疾病常伴随着ENS的改变。本研究通过制造大鼠SAP模型,观察胃窦肌间神经丛的VIP阳性神经元数目的变化,以探讨其与SAP伴胃肠动力障碍的关系。
1 材料与方法
1.1 材料 健康雌性SD大鼠20只,体重200~220 g,由桂林医学院动物实验中心提供,实验动物合格证号:SYXK桂2003-001。按随机列表法分为假手术组和SAP模型组,每组10只。大鼠分笼饲养于20~22℃室温下,相对湿度为45%~55%,自由饮食进水,每日光照明暗交替12 h。Anti Human Neuronal Protein HuC/HuD(anti-HuC/HuD,Molecular Probes公司);VIP(H-95)兔抗大鼠多克隆抗体(Santa Cruz公司);正常山羊封闭血清、FITC标记山羊抗小鼠IgG(H+L)、TRITC标记山羊抗兔 IgG(H+L)(北京中杉金桥生物技术有限公司);牛磺胆酸钠(Sigma公司);酚红糊剂(4 g/L酚红水溶液按15 mL/g面粉的比例加热调成糊剂,天津科密欧化学试剂开发中心);氢氧化钠、氢氧化钡、硫酸锌(广东汕头西陇化工有限公司);CRP ELISA检测试剂盒(美国R&D公司)。体视显微镜(日本奥林巴斯公司);倒置荧光相差显微镜(日本奥林巴斯公司);紫外分光光度计(日本岛津公司)。
1.2 方法
1.2.1 建立动物模型 大鼠术前24 h禁食,自由饮水,乙醚麻醉大鼠,假手术组开腹后,翻动十二指肠及胰腺3次,关腹。SAP模型组开腹后,辨认胰胆管走向及其在十二指肠的开口处,用针头在胰胆管十二指肠开口处的对侧肠壁一无血管区穿孔,用磨顿的头皮针从肠壁穿孔处逆行滑行探入胰胆管,动脉夹夹闭胰胆管近肠壁端和近肝门端,头皮针接微量泵泵入0.5 g/L牛黄胆酸钠水溶液(1 mL/kg,0.1 mL/min)4~6 min,停止泵入后维持夹闭6~8 min,松开动脉夹、拔除针头,回复肠段,关腹。假手术组和SAP模型组均皮下注射10 mL等渗盐水。
1.2.2 检测胃排空率、血清淀粉酶、C-反应蛋白(C-reactionprotein,CRP) 大鼠造模后禁食禁水24 h后,灌入酚红糊剂(1 mL/100 g),20 min后水合氯醛麻醉大鼠,下腔静脉取血8 mL。以胃酚红残留率为指标评价胃排空率,人工碘比色法检测血清淀粉酶,检测CRP严格按照试剂盒操作。
1.2.3 胰腺HE染色 取胰头部胰腺,置于体积分数为4%的甲醛中固定24 h后,制成HE标本。胰腺病理评分参照Schmidt法[1],按组织水肿、炎性细胞浸润、出血程度、胰腺坏死程度共4个参数评分,得分相加计算其总分值。
1.2.4 制作胃窦肌间神经丛标本 用Kreb液将胃清洗干净后,放于 Zamboni's固定液中伸展固定24 h;PBS磷酸盐溶液清洗后,将胃窦部浆膜面朝上放于玻璃皿中,体视显微镜下用显微镊将浆膜层和肌层一同撕下,将浆膜面朝下,剥除其上附着的环形肌,剪成0.4cm×0.8cm大小,即制成胃窦肌间神经丛标本。
1.2.5 双重免疫荧光染色与结果判断 ①染色方法:在室温22℃下,将胃窦肌间神经丛标本放入体积分数为10%的正常山羊封闭血清和体积分数为0.5%的TritonX-100的PBS中孵育45 min;4℃环境中,用小鼠来源的anti-HuC/HuD(10 μg/mL)和兔来源的VIP抗体(1∶100)分别孵育24 h;室温22℃下,用 FITC标记的山羊抗小鼠IgG(1∶100)和TRITC标记的山羊抗兔IgG(1∶400)分别孵育45 min;甘油封片。孵育时,标本保持湿润,以上每道程序后均用PBS漂洗3次,每次10 min。②结果判断:用 anti-HuC/HuD作为一抗,FITC标记的绿色荧光抗体作为二抗,显示所有胃窦肌间神经丛细胞;用VIP抗体作为一抗,TRITC标记的红色荧光抗体作为二抗,显示VIP阳性神经元。用荧光显微镜观察标本,计算胃窦肌间神经丛细胞数和VIP阳性神经元细胞数,每个样本至少观察200个胃窦肌间神经丛细胞数。VIP阳性神经元表达率计算公式:
神经元表达率(%)=VIP阳性神经元细胞数/胃窦肌间神经丛细胞数×100%
1.3 统计学分析 采用SPSS 20.0软件进行统计分析,胰腺病理评分、血清淀粉酶、CRP及胃排空率的比较用两独立样本t检验,VIP阳性神经元表达的比较用Mann-Whintney非参数检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 一般情况 造模24h后,假手术组大鼠无死亡,一般情况良好,活动及反应正常,开腹后未见腹水、钙化灶、胰腺病灶及胃潴留等胰腺炎相关表现。SAP模型组大鼠2只死亡,生存率为80%,存活大鼠精神萎靡,活动及反应迟缓,开腹后可见血性腹水、钙化灶、胰腺出血坏死灶及胃肠道扩张等表现。
2.2 胰腺组织病理评分、血清淀粉酶、CRP及胃排空率的比较 光镜下,假手术组胰腺组织仅见少量出血水肿,小叶结构正常,无胰腺坏死灶区。SAP模型组小叶结构紊乱,叶间隙增宽,可见大片状坏死、大量出血和炎细胞浸润。SAP模型组胰腺病理评分、血清淀粉酶、CRP高于假手术组,差异有统计学意义(P<0.05);而胃排空率低于假手术组,差异有统计学意义(P<0.01)。见图1,表1。
2.3 VIP阳性神经元表达的比较 胃窦肌间神经丛细胞呈多态性,细胞核和细胞质均染色,神经纤维不着色。VIP阳性神经元细胞质染色,而细胞核不染色,神经纤维着色呈串珠状,连接于神经节之间。见图2。
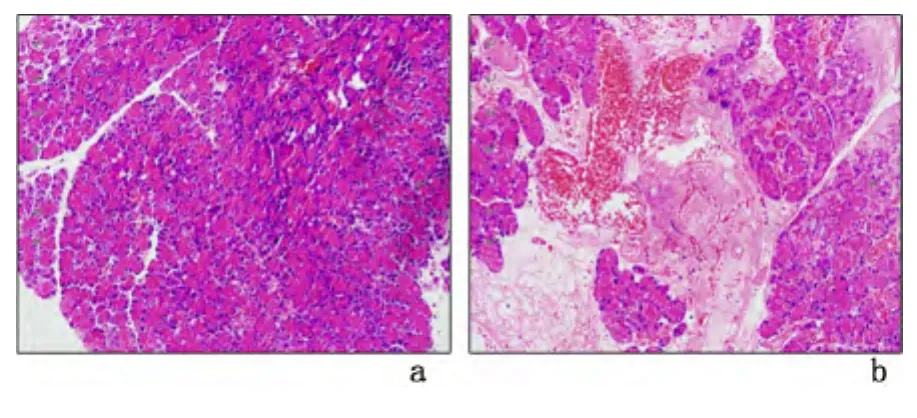
图1 大鼠胰腺病理改变(HE×200)Figure 1 The pathological lesion of the pancreas(HE×200)
表1 大鼠胰腺病理评分、血清淀粉酶、CRP、胃排空率及VIP阳性神经元表达的比较()Table 1 The comparison of the score of pancreatic lesion,amylase,CRP,gastric emptying rate and the percentage of VIP neurons()

表1 大鼠胰腺病理评分、血清淀粉酶、CRP、胃排空率及VIP阳性神经元表达的比较()Table 1 The comparison of the score of pancreatic lesion,amylase,CRP,gastric emptying rate and the percentage of VIP neurons()
与假手术组比较,*P ﹤0.05、**P ﹤0.01
组别 n 胰腺病理评分(分) 血清淀粉酶(U/L) CRP(μg/mL) 胃排空率(%)VIP阳性神经元的表达率(%)假手术组 10 1.60 ±0.52 360.20 ±30.29 35.71 ±6.43 70.99 ±1.82 10.72 ±1.92 SAP 模型组 8 14.63 ±1.06* 2061.25 ±434.86** 140.10 ±17.07* 31.49 ±3.96** 22.45 ±4.10**

图2 大鼠胃窦肌间VIP阳性神经元的表达(双重免疫荧光法 ×200)Figure 2 The immunofluorescence results of VIP positive neurons in gastric antrum myenteric ganglia(double-immunofluorescent staining×200)
3 讨 论
VIP阳性神经元是来自肠神经系统的重要抑制性神经元[4],分泌 VIP 使胃肠道平滑肌舒张[5]。VIP是由28个氨基酸组成的一种直链结构小分子神经多肽[6],主要有胃肠激素功能[7]、神经肽功能[8]和免疫调节功能[9]。VIP广泛分布于肠道和神经系统,在结肠的含量最高,以神经递质的方式发挥作用[10]。VIP通过 cAMP依赖的蛋白激酶途径和NO相关性途径来介导胃肠平滑肌的运动,引起胃排空减慢、参与结肠的节段非推进性运动和维持胃肠道规律的蠕动调节等作用[11-12]。研究表明SAP时VIP能通过影响胃肠道平滑肌电活动而导致胃肠动力障碍[13]。本研究组曾在大鼠小肠肌间神经丛神经元和结肠平滑肌细胞体外共同培养实验中发现VIP阳性神经元在体外培养时发生了重塑[14],亦发现SAP伴胃肠动力障碍时结肠黏膜下VIP阳性神经元有变化[15]。胃为胃肠道的重要器官,是胃肠蠕动的重要部位。本研究以胃窦部为研究对象,旨在探讨胃肠动力障碍时胃的变化;以血清淀粉酶、CRP、胰腺病理评分作为衡量造模成功与否和胰腺炎严重程度的标准;以胃排空率来判断大鼠是否存在胃肠功能减弱;以双重免疫荧光法测定VIP阳性神经元的表达,实验技术成熟,结果直观可靠。SAP伴胃肠动力障碍大鼠ENS中胃窦肌间神经节VIP阳性神经元发生了重塑,VIP阳性神经元的重塑与SAP伴胃肠动力障碍的神经机制有关。
[1]叶 欣,赵洪川.急性胰腺炎合并全身炎症反应综合征的危险因素分析[J].医学研究生学报,2012,25(3):274-278.
[2]王 彬,张晓华.细胞因子在重症急性胰腺炎合并急性肺损伤中的作用[J].医学研究生学报,2012,25(11):1208-1212.
[3]Rongione AJ,Kusske AM,Kwan K,et al.Interleukin 10 reduces the severity of acute pancreatitis in rats[J].Gastroenterology,1997,112(3):960-967.
[4]Rudholm T,Wallin B,Theodorsson E,et al.Release of regulatory gut peptides somatostatin,neurotensin and vasoactive intestinal peptide by acid and hyperosmolal solutions in the intestine in conscious rats[J].Regul Pept,2009,152(1-3):8-12.
[5]李云峰,刘俊峰.血管活性肠肽介导人食管下括约肌舒张的实验研究[J].中国胸心血管外科临床杂志,2012,19(6):654-658.
[6]Huang L,Tang Y,Qin J,et al.Vasoactive intestinal peptide enhances TNF-α-induced IL-6 and IL-8 synthesis in human proximal renal tubular epithelial cells by NF-κB-dependent mechanism[J].Inflammation,2012,35(3):1154-1160.
[7]刘龙飞,肖 帅,龙建武,等.生大黄对SAP患者血胃动素和血管活性肠肽影响的研究[J].中国现代医学杂志,2013,23(13):84-87.
[8]Delgado M,Ganea D.Vasoactive intestinal peptide:a neuropeptide with pleiotropic immune functions[J].Amino Acids,2013,45(1):25-39.
[9]Voedisch S,Rochlitzer S,Veres TZ,et al.Neuropeptides control the dynamic behavior of airway mucosal dendritic cells[J].PloS One,2012,7(9):e45951.
[10]杨凤江,钟敦璟,俞 杨,等.溃疡性结肠炎患者血清P物质、血管活性肠肽及内皮素检测结果分析[J].海南医学,2013,24(13):1954-1955.
[11]郭志国,韩 真,袁鹤鸣.加贝脂对ERCP患者十二指肠乳头局部组织中VIP和nNOS表达的影响[J].世界华人消化杂志,2011,19(16):1731-1734.
[12]Van Geldre LA,Lefebvre RA.Interaction of NO and VIP in gastrointestinal smooth muscle relaxation[J].Curr Pharm Des,2004,10(20):2483-2497.
[13]王 强,唐才喜,王湘英,等.清胰汤改善重症急性胰腺炎大鼠胃肠动力的机制研究[J].中国普通外科杂志,2013,22(3):275-280.
[14]林 中,张剑波,赵永忠,等.小肠肌间神经丛神经元体外培养抑制肠平滑肌细胞的增殖[J].世界华人消化杂志,2008,16(14):1577-1580.
[15]李小玲,林 中,郑清华,等.清胰汤对重症急性胰腺炎大鼠结肠黏膜下神经节VIP神经元的影响[J].实用医学杂志,2012,28(22):3715-3717.

