二次盐水中碘离子测定方法的探讨
王建宏,宋 昕
(黑龙江昊华化工有限公司黑龙江 齐齐哈尔 161033)
二次盐水碘含量过高会毒害离子膜,会造成膜损坏。生产工艺要求小于等于0.2 mg/L,但是二次盐水中由于饱和NaCl的影响,碘的检出线升高为0.3 mg/L,因此,无法使用ICP OCE方法对其检测;采用分光光度法分析操作复杂,时间长,当发现碘离子超标,电解槽膜已受到了损害。目前,黑龙江昊华化工有限公司二次盐水中碘离子测定采用 《制盐工业通用试验方法碘离子的测定》中的直接滴定法,即适用于以碘酸钾为碘剂的普通加碘食用盐中碘的测定。方法经改进后又适用于二次盐水中碘离子的测定。该法既简便又快速,准确性和重现性都很好,省时、省力,是该公司测定二次盐水中碘离子的主要方法。
1 比色法
1.1 试剂和溶液
(1)三氯化铁10%溶液:称取100 g三氯化铁,加入10 mL盐酸,用水稀释至1 000 mL;
(2)盐酸(相对密度 1.1 g);
(3)四氯化碳;
(4)碘标准溶液(1 mL 溶液含有 0.1 mg I-)称取0.131 g碘化钾,溶于水,移入1 000 mL容量瓶中稀释至刻度,贮于褐色瓶中;
(5)碘标准溶液:(1 mL 溶液含有 0.01mg I-)。
1.2 测定步骤
量取50.0 mL试样,置于100 mL分液漏斗中。在另一个100 mL分液漏斗中加入1 mL碘标准溶液,用水稀释至50 mL。每个分液漏斗分别加入2 mL盐酸和5 mL三氯化铁溶液,摇匀,放置5 min,分别加入10 mL四氯化碳,剧烈摇动1 min,静止分层,放出四氯化碳至10 mL比色试管中。从试样中,提取的四氯化碳紫色不应深于标准溶液的四氯化碳提取的颜色。
1.3 测量范围
碘离子测定范围为0.01~0.20 mg/L碘离子。
1.4 注意问题
(1)不用分液漏斗也可用50 mL比色试管代替,带紫色的四氯化碳层在水溶液下面,溶液比色。
(2)如果试样中含碘离子较高,可配制标准系列,进行比较。
2 直接滴定法
2.1 原理
在酸性溶液中,试样中的碘酸根氧化碘化钾析出碘,用硫代硫酸钠标准溶液滴定,测定碘离子的含量,方程式如下。
IO3-+I-+6H+=I2+3H2O
2 S2O3-+I2=2I-+S4O6-
2.2 仪器设备
一般实验室仪器。
2.3 试剂和溶液
本方法所用试剂和水未注明要求时,均使用分析纯试剂和蒸馏水(或相应纯度的水)。
(1)硫代硫酸钠(GB/T637):0.1 mol/L 硫代硫酸钠标准溶液
配制:称取25 g硫代硫酸钠,1.0 g氢氧化钠,溶于1000mL水中,贮于棕色瓶中,取上层澄清液备用。
标定方法:采用0.15 g 120℃烘干至恒重的基准重铬酸钾,称准至0.000 1 g,置于碘量瓶中,溶于25 mL水,加2 g碘化钾及20 mL硫酸溶液(20%)摇匀,于暗处放置10 min,加150 mL水,用前项配制好的硫代硫酸钠溶液滴定。近终点时,加3 mL淀粉指示液(5 g/L),继续滴定至溶液由蓝色变为亮绿色,同时作空白试验。
硫代硫酸钠标准溶液浓度按下式计算:
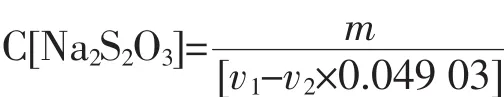
式中:C(Na2S2O3)—硫代硫酸钠标准溶液的量浓度,mol/L;m—重铬酸钾质量,g;V1—硫代硫酸钠溶液用量,ml;V2—空白试验硫代硫酸钠溶液用量,mL;0.049 03—与1.00 mL硫代硫酸钠标准溶液相当的以克表示的重铬酸钾的质量。
(2)用配制并标定好的 C(Na2S2O3)=1.000 mol/L硫代硫酸钠溶液稀释50倍0.002 mol/L。
(3)磷酸(GB/T1282):1 mol/L 溶液
量取17 mL 85%磷酸,加水稀释至250 mL
(4)碘化钾(GB/T):50 g/L 溶液(用时新配)称取25 g碘化钾,用水溶解,并稀释至500 mL,贮于棕色瓶中。
(5)淀粉(HGB3095):5 g/L 溶液(用时新配)
称取0.5 g淀粉,用水调成糊状,倾入100 mL沸水,搅拌后,再煮沸0.5 min,冷却备用。
2.4 分析步骤
取二次盐水10 mL,置于250 mL碘量瓶中,加入2 mL 1 mol/L的磷酸和5 mL 50 g/L的碘化钾溶液,加入约 5 mL 5 g/L淀粉溶液,摇匀,用0.002 mol/L硫代硫酸钠标准溶液滴定,至蓝色恰好消失为止。
2.5 测定计算
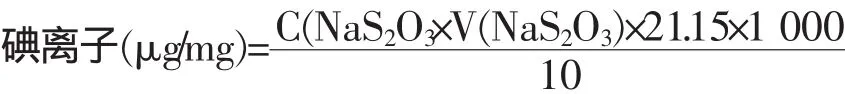
式中:C(Na2S2O3)—硫代硫酸钠标准溶液的浓度,mol/L;V (Na2S2O3)—硫代硫酸钠标准溶液的用量,mL;21.15—1/6 I-毫摩尔质量,mg/mmoL;10—二次盐水吸入的体积,mL。
2.6 允许差
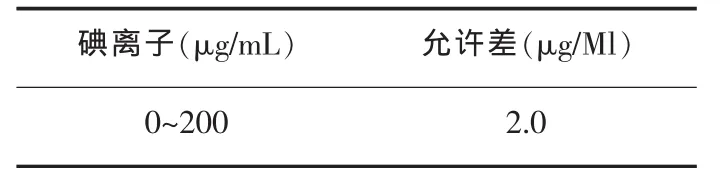
碘离子(μg/mL)允许差(μg/Ml)0~200 2.0
预实验:取KIO3少量,加入少量 50 g/L KI和1 mol/L H3PO4,加少量5 g/L淀粉,至溶液变为蓝色,验证药品使用正常。
称取10.0 g左右以KIO3作碘剂的加碘食用盐置于250 mL碘量瓶中,加水约80 mL,按GB/T13025.7-1999方法操作滴定至蓝色消失,0.002 mol/L硫代硫酸钠消耗体积为7.12 mL,由公式:
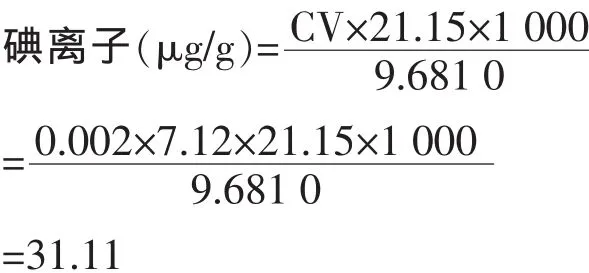
验证GB/T13025.7-1999方法使用正常。
2.7 分析方法的改进措施
(1)直接滴定法是称取10.0 g均匀加碘食用盐,置于250 mL碘量瓶中,加水约80 mL溶解。改进后,直接吸取10.0 mL二次盐水样。
(2)原标准是滴定至溶液呈浅黄色时,加入约5 mL 5 g/L淀粉溶液,继续滴定至蓝色恰好消失为止。改进后,在滴样前加入约Na2S2O35 mL 5g/L淀粉溶液
(3)原标准 Na2S2O3制成 0.002 mol/L标准溶液进行标定。改进后,采用K2Cr2O7标定配制好的0.1 mol/L Na2S2O3,稀释 50 倍,得到 C(Na2S2O3)=0.002 mol/L。
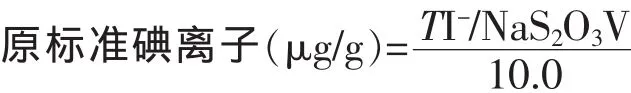
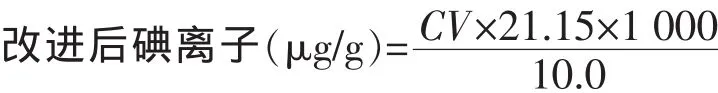
2.8 注意事项
(1)取二次盐水量瓶先用硝酸进行酸洗,再用超纯水冲洗,最好使用聚乙烯瓶,保证不污染样品。
(2)特别指出,直接滴定法测定碘离子只适用于以KIO3为碘剂普通加碘食用盐,不适用于海藻食用盐,更不适用于原盐。
(3)取二次盐水10 mL于250 mL碘量瓶,切忌不能加约80 mL水,也不能加热。
(4)碘化钾溶液见光易被空气中氧气氧化成碘而变为黄色,最好使用棕色瓶密封。
(5)Na2S2O3溶液用煮沸冷却后的蒸馏水配制,以除去微生物。配置好的溶液置于棕色瓶中,放置2周,再用K2Cr2O7标定,Na2S2O3加热煮沸10 min后冷却移入棕色瓶。
(6)若是测以碘酸钾为碘剂普通加碘食用盐,应按原标准GB/T13025.7-1999操作,即用0.002 mol/L Na2S2O3标准溶液滴定,滴定至溶液呈浅黄色时,加入约5mL淀粉溶液,继续滴定至蓝色恰好消失为止。
(7)若是测二次盐水中碘离子,最好在滴样前加入淀粉,这样,能够得到准确的消耗体积。即采用前述分析步骤。
(8)由于在滴定样品过程中,消耗硫代硫酸钠量很小,实际操作均采用0~5 mL微量滴定管。
(9)在滴样过程中,由于颜色较浅,不易观察,滴定速度要缓慢。尽量在阳光充足的地方,底部用白纸衬托,观察蓝色变化情况,直到蓝色恰好消失为止。
(10)在滴样产生轻度的返色时,稍等颜色复出,再滴至不返色为止。
(11)原盐中碘离子若采用直接滴定法,无法检出,而二次盐水碘离子却检出,很有可能是原盐中碘离子受到杂质干扰所致。
(12)取来的二次盐水样应做到尽快分析,现取现做,以免久置使样品浑浊,使终点不明显。
3 结果讨论
采用比色法和直接发滴定法测定二次盐水中碘离子含量的比较结果见表1。
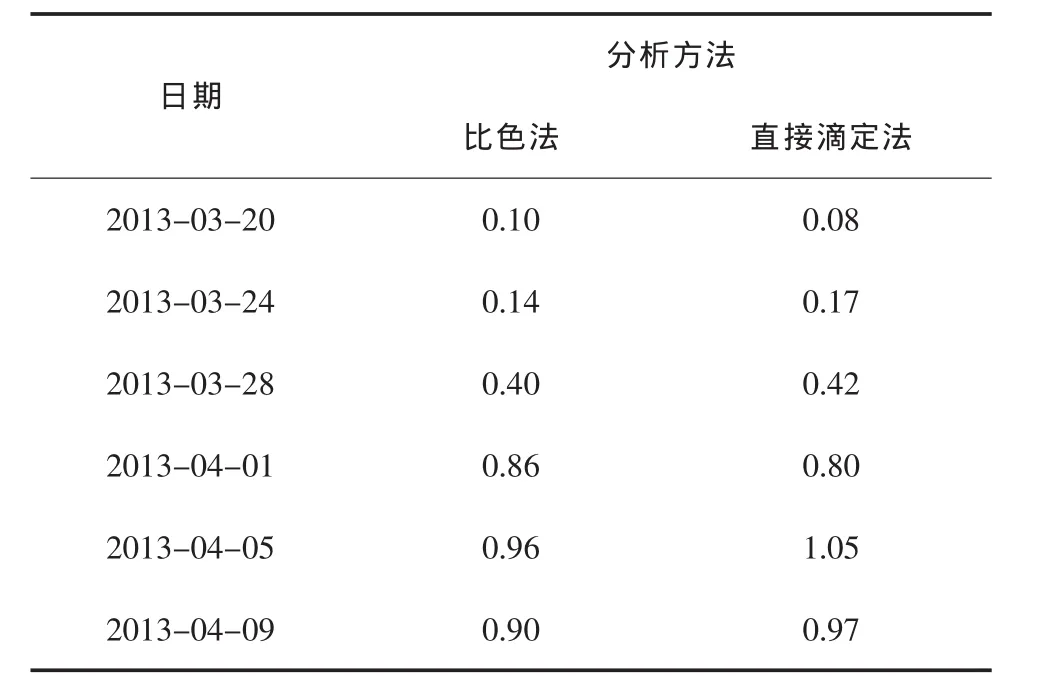
表1 二次盐水中碘离子含量测定结果 μg/mL
(1)比色法受环境影响,测定线性、重现性差,只是在停电检修情况下使用。
直接滴定法作为主要分析方法完成二次盐水碘离子测定。
(2)正常 Iˉ≤0.2 mg/L,有时由于开停车,生产运行不正常,I-含量偏高。这时,要按做样频率及时测定,数据产生波动时及时反馈,以便及时处理。
(3)直接滴定法简便、快速、省时、省力,准确性和重现性都很好。
——硫代硫酸钠

