生物淋滤去除电镀污泥中的重金属
曾 猛,靳 辉,刘金友,吕海锋
(1.天津市环境保护科学研究院,天津 300191;2.辽宁省环境保护宣传教育中心,辽宁 沈阳110161;3.天津市蓟县环境保护局,天津 301900;4天津世纪天源集团有限公司,天津 300191)
引 言
电镀就是利用电解原理在某些金属表面镀上一薄层其它金属或合金的过程[1],因此,这个过程会产生大量的重金属。电镀废水经过处理可有效除去重金属达标排放,但一部分重金属进入反应器的活性污泥中。目前,污泥处置的方案包括厌氧消化、焚烧、填埋或农田回用等。从运营成本和可持续发展角度考虑,污泥的农田回用应该是最有价值与前景的污泥处置方法[2]。然而,限制污泥农田回用的重要原因之一就是其中的有毒重金属[3-5]。因此,去除污泥中对环境有害的重金属成为污泥处理的一个不可缺少的部分[5]。
目前,通常使用化学法去除污泥中的重金属,如氯化、离子交换、络合和酸化等。化学法具有一定的缺点,如成本高、操作困难、耗能量高和金属溶解量低等[6]。相比之下,起源于微生物湿法冶金的生物淋滤法具有成本低、操作简单、需能量低、金属去除率高且副产物无毒等优点[7]。因此生物淋滤法在去除剩余活性污泥重金属中具有广泛的应用前景。
生物淋滤法是利用自然界中一些微生物的直接作用或其代谢产物的间接作用,产生氧化、还原、络合、吸附或溶解作用,将固相中某些不溶性成分(如重金属、硫及其它金属)分离浸提出来的一种技术[8]。
生物淋滤常用的菌种就是嗜酸性氧化硫硫杆菌(A.t)[9]。这种微生物的生理特特征是:化能自养、以无机物硫为能源,最适pH为2~4。无需外加碳源,且低pH抑制了杂菌的生长,所以在实际反应器中施用时不需无菌保障,降低了成本,适合污水处理的开放式反应器[10]。
本文介绍了以一株嗜酸性氧化硫硫杆菌针对富含多种重金属的电镀污泥进行的生物淋滤,从菌种的活化到生物淋滤的操作,以及后续的处理与检测,并探讨了生物法较之传统物化法的优势。
1 材料及实验方法
1.1 实验材料
1)污泥样品。电镀废水处理反应器的剩余活性污泥,取自天津某电镀厂污水处理系统二沉池。
2)菌株。嗜酸性氧化硫硫杆菌ZM-01,保存温度为4℃,由天津市环境保护科学研究院微生物组从活性污泥中分离并保藏。
3)9K 培 养 基。3.0g(NH4)2SO4,0.5g K2HPO4,0.5g MgSO4·7H2O,0.1g KCl,0.01g Ca(NO3)2·4H2O,10g S,1000mL H2O。
1.2 实验方法
1.2.1 嗜酸性氧化硫硫杆菌的活化
吸取5mL A.t菌液加入相应已备好的9K培养基中。摇匀,测定初始pH和氧化还原电位(ORP),并记录。体系于30℃,150r/min振荡培养,活化7d左右。培养过程中每天用酸度计和ORP测定仪测量菌液 pH与 ORP,并记录。当菌液 ORP达到600mV左右,pH降至2以下时则认为菌体活化结束,可作为淋滤用菌。
1.2.2 生物淋滤
取电镀污泥以7000r/min离心沉积20min,弃上清液。按5%比例分别称取两种湿泥样品加入到100mL三角瓶中。按照10%接入活化得到的种子液,并加入9K培养基固体。将三角瓶于θ=30℃,150r/min下培养,每天检测pH和氧化还原电位(ORP),当pH降至2以下、ORP升至600mV以上时停止培养。淋滤处理后离心收集沉淀,即为淋滤后污泥。
改变9K培养基中S的含量,分别为原始值的100%、50%、25%和12.5%,在不同底物浓度(S的添加量)下进行生物淋滤,每个浓度进行3个重复,取平均值。只添加9K培养基而不投加菌种的污泥作为对照组。
1.2.3 污泥的消化与检测[11-12]
将污泥在105℃下烘干至恒质量。取1g样品加入定氮烧瓶中,按V(浓硝酸)∶V(高氯酸)3∶1加入,使其浸没样品。加热至沸腾后,控温使其微沸,持续2h左右。如液面下降,按上述比例补酸。上清水溶液变澄清,下层污泥发白成糊状,结束加热。离心取上清液,定容。采用原子吸收分光光度法检测重金属含量,使用STD-XG硫磺检测仪检测残余硫磺含量。
采用公式计算重金属去除率:
η去除=(淋滤前重金属质量浓度-淋滤后重金属质量浓度)/淋滤前重金属质量浓度×100%。
2 结果与讨论
2.1 硫杆菌的活化
取A.t种子液进行活化,活化过程中的pH变化如图1所示。数据表明,A.t菌液的pH前3d变化很小,保持在2.5左右,第4d迅速降低至1.33,最后第7d降至1.05。A.t使pH降低的原因是A.t把底物S氧化成H2SO4[13]。
由图1还可以看出,A.t的ORP变化前3d基本不变,之后开始逐步上升,由第3d的381mV上升至606mV。ORP代表氧化还原能力,ORP越高,氧化能力越强,ORP越低,还原能力越强。对于A.t来说,利用S的能力越强,氧化能力越强,其活性越高,ORP也就越高。因此,可以用ORP间接反应细菌的活性。所以一般在ORP上升至600mV以上时视为活化结束,可以用作种子液进行下一步的生物淋滤。
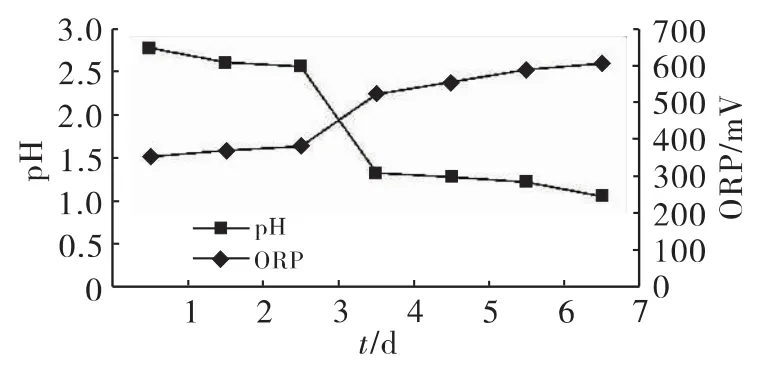
图1 硫杆菌活化过程中pH和ORP的变化
另外由图1可见,在活化过程中A.t会有较长时间的迟缓期,所以pH和ORP都有几天的稳定期,之后会进入快速增殖阶段。pH和ORP的变化规律呈负相关性。
2.2 生物淋滤过程
2.2.1 生物淋滤过程的监控
对电镀污泥的生物淋滤过程中pH呈下降趋势,如图2所示。实验组pH由5.1降低到1.0左右,对照组pH由6.89降低到5.78。对照组的降低可能是因为污泥中所含的土著菌生理代谢活动所致。实验组pH在第一天就迅速的降低到2.5左右,第三天就已经降低到接近1.5,往后降低速度趋于平缓。由于pH的迅速降低,实验组中无法在酸性条件下生长的土著菌会大量死亡。
各组的ORP在第一天均显著上升,之后上升速度渐渐降低最后趋于平稳。实验组ORP从第一天开始就显著高于对照组,如图2所示。
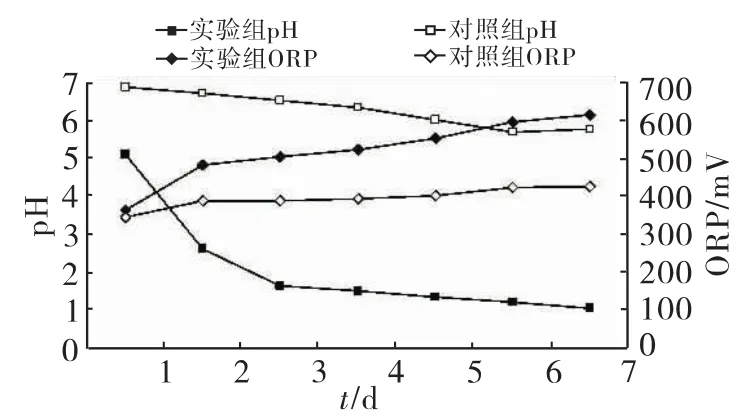
图2 生物淋滤过程中pH和ORP的变化
生物淋滤结束后,经浓硝酸和高氯酸消化处理,并采用原子吸收分光光度法测得淋滤前后重金属含量。
2.2.2 底物浓度与淋滤效果
将底物浓度(S的添加量)按9K的100%、50%、25%和12.5%加入,在不同底物浓度下进行生物淋滤,结果如图3所示。
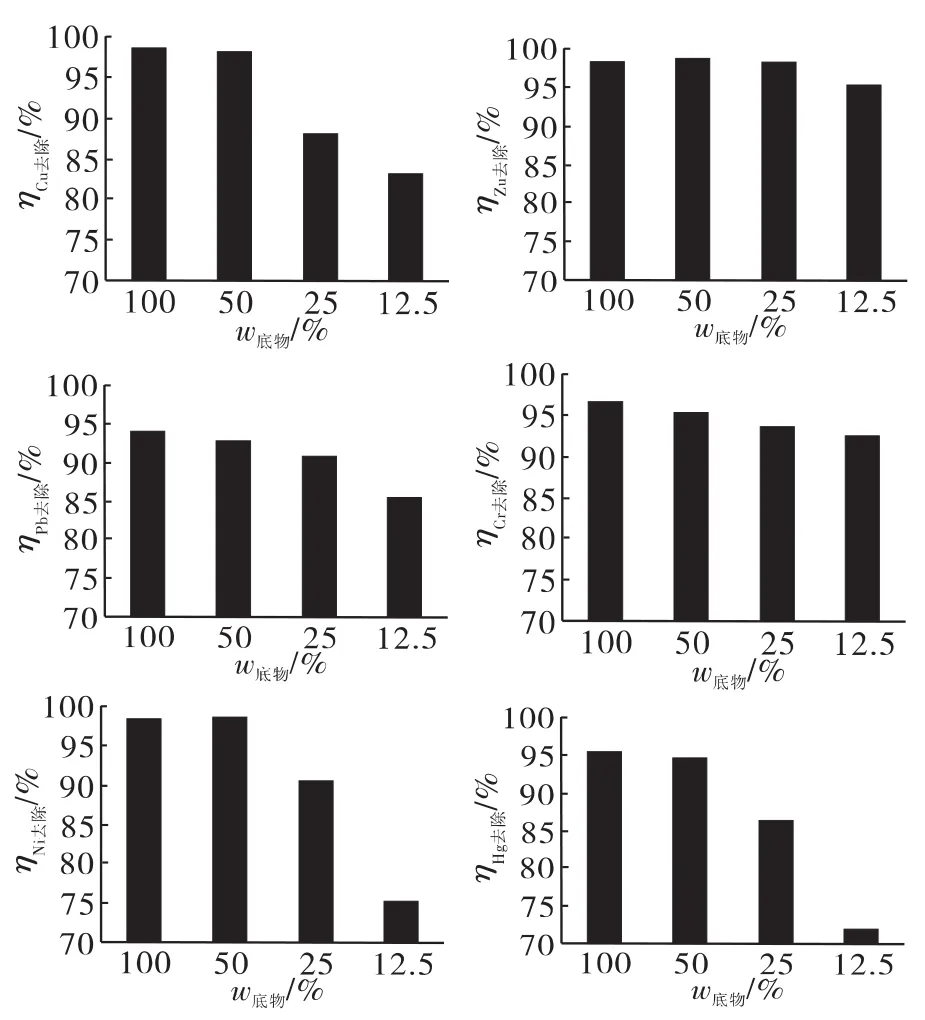
图3 不同底物质量分数对重金属的生物淋滤效果
对Cu的去除,当底物质量分数为原始值50%时,去除率基本与100%时持平,当底物减少到25%,去除率降低了10%。当底物质量分数仅为原始值的12.5%,对Cu的去除率进一步降低到了83%。
对Zn的去除率,底物质量分数由原始配方降低到25%时,去除率基本无变化,稳定在98.5%左右;底物质量分数降低为原始值12.5%时,去除率有了轻微的降低,为95.2%。
四种不同底物含量下对Pb的去除率分别对应93.8%、92.8%、91.0% 和 85.5%。随着底物质量分数的减少,对Pb的去除率逐步降低。
不同底物质量分数下,Cr的去除率分别为96.9%、95.5%、93.8% 和 92.6%。随着底物质量分数的减少,Cr的去除率以很小的幅度逐步降低,总体影响不大,去除率仍维持在90%以上的较高水平。
当底物质量分数为原始值的50%时,Ni的去除率没有出现降低。但随着底物由50%降低到25%和12.5%时,去除效果迅速下降,12.5%的底物质量分数下对于Ni的去除率仅为75.1%。
对Hg的去除,在底物质量分数为原始值50%时只是略有降低,但当底物质量分数为原始值的25%时,对Hg的去除率已经降低到73%的水平。当底物质量分数为原始的12.5%时,去除率大幅下落,去除率仅为43.8%。
综上所述,底物质量分数的减少,对于Zn、Cr的淋滤效果几乎没有影响,对于Cu、Pb的影响较为明显,而对于Ni和Hg的去除率的影响十分显著。虽然一些重金属离子的去除效果随着底物质量分数的减少有着大幅度的降低,不过对于本实验所用的剩余活性污泥样品在经过12.5%底物的生物淋滤之后,各种重金属的剩余量仍达到了国家对于农用污泥所规定的标准[14],不同底物浓度下淋滤前后污泥中重金属含量与《污泥农用时污染物控制标准限值》(GB18918-2002)的比较列于表1。由于底物12.5%部分结果已接近标准,所以没有进行更低底物浓度的检测。同时,淋滤后污泥中硫磺残留为痕量级,可以安全进行后续堆肥或消化操作。因此,在实际应用时,考虑到成本问题以及控制残留的底物问题,应当选取较低浓度的底物投加量。
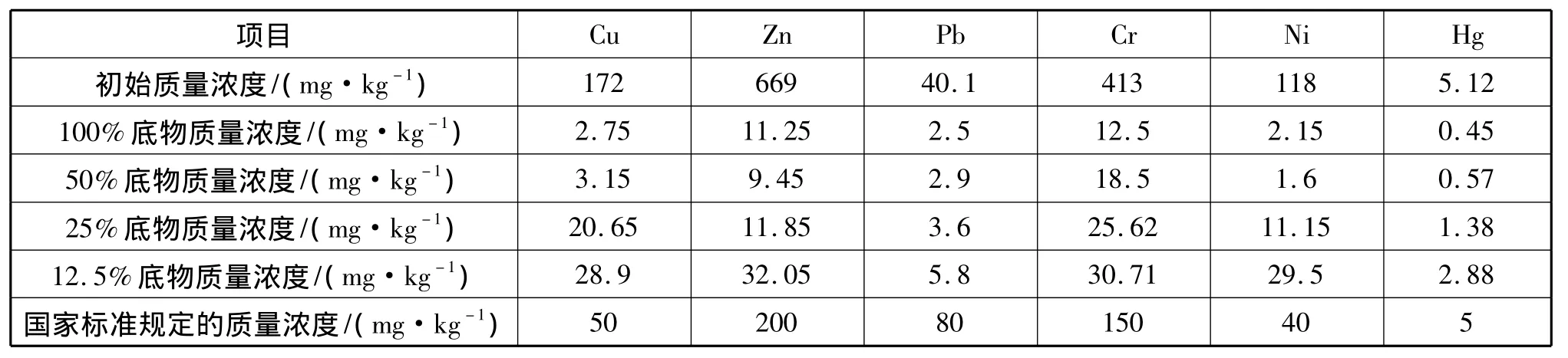
表1 淋滤前后污泥中重金属质量分数与标准的比较
3 结论
使用嗜酸性氧化硫硫杆菌(A.t)进行生物淋滤,菌种在9K培养基中活化7d使用。探讨底物质量浓度对淋滤效果的影响,单质硫添加量为12.5%(即1.25g/L)时,各种重金属的剩余量达到国家对于农用污泥所规定的标准。生物淋滤较之传统物化法具有金属溶出率高、操作简便,持续性好等特点。
[1]李峰,吴欲,胡如南.我国电镀废水处理回用的现状及探讨[J].电镀与精饰.2011(10):17-20.
[2]周立祥,胡霭堂,戈乃玢,等.城市污泥土地利用研究[J].生态学报,1999,19(2):185-193.
[3]Bruce A M,Davis R D.Sewage sludge disposal:current and future options[J].Water Science and Technology,1989,21:1113-1122.
[4]Burton F L.Wastewater Engineering:Treatment,Disposal and Reuse,3rd edn[M].Singapore:McGraw-Hill,1991:15-41.
[5]McGhee T J.Water Supply and Sewage,6th edn[M].Singapore:McGraw-Hill,1991:129-153.
[6]In S Kim,Jong-Un Lee,Am Jang.Bioleaching of heavy metals from dewatered sludge by Acidithiobacillus ferrooxidans[J].Journal of Chemical Technology and Biotechnology,2005,80:1339-1348.
[7]Mercier G,Chartier Mand Couillard D.Strategies to maximize the microbial leaching of lead from metal-contaminated aquatic sediments[J].Water Research,1996,30:2452-2464.
[8]周顺桂,周立祥,黄焕忠.生物淋滤技术在去除污泥中重金属的应用[J].生态学报,2002,22(1):125-133.
[9]Wong,Xiang L,Henry J G.Bacterial leaching of heavy metals from anaerobically digested sewage sludges[J].Water.Pollut.Res.J.Can,1983,18:151-162.
[10]Wong J W C,Xiang L,Gu X Y.Bioleaching of heavy metals from anaerobically digested sewage sludge using FeS2 as an energy source[J].Chemosphere,2004,55:101-107.
[11]李海峰,王庆仁,朱永官.土壤重金属测定两种前处理方法的比较[J].环境化学,2006,25(1):108-109.
[12]GB/T17140-1997,土壤质量铅、锆的测定[S].
[13]Ying-Xu Chen,Yu-Mei Hua,Shao-Hui Zhang.Transformation of heavy metal forms during sewage sludge bioleaching[J].Journal of Hazardous Materials,2005,B123:196-202.
[14]GB18918-2002,污泥农用时污染物控制标准限值[S].

