PTTG和VEGF-C在喉癌组织中的表达及其与微淋巴管生成的关系
高 珊,卢国友,王竹君△,徐 勤,辛国华,刘吉娜,黄越燕
(1.承德医学院附属医院耳鼻喉科,河北承德067000;2.河北省承德市口腔医院综合科067000)
喉癌是头颈部常见的恶性肿瘤,主要病理类型为鳞状细胞癌,其发病率逐年上升,癌细胞转移成为影响其预后的主要原因。垂体肿瘤转化基因(PTTG)是从垂体瘤组织中分离出的原癌基因,其高表达在促进细胞增殖转化以及体内肿瘤形成中有重要作用。血管内皮生长因子-C(VEGF-C)是目前发现的惟一可调节胚胎组织淋巴管生成的因子,是PTTG反式激活靶基因之一,可作为PTTG介导微淋巴管生成的效应剂。本研究检测PTTG和VEGF-C在60例喉鳞癌组织中的表达及其与微淋巴管生成的关系,探讨二者对喉癌发生、发展的作用及意义,现报道如下。
1 资料与方法
1.1 一般资料 60例喉癌组织及32例喉癌相应癌旁组织(距离肿瘤切缘至少大于0.5cm[1])取自2005年6月至2011年12月于承德医学院附属医院耳鼻咽喉科住院手术60例原发喉鳞癌患者。术前均未接受放、化疗,标本为手术切除后1h内获得,标本获得后经10%甲醛固定、石蜡包埋、4μm厚度连续切片。所有标本均经过病理学检查确诊。60例喉鳞癌患者中,男52例,女8例;年龄42~74岁,中位年龄60岁,<60岁33例,≥60岁27例;采用2010年国际抗癌协会(UICC)公布的TNM分类分期标准,Ⅰ、Ⅱ期36例,Ⅲ、Ⅳ期24例。有淋巴结转移22例,无淋巴结转移38例(有无淋巴结转移根据术后病理而定);声门上型30例,声门型30例;发病前吸烟史20年以上(每日大于20支)者48例为吸烟组,其余12例为对照组;肿瘤小于3cm者40例,肿瘤大于或等于3cm者20例;高分化(G1级)35例,中低分化(G2~G3级)25例。
1.2 试剂和仪器耗材 兔抗人PTTG、VEGF-C多克隆抗体及鼠抗人D2-40单克隆抗体均购自北京中杉金桥公司。
1.3 方法 采用免疫组织化学SP法,每例标本解冻后经甲醛固定24h内行石蜡包埋,连续切取切片3张,分别进行PTTG、VEGF-C和D2-40染色石蜡切片(5μm),常规脱蜡至水,3%过氧化氢室温孵育10min,抗原修复15min,室温放置40 min,磷酸盐缓冲液(PBS)冲洗,小牛血清封闭10min,滴加一抗50μL(1∶100工作液)4℃过夜,PBS冲洗,加二抗,室温孵育15min,PBS冲洗,DAB显色5min,终止显色,蒸馏水冲洗,苏木素复染,透明,封片,镜检。
1.4 结果判定 PTTG、VEGF-C主要表达于细胞质或细胞核(多数在细胞质),以出现棕黄色颗粒为阳性反应。以PBS代替一抗作为阴性对照,以已知喉癌阳性组织切片为阳性对照。采用Volm双评分法进行判定在染色均匀的肿瘤区,选取5个高倍镜视野(×200):(1)按染色阳性细胞百分率(A值)评分,阴性为0分,<25%为1分,25%~50%为2分,>50%为3分;(2)按染色强度(B值)评分,不着色为0分,浅棕色为1分,棕黄色为2分,棕褐色为3分。综合A、B值判断结果,阴性:0分,阳性:1~6分。
微淋巴管密度(LMVD)判定:采用D2-40染色微淋巴管内皮,阳性的微淋巴管内皮细胞胞质呈棕黄色颗粒。微淋巴管计数根据Weidener法,先用100倍镜扫视整个切片,寻找肿瘤组织内微淋巴管最丰富的区域即“热点”,然后在200倍镜下计数每一热点的微淋巴管数目(忽略管径大于8个红细胞或管壁有平滑肌存在的脉管),由两人采用双盲法进行计数。结果采用2个热点、5个200倍视野下微血管数目的平均值作为LMVD。以上结果的判定均由两位不知患者临床病理资料的病理科医师进行。
1.5 统计学处理 采用SPSS13.0统计软件进行分析。采用Spearman等级相关分析蛋白,LMVD表达的相关性。计数资料采用χ2检验。计量资料以x±s表示,两样本均数比较用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PTTG、VEGF-C蛋白在喉癌组织、癌旁组织中均有表达
在60例喉癌组织标本中,PTTG蛋白表达的阳性率为70.0%,在癌旁组织表达的阳性率37.5%,PTTG蛋白在喉癌组织的表达明显高于癌旁组织,差异有统计学意义(P<0.05)。VEGF-C在喉癌组织中阳性表达率为68.33%,在癌旁组织中阳性表达率12.5%,VEGF-C蛋白在喉癌组织的表达明显高于癌旁组织,差异有统计学意义(P<0.05),见表1,图1、2。

表1 喉癌组织、癌旁组织中PTTG、VEGF-C蛋白表达的比较[n(%)]
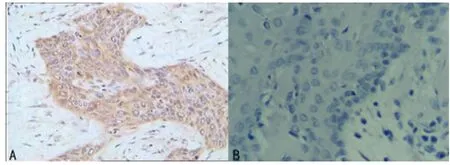
图1 PTTG蛋白在喉癌组织中表达(SP×400)
2.2 LMVD在喉癌组织、癌旁组织中的表达 喉癌组织LM-VD值在高倍视野下为(23.08±3.14),明显高于癌旁组织(14.71±2.50),差异有统计学意义(P<0.05),见图3。

图2 VEGF-C蛋白在喉癌组织中的表达(SP×400)
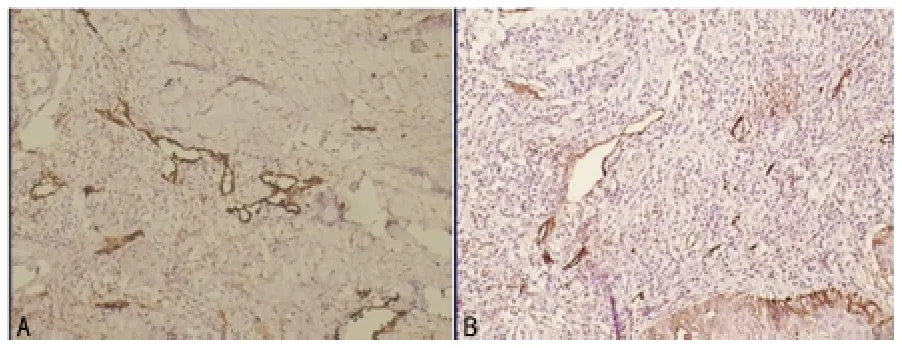
图3 D2-40在组织中表达(SP×200)
2.3 PTTG、VEGF-C的表达与喉癌组织中的淋巴结转移、临床分期、分化程度的关系 PTTG、VEGF-C的表达均与喉癌组织中的淋巴结转移、临床分期、分化程度相关(P<0.05),与喉癌组织中的肿瘤大小、吸烟量、年龄及性别无相关性(P>0.05)。LMVD与淋巴结转移有相关性(P<0.05),与临床分期、分化程度、肿瘤大小、吸烟量、年龄及性别无相关性(P>0.05)。
2.4 PTTG、VEGF-C在喉癌组织表达的相关性 PTTG表达阳性的42例喉癌组织中,VEGF-C阳性31例(73.81%);VEGF-C表达阳性的41例喉癌组织中,PTTG阴性34例(82.93%)。PTTG与VEGF-C在喉癌组织中表达呈正相关,差异有统计学意义(r=0.67,P<0.05)。
2.5 喉癌组织中PTTG、VEGF-C表达各组的LMVD值比较
喉癌组织中VEGF-C表达阳性组LMVD值(27.83±4.03),显著高于VEGF-C阴性表达组LMVD值(23.53±3.40),差异有统计学意义(P<0.05)。PTTG表达阳性组LMVD值(27.63±4.81),高于 PTTG 表达阴性组 LMVD值(24.59±4.09),差异有统计学意义(P<0.05)。
3 讨 论
PTTG作为原癌基因,在大多数正常组织中不表达,除在垂体肿瘤中有高表达外,其他的恶性肿瘤细胞中也高表达[1-3]。PTTG高表达在肿瘤发生中的作用机制可能有:(1)PTTG通过激活转染细胞中的C-myc原癌基因从而发挥转录因子的作用[4];(2)PTTG在肿瘤组织中的高表达可以促进bFGF转录和分泌,导致细胞转化,从而促进肿瘤中出现有丝分裂、血管生成、调控激素分泌[5];(3)PTTG蛋白抑制姊妹染色体单体分离,破坏细胞分裂导致染色体稳定性破坏,非整倍体形成,赋予其成瘤活性[6];(4)PTTG通过反式激活作用激活原癌基因、生长因子等间接致癌;(5)PTTG基因调控区的突变引起其调控失常,导致其高表达,引起肿瘤细胞转化;(6)PTTG具有细胞凋亡和染色体非整倍体性的双重作用。以上决定了PTTG与恶性肿瘤发生、发展及预后关系密切。
目前,对于肿瘤淋巴管生成的研究已成为热点,VEGF-C被认为是已知最具特异性的淋巴管内皮生长刺激因子,其高表达可促进淋巴管增生及淋巴道转移[7]。VEGF-C是具有高度特异性的血管内皮分裂原,可诱导血管新生病增加新生血管的通透性。VEGF-C可能通过促进淋巴管形成并增生,从而增加淋巴管与肿瘤细胞接触面积使之利于出现转移,同时通过淋巴管数目的增加及接触面积的加大产生挤压现象使淋巴管通透性和肿瘤间质间的压力增加,更利于肿瘤细胞进入淋巴管及静脉血管[8]。Wiericnkx等[1]研究发现,肿瘤边缘区 LMVD增加与淋巴结转移密切相关。王璟璐等[9]发现,VEGF-C不仅与肿瘤浸润深度、淋巴结转移以及Duke′s分期相关,还与癌组织中LMVD密切相关。Tes等[10]在喉鳞癌组织中通过免疫组织化学检测到VEGF-C高表达。大量研究证实,PTTG可以上调DNA结合抑制蛋白-3(ID3),而VEGF-C介导血管发生的最重要介质就是ID3,PTTG促进VEGF-KDR-ID3自分泌途径,促进癌细胞生长及转移[11-12],这与本实验结果中PTTG 与VEGF-C显著正相关相印证。本研究还显示,随着PTTG表达的增高,VEGF-C与LMVD表达亦增强,且喉癌组中VEGF-C表达明显高于癌旁组,且PTTG、VEGF-C及LMVD与喉鳞癌组织的淋巴结转移、临床分期、分化程度密切相关。提示在喉癌发生、发展过程中PTTG、VEGF-C发挥了重要作用,笔者推测该机制可能是PTTG高表达后通过上调生长因子受体从而诱导VEGF-C表达增高,即正性调节,而VEGF-C表达增高又通过刺激淋巴管内皮细胞数目和面积增生,从而挤压迁移促进癌组织中肿瘤微淋巴管大量生成及肿瘤淋巴道转移。PTTG诱导VEGF-C表达的作用机制可能为:MAPK级联活化增强PTTG反式激活作用,促进PTTG转移入核内,PTTG入核后结合于 VEGF-C转录起始位点,继而激活VEGF-C转录、翻译,促进肿瘤微血管淋巴管生成[13]。
本研究采用免疫组织化学检测喉癌组织中PTTG、VEGFC的表达以及肿瘤微淋巴管密度关系,结果显示,PTTG、VEGF-C在喉癌组织中呈显著正相关表达关系,二者表达与喉癌的淋巴结转移、临床分期、肿瘤分化程度密切相关。同时,PTTG、VEGF-C高表达的喉癌组织中LMVD也高的结果说明该喉癌组织内存在大量微淋巴管增生现象,且多位于肿瘤间质,LMVD与喉癌转移、复发及预后密切相关。
综上所述,PTTG、VEGF-C可作为喉癌转移及预后的预判标准。如能通过某种途径抑制PTTG表达可降低喉癌的侵袭力及抑制VEGF-C过度表达,从而减少癌细胞通过淋巴道转移的概率。以上或能为喉癌基因靶点治疗研究提供一定的思路。
[1]Wiericnkx A,Auger C,Devauchelle P,et al.A diagnostic marker set for invasion,proliferation,and aggressiveness of prolactin pituitary tumors[J].Eendocr Relat Cancer,2007,14(3):887-900.
[2]Genkai N,Homma J,Sano M,et al.Increased expression of pituitary tumor transforming gene(PTTG)-1is correlated with poor prognosis in gliom a patients[J].Oncol Rep,2006,15(6):1569-1574.
[3]Rehfeld N,Geddert H,Atamna A,et al.The influence of the pituitary tumor transforming gene-1(PTTG-1)on survival of patients with small cell lung cancer and nonsmall cell lung cancer[J].J Carcinog,2006,20(5):4.
[4]Yu R,Heaney AP,Lu W,et al.Pituitary tunor transforming gene causes aneuploidy p53-independent apoptosis[J].J Biol Chem,2000,275(47):36502-36505.
[5]Chen L,Puri R,Lefkowitz EJ,et al.Identificateion of the human pituitary tunor transforming gene(hPTTG)family:molecular structure,expression,and chromosomal localization[J].Gene,2000,248(1/2):41-50.
[6]Kim D,Pemberton H,Stratford AL,et al.Pituitary tunor transforming gene(PTTG)induce genetic instability in thyroid cell[J].Oncogene,2005,24(30):4861-4867.
[7]Latham AM,Molina-Paris C,Homer-Vanniasinkam S,et al.An integrative model for vascular endothelial growth factor A as a tumour biomarker[J].Integr Biol(Camb),2010,2(9):397-407.
[8]Yuan HQ,Kong F,Wang XL,et al.Inhibitory effect of acetyl-11-keto-beta-boswellic acid on androgen receptor by interference of Spl binding activity in prostate cancer cells[J].Biochem Pharmacol,2008,75(11):2112-2121.
[9]王璟璐,邢丽娜.VEGF-C和VEGFR-3在人结肠癌组织中的表达及意义[J].中国肿瘤临床,2008,35(16):910-913.
[10]Tes GM,Chan AW,Yu KH,et al.Strong immunohistochemical expression of vascular endothelial growth factor predicts overall survival in head and neck squamous cell carcinoma[J].Ann Surg Oncol,2007,14(12):3558-3565.
[11]Akino K,Akita S,Mizuguchi T,et al.A novel moleeular marker of pituitary tumor transforming gene involves in a rat liver regeneration[J].J Surg Res,2005,129(1):142-146.
[12]Kim DS,Frankiyn JA,Boelaert K,et al.Pituitary tumor transforming gene(PTTG)stimulates thyroid cell proliferation via a vascular endothelial growth factor/kinase insert domain receptor/inhibitor of DNA binding-3autocrine pathway[J].J Clin Endocrinol Metab,2006,91(11):4603-4611.
[13]Chien W,Pei L.A novel binding factor facilitates nuclear translocation and transcriptional activation function of the pituitary tumor-transforming gene product[J].J Biol Chem,2000,275(25):19422-19427.

