白细胞介素-17在病毒性心肌炎中的表达及黄芪甲甙干预对其的影响*
刘海英,刘丹莉,高顺利
(南华大学附属第一医院儿科,湖南衡阳 421001)
病毒性心肌炎(viral myocarditis,VMC)是由柯萨奇病毒B3(coxsackievirus B3,CVB3)等嗜心肌病毒引起的心肌炎症性疾病,近年来发病率呈上升趋势[1]。众多临床及动物实验证实细胞因子在VMC的发病机制中起重要作用。白细胞介素-17(interleukin-17,IL-17)是一种由 Th17细胞分泌的前炎症细胞因子,可诱导IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)产生,具有强大的促炎作用[2]。已有研究发现,IL-17有助于VMC与自身免疫性心肌炎的发生、发展[3-4]。黄芪甲甙是从中药黄芪中提取的一单体成分,对VMC有较好的治疗效果[5],然而,其抗VMC机制仍未完全阐明。为此,本研究通过CVB3感染Balb/c小鼠建立VMC动物模型,采用荧光实时定量PCR、免疫组化观察IL-17在VMC小鼠心肌组织中的表达情况,并以黄芪甲甙进行干预研究,从而探索IL-17在VMC
发病机制中的作用及黄芪甲甙的干预效果。
1 材料与方法
1.1 材料
1.1.1 病毒 本实验使用CVB3为Nancy株,由复旦大学附属中山医院卫生部病毒性心脏病重点实验室提供,在Hela细胞中进行传代,然后离心,提取上清液,并检测50% 组织感染率(TCID50),TCID50为107,保存于-70℃冰箱备用,实验所用病毒剂量为1×102TCID50。
1.1.2 动物 Balb/c小鼠60只,4周龄,雄性,纯种,体质量12~16g,购于上海斯莱克实验动物有限公司,饲养于无特定病原体2000B017(SPF)条件下。
1.1.3 药物 黄芪甲甙粉剂(批号:0781-9706)购买于国家药物和生物制品检定研究所(NICPBP),不溶于水,用助溶剂羧甲基纤维素钠制成均匀悬液,根据预实验将浓度设置为0.01、0.09g/L。
1.2 方法
1.2.1 动物分组、模型制备及药物干预 60只Balb/c小鼠按随机数字表法分为4组:对照组、模型组、低剂量干预组以及高剂量干预组,每组15只。对照组小鼠仅腹腔注射0.1mL不含CVB3的病毒培养液,其余3组小鼠腹腔接种0.1mL内含1×102TCID50CVB3的病毒液,以诱发VMC,对照组和模型组于接种当日即用0.1mL羧甲基纤维素钠溶液灌胃,低剂量干预组和高剂量干预组分别以0.01、0.09g/L黄芪甲甙0.1 mL灌胃,每天灌胃1次,连续14d,并记录各组小鼠一般状况及每天存活数。第15天称体质量(BW)后断颈处死小鼠,摘取心脏,称心脏质量(HW),计算HW/BW,然后将小鼠心脏沿左心室中线切为两部分,一部分用甲醛固定、石碏包埋,用HE染色和免疫组化检测;另一部分迅速置于液氮中,再转移至-70℃冰箱冻存,用于总RNA的提取与ELISA检测。
1.2.2 HE染色 按常规方法进行HE染色,在200倍光镜下分析小鼠心肌病理学变化,参照文献[6]计算心肌病变(炎症浸润或坏死)积分:每张心肌切片随机选择5个高倍视野,计算每个视野中炎症细胞浸润或坏死区域面积与整个视野面积比值,0分表示无病理学改变,1分表示心肌病变面积小于25%,2分表示心肌病变面积为25%~50%,3分表示心肌病变面积大于50%~75%,4分表示心肌病变面积大于75%。
1.2.3 荧光实时定量PCR检测 采用美国Invitrogen公司生产的Trizol试剂提取小鼠心肌组织总RNA,溶于无Rnase水中,紫外分光光度计测定OD260/OD280的比值为1.8~2.0。取总RNA 2μg,用Fermentas公司逆转录试剂盒合成cDNA。按照文献[7]由上海生工生物技术有限公司合成引物序列。IL-17上游引物:5′-GTC AAT GCG GAG GGA AAG-3′,下游引物:5′-CAC GAA GCA GTT TGG GAC-3′,扩增产物长度349bp;β-actin上游引物:5′-CCA GCC TTC CTT CTT GGG TAT-3′,下游引物:5′-TTG GCA TAG AGG TCT TTA CGG-3′,扩增产物长度102bp。取10μL逆转录产物进行PCR反应,反应条件:94℃预变性3min,94℃变性45s,58℃复性30 s,72℃延伸45s,总共35个循环,72℃延伸10min。溶解曲线分析表明PCR反应产物为单独的双链DNA。用ΔΔCt值法,以β-actin表达为内参定量IL-17的表达。
1.2.4 Western blot检测 将心肌组织放入液氮碾磨,三去污裂解液裂解。利用BCA蛋白定量测定试剂盒(Hyclone-Pierce公司)检测蛋白水平,50μg蛋白与加样缓冲液混合,在10%不连续十二烷基硫酸钠-聚丙烯酰胺凝胶电泳胶中电泳分离,电转移至PVDF膜,孵育一抗(美国Santa Cruz公司)、二抗,以β-actin为内参照,用ECL发光法显色,曝光、显影、定影。胶片条带用薄层扫描仪进行扫描后,运用Imager2200软件分析各产物积分光密度值,计算IL-17蛋白表达水平。IL-17蛋白表达水平=IL-17积分光密度值/β-actin积分光密度值。
1.2.5 ELISA检测 通过苯甲磺酰基氟化物(PMSF)将心肌组织匀浆,然后离心,提取上清液,利用ELISA试剂盒(深圳晶美生物工程公司)检测上清液中IL-6、TNF-α水平,严格按照说明书由专人进行操作。
1.3 统计学处理 采用SPSS13.0统计软件进行统计学分析,多组均数比较行单因素方差分析及两两之间比较的q检验,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 黄芪甲甙对小鼠死亡率与HW/BW的影响 在实验期间,对照组无小鼠死亡,模型组死亡率为46.67%(7/15),低剂量干预组死亡率为33.33%(5/15),高剂量干预组死亡率为20.00%(3/15);高剂量干预组死亡率较模型组降低(P<0.05),但低剂量干预组死亡率与模型组比较差异无统计学意义(P>0.05)。与对照组比较,模型组 HW/BW 明显增加(P<0.01);经黄芪甲甙处理后,高剂量干预组HW/BW较模型组降低(P<0.05),然而低剂量黄芪甲甙对HW/BW无影响(P>0.05),见表1。
2.2 黄芪甲甙对心肌病理组织学变化的影响 对照组心肌呈规则排列,未见到炎症细胞浸润和心肌细胞坏死;模型组出现大片心肌细胞坏死,周围可见众多炎症细胞浸润;低剂量干预组心肌病变程度与模型组相似;高剂量干预组坏死灶和炎性细胞浸润明显减少。与模型组比较,高剂量干预组炎症细胞浸润与心肌坏死积分显著降低(P<0.01);而低剂量干预组与模型组比较,差异无统计学意义(P>0.05),见图1、表1。
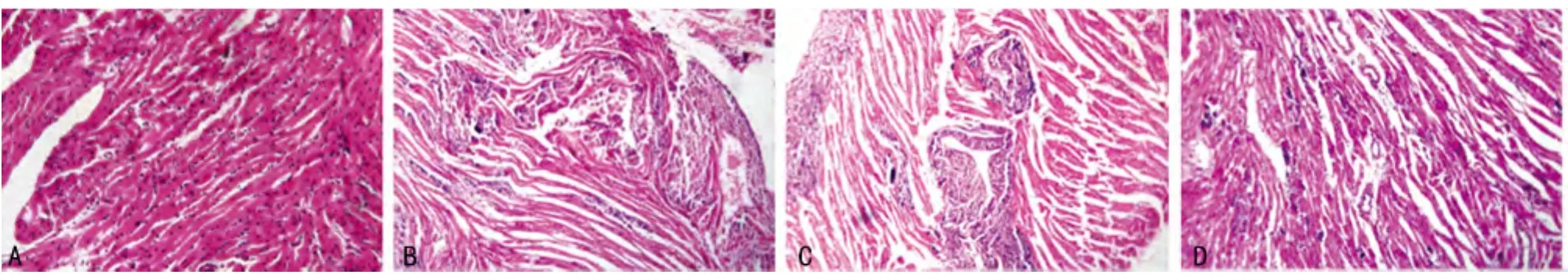
图1 各组心肌病理学改变(×200)
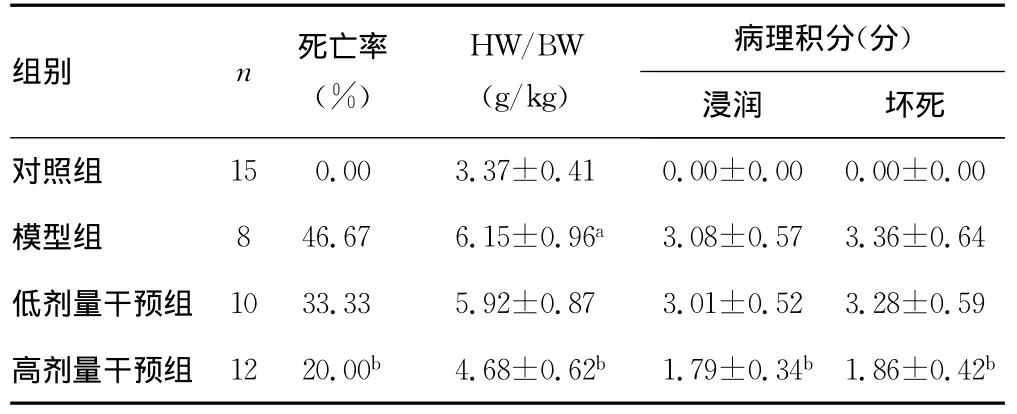
表1 各组死亡率、HW/BW及病理积分比较
2.3 黄芪甲甙对心肌IL-17mRNA表达的影响 条带密度扫描及半定量分析显示,模型组心肌组织中IL-17mRNA表达水平较对照组显著升高(P<0.01);与模型组比较,经过高剂量黄芪甲甙处理后,其表达水平明显降低(P<0.05);低剂量干预组IL-17mRNA表达水平与模型组比较,差异无统计学意义(P>0.05)。见图2。
2.4 黄芪甲甙对心肌IL-17蛋白表达的影响 Western blot检测显示,模型组IL-17蛋白表达水平较对照组显著升高(P<0.01);与模型组比较,经过高剂量黄芪甲甙处理后,IL-17蛋白表达水平明显降低(P<0.05),但低剂量黄芪甲甙对其无明显影响(P>0.05),见图3。
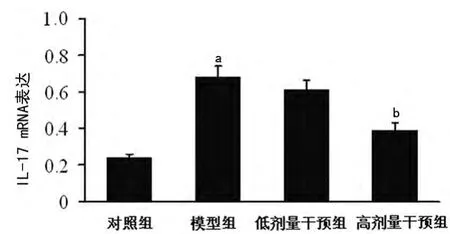
图2 各组小鼠心肌IL-17mRNA表达比较
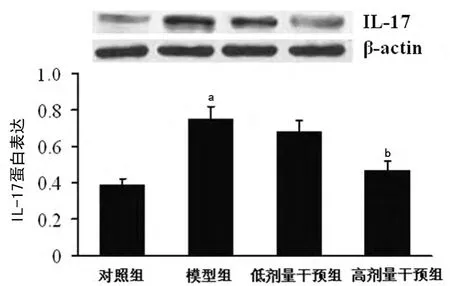
图3 各组小鼠心肌IL-17蛋白表达比较
2.5 黄芪甲甙对心肌组织IL-6、TNF-α水平的影响 ELISA检测结果显示,模型组心肌组织中IL-6、TNF-α水平显著高于对照组(P<0.01);经高剂量黄芪甲甙处理后,IL-6、TNF-α水平较模型组明显降低(P<0.05),但低剂量黄芪甲甙对上述指标无影响(P>0.05),见图4、5。
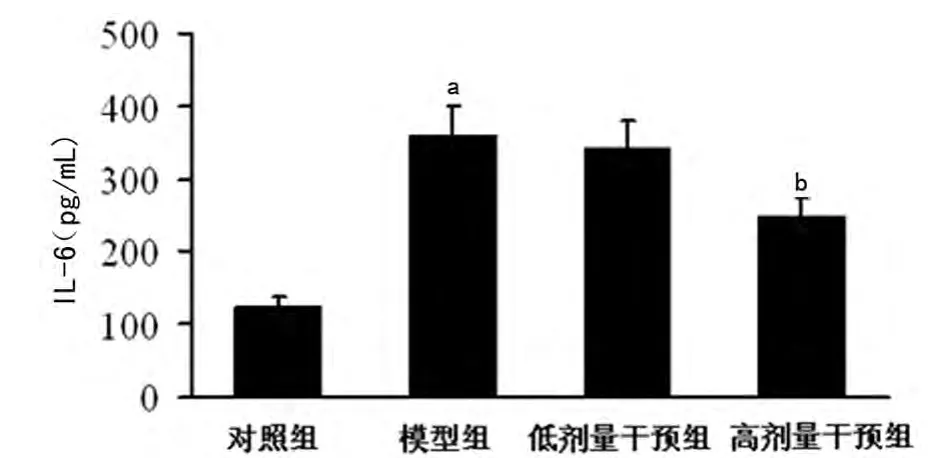
图4 各组小鼠心肌IL-6水平比较
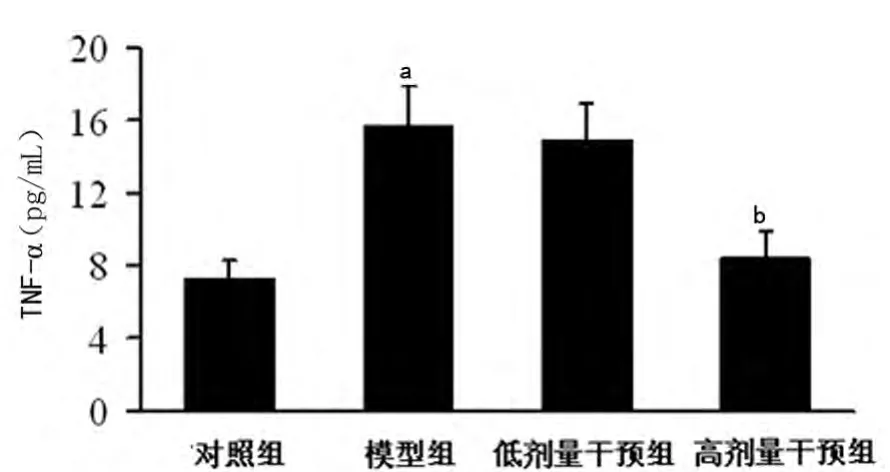
图5 各组小鼠心肌TNF-α水平比较
3 讨 论
IL-17是Th17细胞分泌的特征性因子,由155个氨基酸组成,相对分子质量为3×103,N端为19~23个氨基酸残基组成的信号多肽,其基因定位于染色体2q31。近年研究发现,IL-17是一种强大的前炎症因子,可诱导中性粒细胞的发育和成熟,并能刺激T细胞、成纤维细胞、巨噬细胞、上皮细胞分泌多种炎症介质,如IL-1、IL-6、IL-8、TNF-α、一氧化氮合酶2、单核细胞趋化蛋白-1、生长调节因子α、金属蛋白酶及化学增活素等,从而诱导炎症反应[8]。Yuan等[9]报道,Th17细胞及血清IL-17水平在急性VMC患者中升高。Chang等[10]在心肌肌球蛋白诱导的实验性自身免疫性心肌炎中发现,心脏组织中IL-17、IL-17受体、IL-23表达均增加,其中以IL-17增加最为明显。有研究表明,IL-17在VMC小鼠心肌组织中表达显著升高,并且与心肌病变程度呈正相关[7]。本研究结果显示,在正常小鼠心肌组织中存在低水平的IL-17表达,当小鼠感染CVB3后,IL-17的表达量显著升高,与文献[7]报道一致,表明在生理条件下组成性表达的IL-17可能参与维持心脏结构与功能的平衡,而CVB3感染所致的IL-17过表达可能与VMC的发生、进发展密切相关。因此,抑制IL-17的表达及其介导的炎症反应可能成为治疗VMC的一个潜在的、有价值的靶点。
黄芪为一传统中药,具有补气升阳、益卫固表、利尿消肿、托毒生肌、益气理虚、伏正固本之功效。黄芪甲甙是黄芪注射液中的主要有效成分,它是一种黄芪皂甙类单体成分。众多实验不但发现其对实验性VMC动物模型疗效较好,而且已初步阐明其机制:抗病毒作用;抗心肌细胞凋亡作用[11];下调心肌柯萨奇-腺病毒受体表达,从而减少CVB3对心肌细胞的亲和力[12];抑制心肌细胞L型钙通道电流及钙超载[10]。然而,这种药物抗VMC的机制仍未完全阐明。本研究中,VMC小鼠给予高剂量黄芪甲甙干预治疗后,小鼠死亡率、HW/BW、炎症细胞浸润与心肌坏死病理积分降低,IL-17mRNA和蛋白表达水平显著下调,而低剂量黄芪甲甙干预治疗则无此作用,提示黄芪甲甙对VMC有良好的治疗作用,其机制可能与抑制IL-17表达有关。
炎症因子IL-6、TNF-α过表达在VMC的发生、发展中起重要作用。已有研究证实IL-17能促进IL-6、TNF-α分泌。Yang等[13]报道,腹腔注射IL-17单克隆抗体阻断IL-17的作用,可以明显改善VMC小鼠心肌病变程度,并下调心肌组织中IL-6、TNF-α的表达水平。为了进一步探讨黄芪甲甙治疗VMC的机制,作者通过ELISA检测了心肌组织IL-6、TNF-α水平,发现模型组心肌组织中IL-6、TNF-α水平显著高于对照组,经高剂量黄芪甲甙处理后,IL-6、TNF-α水平较模型组明显降低,提示黄芪甲甙对VMC的治疗作用可能与其抑制IL-17介导的炎症反应有关。
综上所述,本研究结果表明IL-17在VMC小鼠心肌组织中表达升高,提示IL-17可能参与了VMC的发病过程,黄芪甲甙对VMC治疗作用较好,这种作用可能与其抑制IL-17介导的炎症反应有关,可为黄芪甲甙的进一步开发应用打下基础。
[1]Shauer A,Gotsman I,Keren A,et al.Acute viral myocarditis:current concepts in diagnosis and treatment[J].Isr Med Assoc J,2013,15(3):180-185.
[2]Miossec P,Kolls JK.Targeting IL-17and TH17cells in chronic inflammation[J].Nat Rev Drug Discov,2012,11(10):763-776.
[3]梁妍琰,丁海涛,朱华.T辅助细胞17及白介素-17与心肌炎的相关性研究[J].临床儿科杂志,2013,31(2):151-153.
[4]Nindl V,Maier R,Ratering D,et al.Cooperation of Th1 and Th17cells determines transition from autoimmune myocarditis to dilated cardiomyopathy[J].Eur J Immunol,2012,42(9):2311-2321.
[5]李双杰,张召才,陈瑞珍,等.黄芪甲甙治疗Balb/c小鼠CVB3病毒性心肌炎疗效研究[J].中华实用中西医杂志,2004,17(5):681-683.
[6]Yu XH,Li SJ,Chen RZ,et al.Pathogenesis of coxsackievirus B3-induced myocarditis:role of macrophage migration inhibitory factor[J].Chin Med J(Engl),2012,125(1):50-55.
[7]Yang F,Wu WF,Yan YL,et al.Expression of IL-23/Th17pathway in a murine model of Coxsackie virus B3-induced viral myocarditis[J].Virol J,2011,142(2):301-309.
[8]Chiricozzi A,Zhang S,Dattola A,et al.Role of Th17in the pathogenesis of cutaneous inflammatory diseases[J].J Biol Regul Homeost Agents,2012,26(3):313-318.
[9]Yuan J,Cao AL,Yu M,et al.Th17cells facilitate the humoral immune response in patients with acute vival myocarditis[J].J Clin Immunol,2010,30(2):226-234.
[10]Chang H,Hanawa H,Yoshida T,et al.Alteration of IL-17related protein expression in experimental autoimmune myocarditis and inhibition of IL-17by IL-10-Ig fusion gene transfer[J].Circ J,2008,72(5):813-819.
[11]李双杰,杜九中,于小华,等.黄芪甲甙对病毒性心肌炎细胞凋亡作用的研究[J].南华大学学报:医学版,2004,32(1):17-19.
[12]于小华,张新刚,李双杰,等.黄芪甲甙对病毒性心肌炎小鼠心肌柯萨奇-腺病毒受体基因表达的影响[J].实用儿科临床杂志,2005,20(3):215-217.
[13]Yang F,Wu WF,Yan YL,et al.Treatment with a neutralizing anti-murine interleukin-17antibody after the onset of coxsackievirus b3-induced viral myocarditis reduces myocardium inflammation[J].Virol J,2011,142(17):1449-1453.

