心室电传导模型的心律失常机制仿真分析
宋俊雅,袁永峰,王宽全
(哈尔滨工业大学计算机科学与技术学院,150001哈尔滨)
据世界卫生组织统计[1],非传染性疾病引起的死亡48%归因于心血管疾病,我国每年死于心血管疾病的约300万人,平均每小时心血管病死亡340人,成为危害国民健康的第一杀手.心律失常是心血管疾病中最为常见的病症之一,长期心律失常不仅会导致严重的心脏病,甚至可能导致患者猝死,对人们的健康造成了严重威胁[2].心律失常的发生主要是由心肌兴奋冲动的形成异常和传导异常,或二者兼有所引起的.20世纪90年代后期大量的临床和实验室研究[3]发现浦肯野氏纤维(purkinje fiber,PF)细胞是最易于发生心律失常的细胞,在许多情况下它是严重室性心律失常发生的源头.浦肯野氏纤维细胞的动作电位间期(action potential duration,APD)远大于心室肌细胞的动作电位间期.存在如此大差异的两种细胞在结合时通常会造成很大的问题,但有研究表明:浦肯野氏纤维细胞和心室肌细胞在耦合连接时,由于细胞间的间隙连接,它们的动作电位都会发生变化,从而使得二者的动作电位间期彼此接近.因此,浦肯野氏纤维与心室肌的耦合问题成为了当前学术领域研究心室电传导过程的重要对象[4-6].
目前,由于实验条件的限制,很难直接从动物模型角度来研究浦肯野氏纤维与心室肌的耦合作用.随着电生理实验技术和数据的丰富,越来越多心肌细胞电生理计算模型被开发出来并大量应用到心脏生理机制的研究当中.O.V.Aslanidi等[5-9]分别建立了包括浦肯野氏纤维网络结构的心室电传导模型,但至今没有一个此类模型与心电图仿真相结合,来讨论分析心室电传导的相关问题.因此,本文建立一个浦肯野氏纤维和心室组织耦合的理想化的二维心室电传导模型,以此来模拟正常、异常情况下的心室组织电兴奋传导过程、细胞的动作电位形态以及伪心电图,并用于分析不同心率下对浦肯野氏纤维细胞对心室组织电兴奋传导的影响.
1 心室电传导模型的建立
1.1 二维心室电传导模型
为了分析、研究不同的心脏节律对心室组织电兴奋传导的影响,本文参照文献[5]提出的犬类浦肯野氏纤维-心室组织模型的结构,结合P.Stewart等[10]提出的人类浦肯野氏纤维细胞模型和文献[3]提出的人类心室细胞模型(TNNP模型)建立了理想化的二维人类心室电传导模型.该模型由一条浦肯野氏纤维与一块心室肌透壁切片组织耦合连接组成(如图1所示),其中,浦肯野氏纤维宽约2.25 mm(15个细胞),长约45 mm(300个细胞),如图1中PF区域所示.心室透壁切片组织宽约60 mm(400个细胞),长约15 mm(100个细胞),如图1中VM区域所示.由于心室肌细胞沿透壁方向的电特性非均匀性的特点,根据文献[11]将心室组织从内到外分为3种类型细胞:心内膜细胞(ENDO)、中间层细胞(M)和心外膜细胞(EPI),其比例为25∶35∶40.在距心室外壁2 cm处放置虚拟电极,计算整个模型的电势场变化,并模拟仿真心电图.
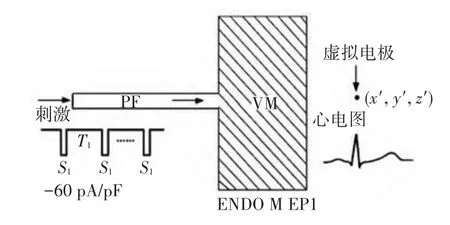
图1 二维心室电传导模型示意图
1.2 多细胞电生理计算模型
心室组织电兴奋过程可以用非线性反应-扩散方程来描述,具体方程为
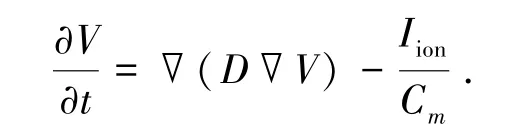
式中:V为跨膜电压,mV;t为时间,ms;∇为空间梯度算子;D是扩散系数,mm2·ms-1,该系数用来建模通过间隙连接形成的细胞间的电耦合;Cm为细胞膜电容,pF;Ⅰion为跨膜离子电流的总和,pA;∇(D∇V)为扩散项,它描述电兴奋通过细胞间隙连接形成电耦合在心室组织内传导;-Ⅰion/Cm为反应项,它描述由电兴奋引起的单个细胞内各种离子通道电流变化以及动作电位变化.
对于浦肯野氏纤维细胞模型,本文采用的是文献[10]的模型,浦肯野氏纤维细胞的跨膜总离子电流的包括
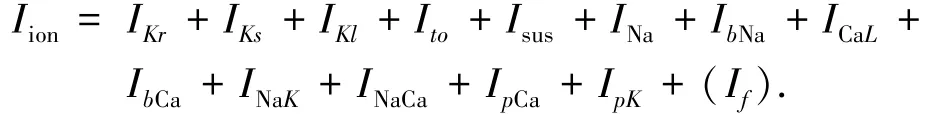
式中:超极化激活的阳离子通道电流Ⅰf被认为与浦肯野氏纤维细胞的自律性有关,即在没有刺激的情况下,浦肯野氏纤维细胞本身能够有节律的产生电兴奋.对于心室模型,本文修改了文献[9]提出的TNNP模型.结合ⅠNaL最新的实验数据,在TNNP模型中加入ⅠNaL电流[12],将其ⅠKr通道的电导率Gks,按照文献[11]提出的比例作了调整,由原来的0.245nS/pF调整为0.149nS/pF,其他数据均与TNNP模型的数据保持一致.
心室肌细胞的跨膜离子电流的总和的具体描述为
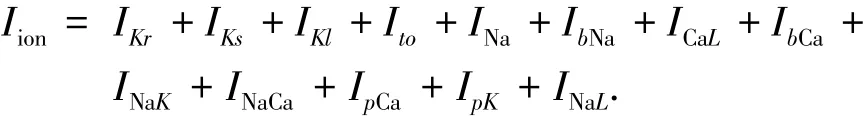
1.3 伪心电图的计算
心电图(electrocardiogram,ECG)由心脏所有单个心肌细胞的电激动集合起来且在体表能够记录到的电信号,组成一组连续的曲线图(包括P、QRS、T、U波,如图1中心电图所示),是临床上用于判断心脏疾病的重要依据,心脏正常情况下,QRS波群的宽度为0.06~0.08s,QT间期为0.32~0.44s.本文主要是参照K.Gima等[13]所采用的方法来计算人的伪体表心电图,细胞外间隙的一个场点(x′,y′,z′)的单极电势可以通过对跨膜电压的空间梯度进行积分得到
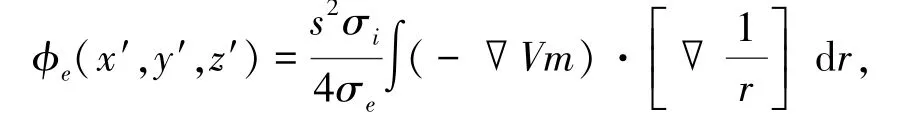
式中:∇Vm为跨膜电压Vm的空间梯度;s为2aWVM(其中:a为细胞的半径,WVM为心室组织的长度);σe、σi分别为细胞外和细胞内的电导率;r为从“源”点(x,y,z)到场点(x′,y′,z′)的距离;.ϕε(x′,y′,z′)为电极处电势.本模型中将虚拟电极(x′,y′,z′)放在模型右侧中间距离心外层细胞2cm处(如图1所示),并假设细胞内外电导率处处相等.
1.4 数值计算方法
在对本模型进行仿真计算时,采用前向欧拉的方法对式(1)进行数值计算,具体计算方法为
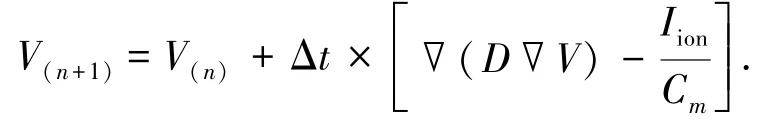
设置时间步长Δt为0.02 ms,空间步长为0.15 mm,对理想化二维心室电传导模型最左端浦肯野氏纤维起始处对模型施加一组(30~50个)周期长度(cycle length,CL)可变的S1刺激(称动态电流刺激法),刺激强度为-60pA/pF,如图1中所加的刺激所示.本模型的仿真时间为30个周期,在每个周期的第10ms施加刺激,刺激持续时间为1ms.
2 结果与分析
根据临床心电图诊断标准,健康成人的心率是60~100次/分,平均约75次/分,当心率大于100次/分时,称为心动过速,当心率小于60次/分时,称为心动过缓.为了分析心动过速、正常以及心动过缓时浦肯野氏纤维与心室肌的耦合对心室组织电兴奋传导的影响,本文依照健康成人的心率范围(不考虑性别、年龄等因素对心率的影响),设置刺激周期分别为300、375、800、2000 ms,对应的心率分别为200、160、75、30次/分.其中,为了讨论心率过快和极快时心室组织的电兴奋传导情况,因此,本文在讨论心动过速的情况时采用刺激周期为375ms和300ms两种情况下的实验结果.
考虑到模型是由非线性方程构成,因此本文都选取第25个周期之后(模型达到稳定状态)的实验结果进行讨论分析.
2.1 正常情况下电兴奋传导
设置刺激周期为800ms,对模型进行仿真,结果显示,在每一个周期内心室组织都能够完全复极,电兴奋正常传导(如图2所示),其中,图2(a)、(b)、(c)分别表示第30个周期心室组织去极化、慢速复极化以及快速复极化过程中某一时刻的电兴奋传导情况,图2(d)表示心室组织复极化完成后的状态.图3显示了Ⅰf电流存在和缺失两种情况下,第28~30个周期浦肯野氏纤维细胞的动作电位,从图3中可以看出,在一个周期之内,浦肯野纤维细胞复极化完成之后,当Ⅰf电流存在时,浦肯野氏纤维细胞具有自律性,其动作电位的值逐渐增大,而当Ⅰf电流缺失时,其动作电位的值保持不变.图4显示了Ⅰf电流存在和缺失两种情况下第30个周期细胞的动作电位和与其对应的心室组织的伪心电图关系,图4(a)和图4(c)分别表示Ⅰf电流存在时第30个周期细胞的动作电位和心室组织的伪心电图,由图可以看出,心外层细胞最先完成复极的时刻对应仿真的伪心电图T波的波峰,中间层细胞最后完成复极的时刻对应伪心电图T波的结束[13](图4中垂直的黑色虚线所示,由于细胞开始去极化的时间与细胞位置密切相关,因此,二者的对应关系存在一定偏差),进而形成了正向的T波,同理可以说明Ⅰf电流缺失时细胞动作电位和心室组织伪心电图的对应关系(如图4(b)、(d)所示).通过对Ⅰf电流存在和缺失两种情况下心室肌细胞的动作电位和心室组织的伪心电图进行对比分析可知,两种情况下心室肌细胞去极化开始的时间和复极化完成所需要的时间基本一致,并且所对应的伪心电图的波形的差别也非常小,通过计算,伪心电图的QT间期均约为0.4s,QRS波群的宽度约为0.08s,二者均属于临床上心电图正常值范围,并且心率齐整(75次/分).因此得出心脏正常情况下浦肯野氏纤维的自律性对心室组织电兴奋传导的影响不大.
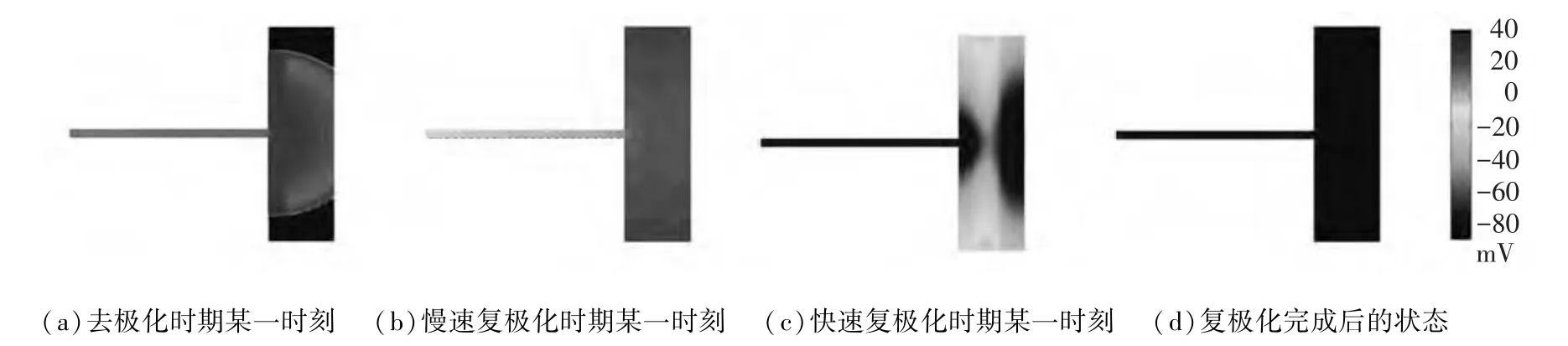
图2 正常情况下,心室组织电兴奋传导过程
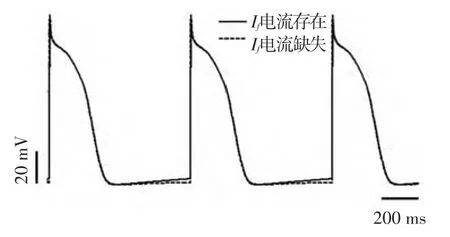
图3 正常情况下,浦肯野氏纤维细胞的动作电位
2.2 心动过速情况下电兴奋传导
设置刺激周期分别为375ms和300 ms,模拟两种心动过速情况下心室组织电兴奋的传导过程.当刺激周期为375ms时,第28~30个周期细胞的动作电位和对应的心室组织的伪心电图如图5所示,由图5(a)可知,一个周期之内,浦肯野氏纤维细胞不能够完全复极,Ⅰf电流存在和缺失两种情况下浦肯野氏纤维细胞的动作电位仅有细微差别,通过对比分析图5(b)和图5(c)可以看出,两种情况下心室肌细胞的动作电位也基本一致,因此,两种情况下仿真得到心室组织的伪心电图也大致相同(如图5(d)所示).并且根据伪心电图的波形进行计算可得,心率齐整(160次/分)、QRS波群的宽度约为0.09s,QT间期为0.37s,相比正常情况下仿真得到的伪心电图的QRS波群稍有增宽,并且与上一心搏的T波相混,出现了临床上心动过速时的心电图特征.
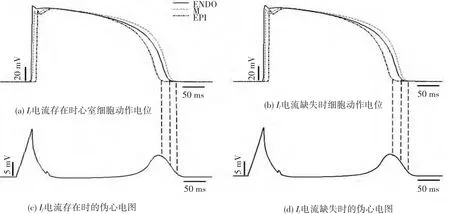
图4 正常情况下,心室各类细胞的动作电位和心室组织伪心电图关系
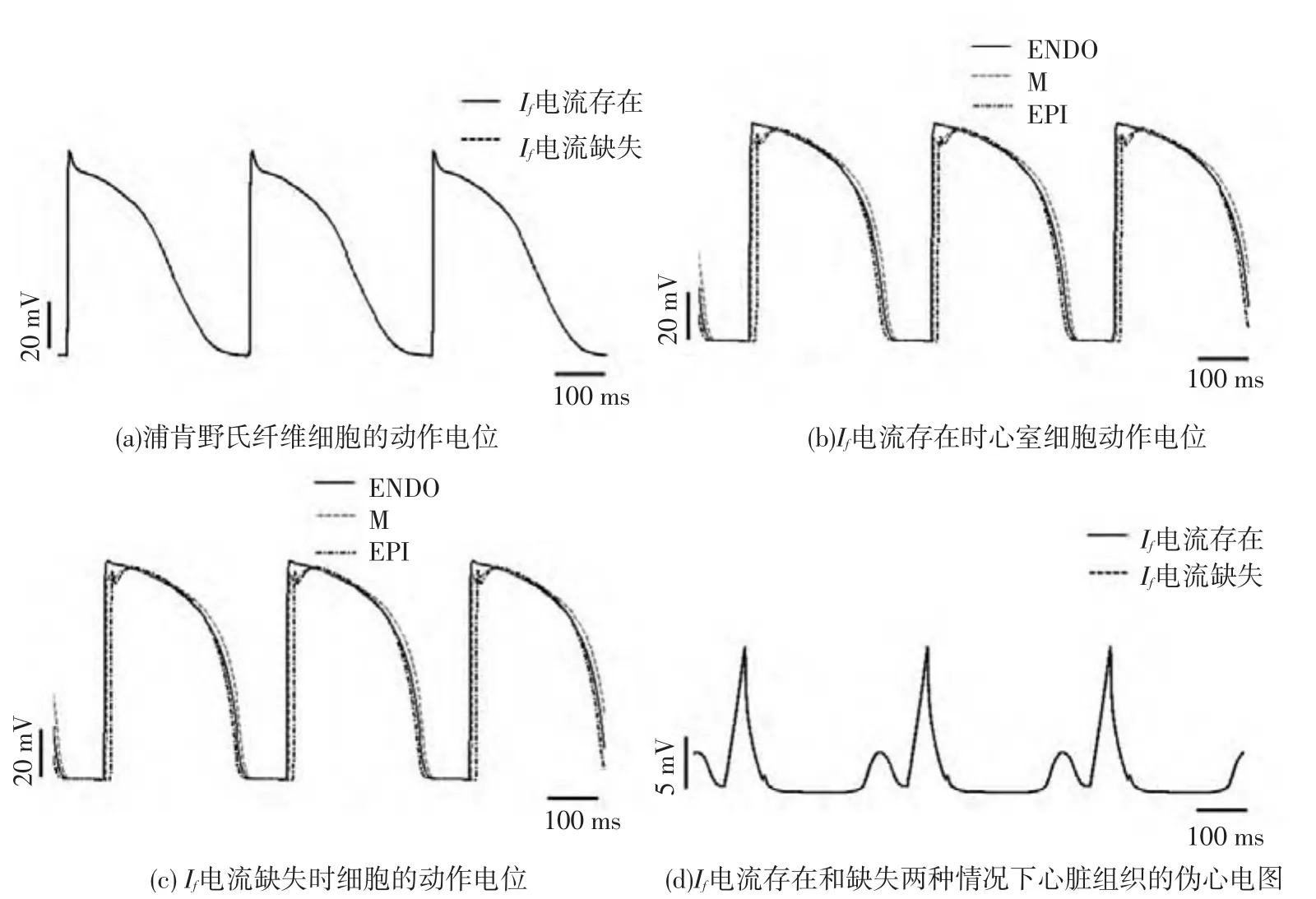
图5 心动过速情况下(CL=375 ms),细胞的动作电位和心室组织的伪心电图
图6显示了刺激周期为300 ms时,第26~30共5个周期中细胞的动作电位和对应的心室组织的伪心电图,其中每幅子图中倒置的矩形波表示每个周期中施加刺激的时间.从图6中可以看出,在此期间共施加了5次刺激,然而从图6中兴奋波的数目可以看出,各类细胞在此期间仅兴奋了3次,有2次刺激心室组织并没有响应,并且在第30个周期结束时细胞没有完全复极(如图6(a)、(b)、(c)所示),从而仿真得到如图 6(d)所示的心室组织的伪心电图.通过计算,此时心率整齐(约100次/分),QT 间期为 0.396 s,QRS 波群的宽度为0.076 s,二者均属于临床正常心电图值的范围.通过对比分析,Ⅰf电流存在和缺失情况下细胞的动作电位以及对应的伪心电图波形情况发现,浦肯野氏纤维的自律性对电兴奋的传导影响不大.但是由于浦肯野氏纤维细胞的动作电位不应期较长,细胞不能够响应快速的兴奋传导,会出现漏停现象,进而恢复正常心脏节律.
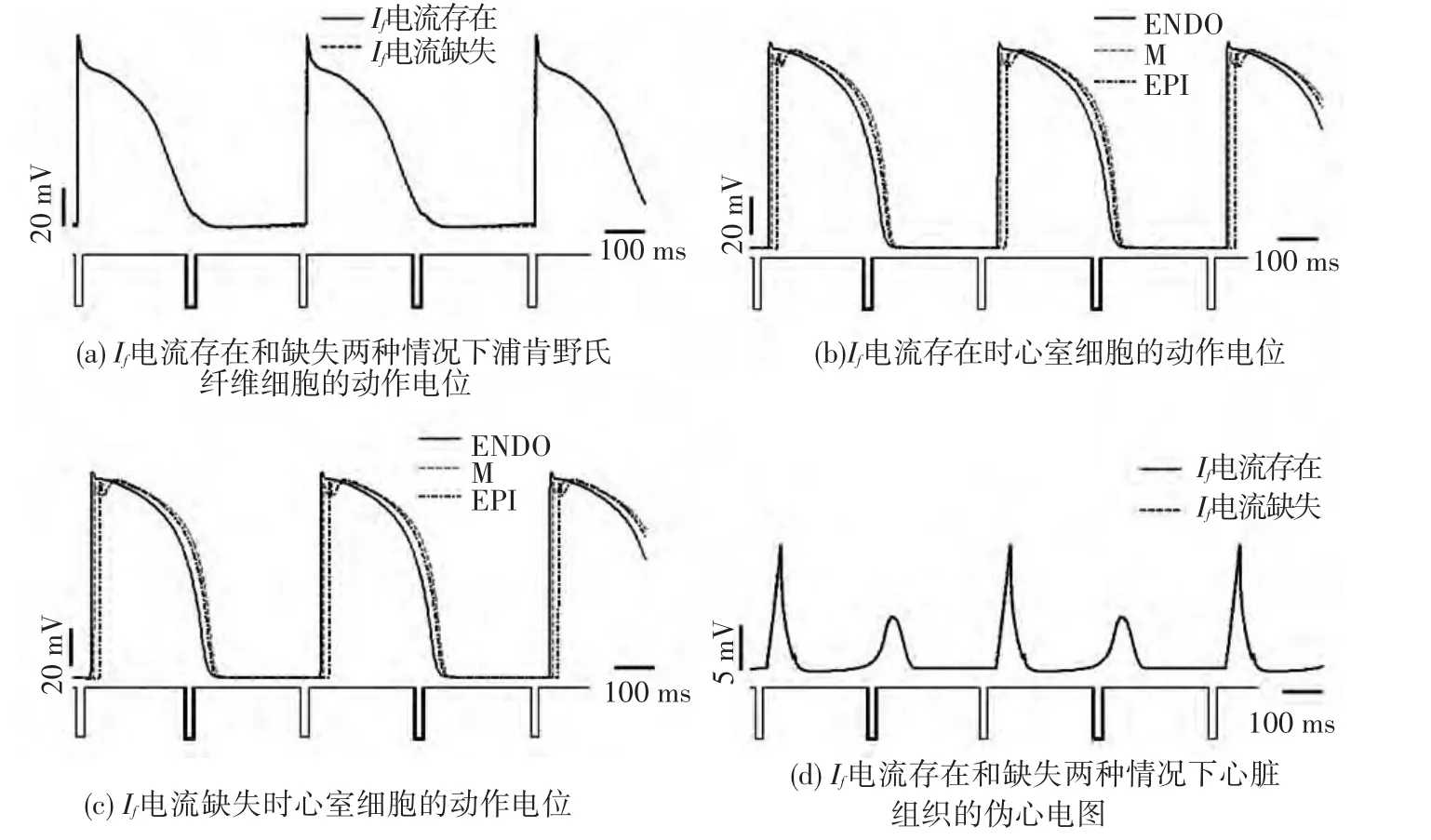
图6 心动过速情况下(CL=300 ms),细胞的动作电位和心室组织的伪心电图
2.3 心动过缓情况下电兴奋传导
设置刺激周期为2000 ms时,模拟人体心动过缓时电兴奋传导情况.结果显示,在每个周期内,心室组织都能够完全复极,Ⅰf电流存在和缺失两种情况下第28~30个周期各细胞的动作电位和对应的心室组织的伪心电图(如图7所示).在一个周期之内,浦肯野氏纤维细胞复极完成之后,由于其自律性,在下一周期施加的刺激到达之前,细胞的动作电位值逐渐增大至细胞兴奋的阈上刺激,产生电兴奋(如图7(b)中所示),该电兴奋经过传导,引起心室肌细胞的兴奋(如图7(d)所示),进而使得整个心室组织兴奋,因此仿真得到的心室组织的伪心电图在相邻两个周期之间,比Ⅰf电流缺失时多一次兴奋(如图7(f)中所示),而当Ⅰf电流缺失时,则不会出现此现象(如图7(a)、(c)、(e)所示).通过对伪心电图进行计算,发现二者QRS波群的宽度和QT间期仅存在细微差别,QT间期约为0.4 s,QRS波群的宽度约为0.08 s,但当Ⅰf电流缺失时,心率齐整,为30次/分;当Ⅰf电流存在时,心率约为60次/分.即心动过缓时,由于浦肯野氏纤维细胞的自律性,超极化激活的阳离子通道电流Ⅰf缓慢而持续内流引起浦肯野氏细胞去极化产生代偿性兴奋传导,进而维持心脏有较高节律的跳动.
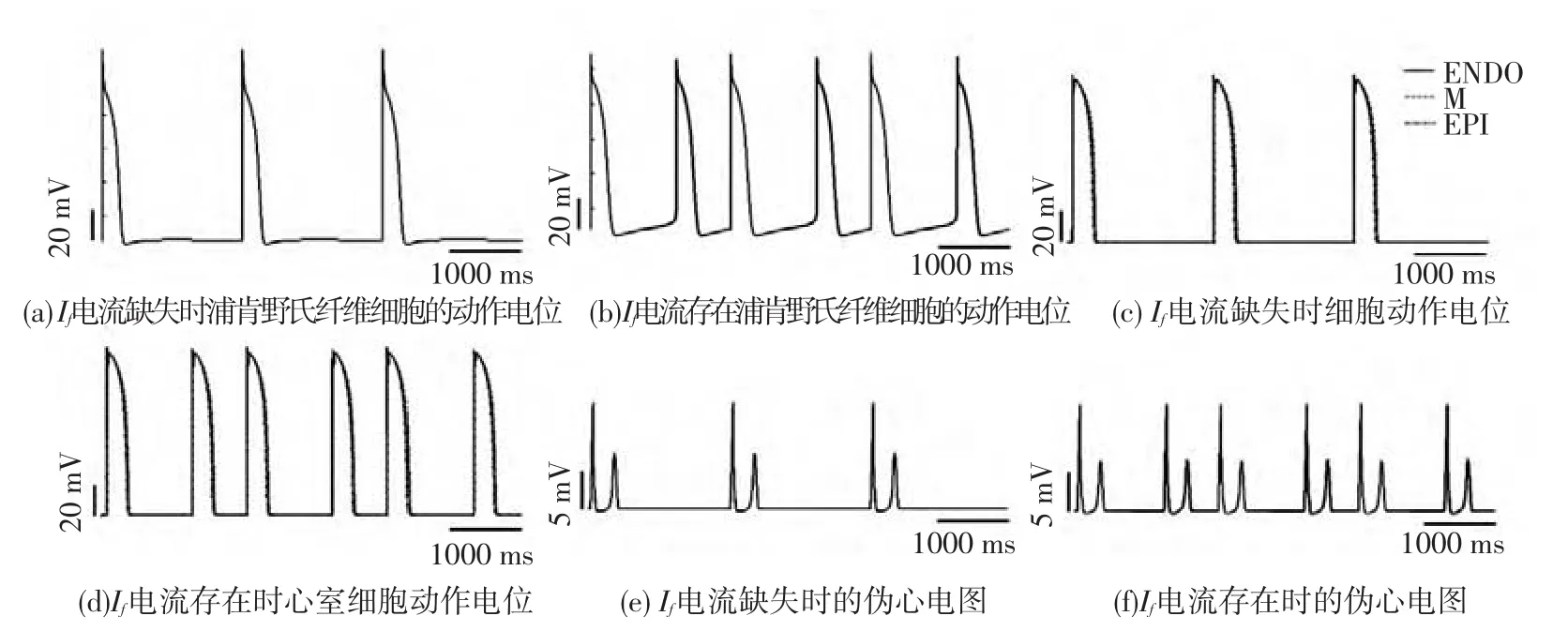
图7 心动过缓情况下,细胞的动作电位和心室组织的伪心电图
3 结 论
1)基于该计算模型模拟了不同心率(正常、心动过速、心动过缓)下心室电传导过程.通过对仿真得到的细胞动作电位与伪心电图分析,本文发现正常情况下,浦肯野氏纤维细胞的Ⅰf对心室组织电兴奋传导影响不大,电兴奋正常传导,得到正常形态的伪心电图.心动过速时,浦肯野氏纤维细胞不能充分复极,导致QRS波群稍有增宽,并且与上一心搏的T波相混,出现临床心动过速时的心电图特征,但是当心率快到一定程度时,由于浦肯野氏纤维细胞较长动作电位不应期的作用不能够响应快速的兴奋传导,会出现漏停现象,进而恢复正常心脏节律.心动过缓时,由于浦肯野氏纤维细胞的自律性,超极化激活的阳离子通道电流Ⅰf缓慢而持续内流引起浦肯野氏细胞去极化产生代偿性兴奋传导,进而维持心脏有较高节律的跳动.综上所述,本模型仿真研究发现虽然浦肯野氏纤维细胞会产生心动过速的电兴奋传导,但也可以抑制极慢或者极快的电兴奋,对心室组织维持正常节律起到重要的保护作用.
2)本模型的研究不仅能够使得人们更加深入的了解浦肯野氏纤维和心室肌耦合对心室组织电兴奋传导的影响,也可以在此基础之上进一步开展先天性基因变异诱发心律失常的机制以及药物抗心律失常作用效果等研究,具有很大的实践意义.
[1]World Health Organization.World Health Statistics 2012[R].WHO, 2012.
[2]杨宝峰,蔡本志.心律失常发病机制研究进展[J].国际药学研究杂志,2010,37(2):81-88.
[3]Ten TUSSCHER K H W J, PANFILOV A V.Modelling of the ventricular conduction system [J].Progress in Biophysics and Molecular Biology, 2008, 96(1/3):152-170.
[4]HUELSING D J,SPITZER K W,Cordeiro J M,et al.Modulation of repolarization in rabbit Purkinje and ventricular myocytes coupled by a variable resistance[J].American Journal of Physiology, 1999, 276(2):H572-581.
[5]ASLANIDI O V, STEWART P, BOYETT M R, et al.Optimal velocity and safety of discontinuous conduction through the heterogeneous purkinje-ventricular junction[J].Biophysical Journal, 2009, 97(1): 20-39.
[6]ATKINSON A,INADA S,LI Jue,et al.Anatomical and molecular mapping of the left and right ventricular His-Purkinje conduction networks [J].Journal of Molecular and Cellular Cardiology, 2011, 51(5): 689-701.
[7]SIMELIUS K, NENONEN J, HORACEK M.Modeling cardiac ventricular activation [J].International Journal of Bioelectromagnetism, 2001, 3(2):51-58.
[8]VIGMOND E J, CLEMENTS C.Construction of a computer model to investigate sawtooth effects in the Purkinje system[J].IEEE Transactions on Bio-Medical Engineering, 2007, 54 (3):389-399.
[9]Ten TUSSCHER K H W J, NOBLE D, NOBLE P J, et al.A model for human ventricular tissue [J].American Journal of Physiology-Heart and Circulation Physiology,2004, 286(4):H1573-1589.
[10]STEWART P, ASLANIDI O V, NOBLE D, et al.Mathematical models of the electrical action potential of Purkinje fibre cells [J].Royal Society Publishing,2009, 367(1896): 2225-2255.
[11]ZHANG Henggui, HANCOX J C.In silico study of action potential and QT interval shortening due to loss of inactivation ofthe cardiac rapid delayed rectifier potassium current [J].Biochemical and Biophysical Research Communications, 2004, 322(2): 693-699.
[12]YUAN Yongfeng, WANG Kuanquan, KHARSCHE S,et al.Vulnerability to re-entry arising from LPC-induced alterations ofcardiac sodium currentkinetics: a simulation study [C]//Proceedings of the Computing in Cardiology.Hangzhou: EMB, 2011:653-656.
[13]GIMA K, RUDY Y.Ionic currentbasis of electrocardiographic waveforms: a model study [ J].Circulation Research, 2002, 90(8):889-896.
——从一道浙江选考生物学试题谈起

