海藻糖和氨基酸之间相互作用的分子动力学模拟
白 姝 常 颖 刘小娟 刘夫锋,*
(1天津大学化工学院生物工程系,系统生物工程教育部重点实验室,天津300072;2天津化学化工协同创新中心,天津300072)
1 引言
海藻糖是自然界生物体普遍存在的一种非还原性二糖,它是由两分子吡喃环葡萄糖通过α,α-1,1糖苷键连接形成,化学性质非常稳定.1,2海藻糖具有不同于其它双糖的独特而卓越的生物学保护特性,其能够在极端恶劣(高温、极端pH、高渗透压和干燥等)的条件下有效地保护生物大分子结构不被破坏,从而维持生物体的生命过程.3-6因此,海藻糖常作为蛋白质药物、酶等生物大分子的高效稳定剂.7-9此外,海藻糖还可以抑制折叠中间体的聚集沉淀从而作为蛋白质复性添加剂用于蛋白质的复性领域.10
虽然海藻糖已广泛应用于蛋白质折叠和聚集的研究领域,11,12但关于海藻糖与生物大分子之间的相互作用机理尚存在很多争议.目前主要有以下三种假说来解释海藻糖与生物大分子之间的作用机制:玻璃态假说,水替代假说和优先排阻假说.13,14玻璃态假说认为在极端条件下海藻糖易于在蛋白质周围形成玻璃态,从而起到保护蛋白质不被极端环境损害.15而水替代假说却认为在恶劣环境下海藻糖能够替代蛋白质周围的水分子并和蛋白质之间形成大量的氢键,从而保护蛋白质的结构和功能.16与之相反,优先排阻假说却认为蛋白质不直接与海藻糖发生相互作用,而是优先与水结合,从而使海藻糖分子从蛋白质的溶剂化层中排阻.因此,相对溶液主体,蛋白质表面水分子增多而海藻糖减少,使得生物大分子周围的海藻糖浓度比溶液中的低,从而使蛋白质优先水化,其表面张力增加,化学势升高,是热力学不利的过程.进一步研究表明,其化学势的增加与蛋白质的溶剂暴露区域成正比.由于变性态的蛋白质所暴露的溶剂面积更大,因此海藻糖分子的加入使变性态蛋白质的化学势升高的程度相比自然状态的更大.从而使天然态蛋白质结构在海藻糖溶液中更稳定.优先排阻学说是目前最被大家所接收的一种假说.
为了从原子和分子角度上解析海藻糖稳定蛋白质的作用机理,本研究选择常见的20种氨基酸为目标分子,利用全原子分子动力学模拟解析海藻糖与20种常见氨基酸之间的相互作用.众所周知,蛋白质都是由20种常见氨基酸通过肽键连接起来的.当海藻糖与蛋白质的残基发生相互作用时,这些残基的N和C端都与它们相邻的氨基酸连接.因此,为了与实际情况类似,本研究将20种常见氨基酸的两端都用最简单的氨基酸——甘氨酸封闭,从而形成三肽分子.但在海藻糖和水分子与氨基酸残基作用分析过程中,本文仅分析了海藻糖和水与中间残基氨之间的相互作用.希望如此处理可以使解析出的海藻糖和氨基酸之间的作用机理更具有代表性.此外,相对于利用整个蛋白质为目标分子,这样处理还可以排除蛋白质的序列和结构(如二级结构和三级结构)对海藻糖和残基之间作用的影响.本研究首先计算了海藻糖与水和这些氨基酸之间的接触数来衡量海藻糖同极性、疏水性残基、肽骨架或氨基酸侧链之间的相互作用.并根据模拟数据计算得到了海藻糖与这些氨基酸之间的接触系数CTW.最后,计算了海藻糖分子或水分子同氨基酸残基间氢键键能.
2 计算方法
2.1 体系构建
海藻糖分子的三维结构文件从GlycoSciences数据库(http://www.glycosciences.de/)中获得,其化学结构式和三维模型如图1所示.本研究中使用的海藻糖的力场参数(包括原子的电荷)选用文献17中报道的参数.而所有三肽(GXG,其中X代表常见的20种氨基酸)的初始构象均利用SYBYL软件中的Biopolymer/Build模块构建.
首先将三肽放入一个立方体盒子(6 nm×6 nm×6 nm)中,然后将10个海藻糖分子随机放入该盒子,并与三肽保持一定的距离.随后将盒子中加满水,并去除与三肽或海藻糖重叠的水分子.采用三次能量最小化模拟优化该体系:首先,固定三肽和海藻糖分子的结构和位置不变,仅让水分子的结构和位置发生变化;其次,仅固定三肽分子的结构和位置,使海藻糖和水分子的结构和位置发生变化;最后,使所有的分子都可以自由运动.表1所示为三肽在海藻糖溶液中模拟系统的详细信息.

图1 海藻糖结构式Fig.1 Structure of trehalose
本研究中海藻糖溶液的浓度为0.07 mol·L-1,海藻糖浓度的选择主要基于作者早期的研究结果.18在利用分子动力学(MD)模拟研究海藻糖对多肽构象转换的结果表明海藻糖溶液浓度对多肽的构象转换影响很大.当多肽在0.07 mol·L-1浓度的海藻糖溶液中,海藻糖分子能够促进多肽的构象转换,而在较高浓度的海藻糖溶液中,反而会抑制多肽的构象转换.基于此,本研究中海藻糖溶液的浓度也选择了0.07 mol·L-1.由于本模拟中盒子体积和海藻糖分子个数固定不变,而短肽的体积是变化的,因此盒子中水分子的数量是不相同的.例如,Gly体系中水分子数量最多为6989,而Leu和Glu体系中水分子最少为6981.其他体系中水分子的个数均介于它们之间.从这些数据可以看出,水分子数量的差别很小,仅约为模拟体系中水分子的0.1%.此外,相对于三肽的体积来说,盒子体积足够大.因此,氨基酸与水分子和海藻糖分子之间的接触数主要由氨基酸的物理化学性质(如,疏水性和带电性等)所决定.综上所述,我们认为模拟体系中水分子数量的微小差别(小于0.1%)对海藻糖和水分子与氨基酸之间的接触数基本没有影响.

表1 模拟系统的参数Table 1 Parameters of simulation systems
2.2 体系构建
本研究采用GROMACS 4.0.5分子动力学模拟软件,19水分子采用SPC模型,20GROMOS 96力场用来描述体系内分子之间的势能.21范德华作用利用Lenard-Jones函数来计算,非键截断距离设定为1.4 nm,非键作用原子列表每4个步长更新一次;采用LINCS算法对形成有化学键的原子之间的相对距离进行固定.22长程静电相互作用利用PME方法进行计算,23格点宽度设为0.12 nm;采用Verlet蛙跳算法对每一步的运动方程进行求解,经过积分得到新的时刻各原子的坐标,步长设为2 fs.在计算过程中采用周期性边界条件对于利用有限的计算单元模拟溶液系统,消除边界条件是必要的.所有MD模拟均在等温等压系综下进行,温度为300 K,通过vrescale方法24控制温度,时间常数设为0.1 ps.压力为1.01×105Pa,压力控制采用Berendsen方法,压力耦合常数为0.5 ps.所有分子动力学模拟计算均在曙光TC2600刀片服务器(每刀片包括4路4核的AMD Opteron 8347HE CPU和8G内存)上完成(Dawning,中国天津).
2.3 模拟分析
2.3.1 接触数
接触数是指分子间发生作用的原子接触个数,该参数常被用来表征两分子之间相互作用的强弱.25本研究中分子之间的接触数由GROMACS软件自带的g_mindist程序完成.当两个原子间的间距小于0.35 nm时,才认为原子间相互接触,视作一个接触数.
2.3.2 接触系数
由于这20种氨基酸含有不同的原子个数,因此模拟系统中海藻糖和水分子原子总数差异较大,因此为了准确量化每种氨基酸分子同海藻糖或水分子结合作用的相对大小,本研究又定义了氨基酸的接触系数CTW:

其中,NX-T和NX-W分别代表氨基酸X同海藻糖分子或水分子的原子接触数.MT代表海藻糖分子的总原子数,其为31.MW代表水的总原子数.
CTW数值越大,表明该氨基酸和海藻糖分子的结合作用更强.分子动力学轨迹的显示分析和构象图均用Visual Molecular Dynamics(VMD)(http://www.ks.uiuc.edu/Research/vmd/)软件完成.
2.3.3 氢键键能计算
氢键键能的计算利用GROMACS 4.0.5软件自带的g_hbond程序计算.首先,计算每种氨基酸同海藻糖或水分子之间的氢键距离随模拟时间的变动.然后利用经验公式(2)估算出氢键键能(E):
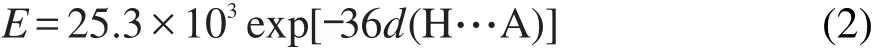
其中,d(H··A)表示供体上的氢原子和受体原子之间的距离.值得注意的是,通过公式(2)计算得到的是孤立氢键的能量,是仅通过氢键供体和受体之间的距离估算的氢键键能,并不十分精确.也就是说,它们不同于蛋白质溶液中实际的氢键能量.但利用该方法计算氢键能量非常简单,且已有大量研究证明该方法可以用于表示分子之间的氢键强弱.26-28因此本研究也用它来衡量这些氨基酸和水和海藻糖之间形成氢键的强弱.
3 结果与讨论
3.1 海藻糖、水和氨基酸整体的接触数
首先分别计算氨基酸-海藻糖以及氨基酸-水之间的接触数来表征氨基酸分子与海藻糖和水分子之间的作用力的强弱以及氨基酸的优先作用倾向.众所周知,接触数越大,表明分子间的结合作用越强.反之,分子间的结合作用越弱.图2所示为海藻糖和水分别与这20种常见氨基酸的接触数.从图2可以看出,所有氨基酸和水之间的接触数均远大于其和海藻糖之间的接触数.这说明这些氨基酸主要和水分子优先结合,而对海藻糖分子优先排阻.其中,酪氨酸、精氨酸、谷氨酸、苏氨酸、脯氨酸和组氨酸与海藻糖之间的接触数均为零,即这些氨基酸和海藻糖之间没有任何直接作用.这主要是因为这些氨基酸的侧链均为极性基团,它们会优先和水分子作用而对海藻糖分子排阻.而脯氨酸侧链虽然为疏水性基团,但是其侧链原子与骨架C、N原子共同形成了一个五元环,从而产生较大的空间位阻,从而与海藻糖之间没有直接作用,因此其与海藻糖之间的接触数也为零.

图2 氨基酸与海藻糖和水之间的接触数Fig.2 Number of contacts between amino acids and trehalose and water
从图2可以看出,在20种常见氨基酸中,色氨酸和苯丙氨酸与海藻糖之间的接触数最大,表明它们与海藻糖有较强的相互作用.主要原因是这两种氨基酸均为非极性氨基酸,且侧链均带有苯环,从而和海藻糖的六圆环发生相互作用.图3为色氨酸和苯丙氨酸与海藻糖相互作用的示意图.从该图可以看出,色氨酸和苯丙氨酸侧链上的苯环和海藻糖分子的六圆环平行堆叠(如图3中椭圆所标示),从而使色氨酸和苯丙氨酸与海藻糖的作用力较其它氨基酸强.另外,虽然这些色氨酸和苯丙氨酸之间的接触数远大于其它氨基酸,但氨基酸-海藻糖之间的接触数也小于这些氨基酸和水分子之间的接触数.即,这些氨基酸也优于和水分子发生相互作用.
从图2可以看出,所有氨基酸均与水分子接触,且与水分子的接触数均大于它们与海藻糖之间的接触数.其主要原因是所有氨基酸均含有极性主链―NH―CO―.其中,酪氨酸、精氨酸、谷氨酸、天冬氨酸和赖氨酸等极性氨基酸,它们和水分子的接触数均大于60.在所有氨基酸中,脯氨酸和水分子的接触数是最小的,主要原因除了脯氨酸为疏水性氨基酸之外,还与其结构特殊有关.脯氨酸特殊的环状结构使其缺少极性基团―NH,因此脯氨酸和水分子的接触数在20种常见氨基酸中是最小的.

图3 海藻糖与色氨酸(a)和苯丙氨酸(b)之间直接相互作用示意图Fig.3 Snapshots of the direct interaction between trehalose and tryptophane(a)and phenylalanine(b)
综上所述,所有氨基酸与水分子的接触数均大于它们和海藻糖分子之间的接触数.色氨酸和苯丙氨酸与海藻糖之间的接触数远大于其他的氨基酸与海藻糖之间的接触数,但其与水分子之间的接触数也大于其与海藻糖之间的接触数.此外,酪氨酸、精氨酸、谷氨酸、天冬氨酸和赖氨酸等极性氨基酸和水分子的接触数最多.
3.2 海藻糖和水分别与氨基酸骨架和侧链之间的接触数
为了进一步解析氨基酸的骨架和侧链分别与海藻糖和水之间相互作用,我们又分别计算了20种常见氨基酸的骨架和侧链分别与海藻糖和水之间的接触数,如图4和图5所示.
图4所示为氨基酸的主链和侧链与海藻糖之间的接触数.从图4可以看出,所有氨基酸骨架和海藻糖的接触数均很小,最大不超2个.海藻糖主要和氨基酸的侧链接触.这说明与氨基酸侧链相比,其骨架和海藻糖的作用较小.众所周知,所有氨基酸的骨架原子完全一致,但图4显示各氨基酸骨架和海藻糖的接触数存在一些差别.这说明这些氨基酸的侧链结构会影响它们的骨架和海藻糖的结合作用.此外,由于甘氨酸无侧链,故侧链对应的接触数为零.酪氨酸、精氨酸、谷氨酸、苏氨酸、脯氨酸和组氨酸无论是骨架还是侧链,与海藻糖接触数均为零,故其整体与海藻糖没有任何作用,与图2结果相符.

图4 氨基酸的主链和侧链与海藻糖之间的接触数Fig.4 Number of contacts between backbone and side chain of amino acids and trehalose
在其它氨基酸中,大部分侧链和海藻糖的接触数都大于其骨架和海藻糖的接触数,这说明氨基酸的侧链在氨基酸和海藻糖的结合作用中贡献较大,是氨基酸和海藻糖的主要作用位点.尤其是,色氨酸和苯丙氨酸的侧链与海藻糖的接触数最大,结合作用最强.这主要是因为其侧链均为非极性基团,且带有苯环,更易与海藻糖结合(图3所示).从图4可以看出,天冬酰胺和谷氨酰胺的侧链和海藻糖的接触数有较大差异.例如,天冬酰胺的侧链和海藻糖的接触数为3.25,而谷氨酰胺的侧链和海藻糖的接触数为10.56.主要原因为谷氨酰胺的侧链比天冬酰胺的侧链多一个亚甲基,从而使谷氨酰胺的侧链的疏水性比天冬酰胺高,从而极大提高了侧链和海藻糖的亲和作用.
综上所述,侧链是氨基酸和海藻糖的主要作用位点,而氨基酸的骨架和海藻糖之间的作用却较弱.尤其是非极性、芳香族氨基酸的侧链和海藻糖的作用最强.
图5所示为水分子与氨基酸主链和侧链之间的接触数.从图5可以看出,所有氨基酸骨架和水的接触数由于侧链类型、空间结构等的不同,略有差异,但最大不超过11.除疏水性氨基酸缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、丙氨酸、胱氨酸、丝氨酸和脯氨酸之外,其余氨基酸侧链和水的接触数均大于其骨架和水的接触数.例如,酪氨酸的侧链和水分子之间的接触数最大,可达到84.这说明骨架和水的结合作用对于氨基酸和水分子之间的作用影响差别不大.相反,对于大部分氨基酸,侧链是氨基酸和水分子的主要作用位点.由于天冬酰胺的侧链比谷氨酰胺的侧链少一个亚甲基,从而使其侧链的亲水性要好于谷氨酰胺的.因此它和水分子的接触数(39.68)要稍大于谷氨酰胺的侧链和水分子之间接触数(32.15).综上所述,侧链是除了疏水性氨基酸之外的氨基酸和水分子的主要作用位点,比骨架和水分子之间的作用力要强.此外,骨架对侧链和海藻糖的结合作用也有一定影响.

图5 氨基酸的主链和侧链与水分子之间的接触数Fig.5 Number of contacts between backbone and side chain of amino acids and water
3.3 氨基酸的接触系数
考虑到模拟系统中海藻糖和水原子总数的差异对接触数会有所影响,进一步引入CTW来分析每种氨基酸分别与海藻糖和水分子的结合倾向.图6所示为每种氨基酸的接触系数CTW.
从图6可以看出,色氨酸和苯丙氨酸的接触系数最大,分别为41和38.其次为谷氨酰胺和半胱氨酸,它们的接触系数均大于20.蛋氨酸、天冬酰胺、苏氨酸、异亮氨酸、丙氨酸,甘氨酸和缬氨酸的接触系数大于10.酪氨酸、精氨酸、谷氨酸、苏氨酸、脯氨酸和组氨酸因为其与海藻糖间的接触数都为0,故对应的CTW值为零.此处以主链的接触系数作为比较标准是因为优先排阻学说认为蛋白质的优先排阻主要是由蛋白质的主链所引起的.因此,海藻糖与主链接触数很少,而水分子与主链的接触数相对于各氨基酸基本相同,所以20种常见氨基酸主链的接触系数的平均值为69.8.基于上述分析,若各氨基酸的接触系数小于69.8表明该氨基酸更易于与水分子结合,而对海藻糖分子进行排阻.从图6可以看出所有氨基酸对应的接触系数均远小于69.8,即这些氨基酸均和水分子优先结合,而对海藻糖优先排阻.综上所述,海藻糖的优先排阻主要由氨基酸的主链和侧链相互作用的结果.

图6 氨基酸的接触系数(CTW)Fig.6 Contact coefficient(CTW)for each amino acid
基于以上分析,本研究结果支持优先排阻学说.当蛋白质在自然状态时,蛋白质的疏水氨基酸会在疏水相互作用影响下发生疏水塌缩,而亲水性氨基酸侧链会分布在蛋白质的表面,因此这些亲水性的侧链会优先和水分子发生相互作用,而对海藻糖优先发生排阻作用.当变性状态的蛋白质在海藻糖溶液中,这些氨基酸和水分子之间的亲合作用均比它们和海藻糖之间的作用更强,即这些氨基酸更易于和水分子发生相互作用,而排阻海藻糖分子,从而造成蛋白质对海藻糖分子的排阻.当然,蛋白质在海藻糖溶液中,海藻糖和水与氨基酸之间的相互作用比本研究体系要复杂.蛋白质的序列、二级和三级结构都会对海藻糖和水与氨基酸残基之间作用有影响.将来在研究海藻糖对蛋白质稳定性的影响过程中,考虑利用二级结构内禀倾向性受溶剂调控的分析方法详细研究海藻糖对蛋白质结构稳定性的影响机制.29此外,由于氨基酸在蛋白质分子中的环境与本文选择的三肽系统有显著区别,为了更真实地了解海藻糖对蛋白质的稳定性的影响.作者将在后期研究中开展海藻糖稳定蛋白质的作用机理.考虑到蛋白质分子体系的复杂性,为了在更大的构型空间上取样,将采用更为有效的构象采样方法——副本交换分子动力学方法来研究海藻糖对蛋白质稳定性的分子机理.30,31
3.4 氢键键能
从图1可以看出,海藻糖含有8个羟基,因此氢键是氨基酸和海藻糖与水分子之间的主要作用力之一,对氨基酸和海藻糖与水之间的结合作用具有重大贡献.下面通过计算海藻糖和水与氨基酸之间整体氢键键能的平均值来衡量常用20种氨基酸和海藻糖分子间氢键作用的强弱(表2).从表2可以看出,所有氨基酸和水分子间的氢键键能均远大于氨基酸和海藻糖间的氢键键能.例如,所有氨基酸和水分子之间氢键键能的平均值为24.45 kJ·mol-1,而所有氨基酸和海藻糖分子之间的氢键键能的平均值仅为6.85 kJ·mol-1.另外,氨基酸同水分子间的氢键键能最大为酪氨酸和水分子之间的氢键,其键能为30.76 kJ·mol-1,最小键能为赖氨酸和水分子之间的氢键,其键能为20.75 kJ·mol-1.而氨基酸和海藻糖间的氢键键能最大的为天冬氨酸和海藻糖分子之间的氢键,它们的键能仅为12.27 kJ·mol-1.其中,谷氨酸、组氨酸、脯氨酸、苏氨酸、酪氨酸和缬氨酸无论是主链还是侧链,和海藻糖间的氢键键能均为零,即这些氨基酸和海藻糖之间没有氢键作用,这与图4的结果一致.而谷氨酸、组氨酸、脯氨酸、苏氨酸、酪氨酸和缬氨酸和水分子之间均发生氢键作用.而带电氨基酸(天冬氨酸,谷氨酸,赖氨酸和精氨酸)和极性氨基酸(丝氨酸,苏氨酸和酪氨酸)的主链和侧链均和水分子有氢键.而这些带电和极性氨基酸的侧链和水的氢键键能大于主链和水的氢键键能.也就是说,这些氨基酸的侧链更易与水形成氢键,侧链上的极性基团是氨基酸和水的主要作用位点.与之相反,其他氨基酸的侧链和水的氢键键能均小于它们主链和水的氢键键能,也就是说这些氨基酸主要是通过主链和水发生氢键作用.因此,氢键是氨基酸和水的主要结合力.此外,水比海藻糖更易形成氢键,且极性氨基酸侧链的极性基团和主链是氨基酸和水的主要作用位点.

表2 氨基酸的主链和侧链与海藻糖和水之间氢键键能的平均值Table 2 Average values of energies of hydrogen bonds between each amino acid including its backbones and side chains and trehalose and water molecules
4 结论
选择两端以甘氨酸封闭的三肽作为模型蛋白质,利用全原子分子动力学模拟方法考察海藻糖和氨基酸之间的相互作用,以便从原子和分子水平上深入阐释海藻糖对蛋白质稳定的作用机制.结果表明,相对于海藻糖分子所有氨基酸均优先和水分子结合.其中,极性带电氨基酸和水的结合作用较强;而相较于其它氨基酸,非极性芳香氨基酸和海藻糖的结合作用较强,而氨基酸的侧链是其与海藻糖的主要作用位点.氨基酸骨架和海藻糖与水分子的作用均较侧链弱,而氨基酸的侧链是除丙氨酸、缬氨酸之外的所有氨基酸和水分子的主要作用位点.非极性芳香氨基酸的侧链和海藻糖的作用较极性氨基酸侧链和海藻糖的作用强,而和水分子的作用却较极性氨基酸侧链和水分子的作用弱;氨基酸和海藻糖和水之间均形成氢键,但海藻糖-氨基酸之间的氢键弱于氨基酸和水之间的氢键,极性氨基酸侧链的极性基团和主链是氨基酸和水的主要作用位点.其中,谷氨酸、组氨酸、脯氨酸、苏氨酸、酪氨酸和缬氨酸和海藻糖间的氢键键能均为零.综上所述,仅从氨基酸残基角度分析,本研究结果支持海藻糖和蛋白质之间的作用机理为优先排阻学说.但需要进一步说明的是,由于本研究中选用的三肽与实际溶液中的蛋白质结构差别较大,在随后的研究工作中,我们会继续研究蛋白质的骨架、侧链和整个蛋白质与海藻糖相互作用的机理,希望基于这些研究可以对海藻糖稳定蛋白质的作用机理有新的认识.
(1) Richards,A.B.;Krakowka,S.;Dexter,L.B.;Schmid,H.;Wolterbeek,A.P.;Waalkens-Berendsen,D.H.;Shigoyuki,A.;Kurimoto,M.Food Chem.Toxicol.2002,40,871.doi:10.1016/S0278-6915(02)00011-X
(2) Singer,M.A.;Lindquist,S.Trends Biotechnol.1998,16,460.doi:10.1016/S0167-7799(98)01251-7
(3) Crowe,J.H.;Crowe,L.M.;Carpenter,J.F.;Wistrom,A.C.Biochem.J.1987,242,1.
(4) Ohtake,S.;Wang,Y.J.J.Pharm.Sci.2011,100,2020.doi:10.1002/jps.22458
(5)Zhang,N.;Liu,F.F.;Dong,X.Y.;Sun,Y.J.Phys.Chem.B 2012,116,7040.doi:10.1021/jp300171h
(6) Zhang,N.;Liu,F.F.;Dong,X.Y.;Sun,Y.Biochem.Eng.J.2013,70,188.doi:10.1016/j.bej.2012.11.004
(7) Liu,F.F.;Ji,L.;Zhang,L.;Dong,X.Y.;Sun,Y.J.Chem.Phys.2010,132,225103.doi:10.1063/1.3453713
(8) Liu,F.F.;Ji,L.;Dong,X.Y.Acta Phys.-Chim.Sin.2010,26,2813.[刘夫锋,纪 络,董晓燕.物理化学学报,2010,26,2813.]doi:10.3866/PKU.WHXB20101011
(9)Zhang,N.;Liu,F.F.;Dong,X.Y.;Sun,Y.Biochem.Eng.J.2013,79,120.doi:10.1016/j.bej.2013.07.007
(10) Dong,X.Y.;Liu,J.H.;Liu,F.F.;Sun,Y.Biochem.Eng.J.2009,43,321.doi:10.1016/j.bej.2008.10.015
(11) Liu,F.F.;Ji,L.;Dong,X.Y.;Sun,Y.J.Phys.Chem.B 2009,113,11320.doi:10.1021/jp905580j
(12) Liu,F.F.;Dong,X.Y.;Sun,Y.Acta Phys.-Chim.Sin.2010,26,1643.[刘夫锋,董晓燕,孙 彦.物理化学学报,2010,26,1643.]doi:10.3866/PKU.WHXB20100613
(13) Bolen,D.W.;Rose,G.D.Annu.Rev.Biochem.2008,77,339.doi:10.1146/annurev.biochem.77.061306.131357
(14) Lins,R.D.;Pereira,C.S.;Hunenberger,P.H.Proteins 2004,55,177.doi:10.1002/prot.10632
(15)Ansari,A.;Jones,C.M.;Henry,E.R.;Hofrichter,J.;Eaton,W.A.Science 1992,256,1796.doi:10.1126/science.1615323
(16)Allison,S.D.;Chang,B.;Randolph,T.W.;Carpenter,J.F.Arch.Biochem.Biophys.1999,365,289.doi:10.1006/abbi.1999.1175
(17) Lins,R.D.;Hunenberger,P.H.J.Comput.Chem.2005,26,1400.doi:10.1002/jcc.20275
(18) Liu,F.F.;Dong,X.Y.;Sun,Y.J.Mol.Graph.Model.2008,27,421.doi:10.1016/j.jmgm.2008.07.002
(19) Hess,B.;Kutzner,C.;van der Spoel,D.;Lindahl,E.J.Chem.Theory Comput.2008,4,435.doi:10.1021/ct700301q
(20) Berendsen,H.J.C.;Postma,J.P.M.;van gunsteren,W.F.;Hermans,J.In Intermolecular Forces;Pullman,B.Ed.;Reidel:Dordecht,Holland,1981;pp 331.
(21) van gunsteren,W.F.;Billeter,S.R.;Eising,A.A.;Hunenberger,P.H.;Mark,A.E.;Scott,W.R.P.;Tironi,I.G.Biomolecular Simulation:The GROMOS96 Manual and User Guide;Zurich:Groninigen,1996.
(22) Hess,B.;Bekker,H.;Berendsen,H.J.C.;Fraaije,J.G.E.M.J.Comput.Chem.1997,18,1463.doi:10.1002/(SICI)1096-987X(199709)18:12<1463::AID-JCC4>3.0.CO;2-H
(23) Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.1993,98,10089.doi:10.1063/1.464397
(24)Berendsen,H.J.C.;Postma,J.P.M.;Vangunsteren,W.F.;Dinola,A.;Haak,J.R.J.Chem.Phys.1984,81,3684.doi:10.1063/1.448118
(25)Liu,F.F.;Dong,X.Y.;Wang,T.;Sun,Y.J.Chromatogr.A 2007,1175,249.doi:10.1016/j.chroma.2007.10.074
(26)Stumpe,M.C.;Grubmuller,H.J.Am.Chem.Soc.2007,129,16126.doi:10.1021/ja076216j
(27) Sheu,S.Y.;Yang,D.Y.;Selzle,H.L.;Schlag,E.W.Proc.Natl.Acad.Sci.U.S.A.2003,100,12683.doi:10.1073/pnas.2133366100
(28) Jenkins,S.;Morrison,I.Chem.Phys.Lett.2000,317,97.doi:10.1016/S0009-2614(99)01306-8
(29)Li,W.;Qin,M.;Tie,Z.;Wang,W.Phys.Rev.E 2011,84,041933.doi:10.1103/PhysRevE.84.041933
(30)Li,W.;Zhang,J.;Wang,J.;Wang,W.J.Am.Chem.Soc.2008,130,892.doi:10.1021/ja075302g
(31) Lei,H.;Duan,Y.Curr.Opin.Struct.Biol.2007,17,187.doi:10.1016/j.sbi.2007.03.003

