氮对纤维藻生长、油脂积累及营养吸收的影响
,,, ,, ,
(海南大学材料与化工学院,热带作物种质资源保护与开发利用教育部重点实验室,海南海口 570228)
氮对纤维藻生长、油脂积累及营养吸收的影响
张森,刘平怀*,王丽波,杨勋,郝宗娣,张玲,罗宁
(海南大学材料与化工学院,热带作物种质资源保护与开发利用教育部重点实验室,海南海口 570228)
为研究氮源及氮浓度对一株淡水富油纤维藻(Ankistrodsemussp.)生长、油脂积累及营养吸收的影响。以3N-BBM为基础培养基,采用单因素实验分别考察了尿素、氯化铵、硝酸钠及亚硝酸钠以及硝酸钠浓度对纤维藻生长、油脂积累及营养吸收的影响。结果表明:四种氮源对纤维藻生长和生物量影响较小,但对油脂积累影响较大。该藻在尿素中的生物量浓度最高(2.87g/L),在硝酸钠中的油脂含量(30.17%)和油脂产量(0.81g/L)最高。硝酸钠浓度为0.3mmol/L时,该藻较难存活,浓度为3.0mmol/L时其生长较差,但油脂含量(37.37%)和油脂产量(0.89g/L)最高;浓度在9.0~30.0mmol/L时,纤维藻生物量较高,但油脂含量和油脂产量较低。综合生物量和油脂含量考虑,该纤维藻最适生长和油脂积累的氮源为硝酸钠且最适浓度为3.0mmol/L。
纤维藻,氮,细胞生长,油脂积累
微藻富含蛋白质,脂肪,EPA(二十碳五烯酸)等多种生物活性物质,开发微藻已经成为人类获得食品,药品及燃料等的新途径[1]。尤其近年来,应用微藻油脂制备生物柴油已经引起全世界能源工作者的广泛关注[2]。与传统的油料作物相比,微藻生长速率快,油脂含量高,单位面积的年生产量是普通作物的几十到上百倍[3]。尽管利用微藻生产油脂产品具有上述诸多优点,但是高密度培养[4]一直是微藻油脂产业化的主要瓶颈之一,探索影响微藻高密度生长和油脂积累的因素具有重要意义。影响微藻生长和油脂积累的因素很多,其中营养因素最为重要。氮是生物体蛋白质和核酸的基本物质元素,对细胞的增殖和油脂积累具有重要的调控作用。Neochlorisoleoabundans[5]在以硝酸钠为氮源时,生长最快,生物量、油脂含量和油脂产率最高,且氮源在3mmol/L下油脂含量最高,5mmol/L下总脂产量最高。Ellipsoidionsp.[6]在尿素中生长最差,在NH4Cl中的油脂产率最高。Scenedesmussp.[7]在2.5mg/L的氮浓度中长生最差,生物量最低但油脂含量较高,而在25mg/L时,生物量和油脂产率最高。纤维藻隶属于绿藻门,绿藻纲,绿球藻目,乱囊藻科,纤维藻属,适应性较强,常作为滤食性鱼类等饵料[8],目前对其产油方面研究较少。本研究以海南本地淡水分离筛选的一株富油纤维藻(Ankistrodsemussp.)为材料,初步研究和考察氮源和氮浓度对纤维藻生长和油脂积累的影响,为其高密度培养和产油条件提供参考。

表1 纤维藻Ankistrodsemus sp.在不同氮源中的生物量浓度及比生长速率
注:表中具有相同字母的组表示无显著相差异,反之,则具有显著性差异。表2、图3及图6同。
1 材料与方法
1.1材料与仪器
纤维藻(Ankistrodsemussp.) 海南大学生物工程综合实验室提供;硝酸钠、亚硝酸钠、尿素、氯化铵、氯仿、甲醇等 均为国产分析纯。
TV-1810紫外可见分光光度计 北京普析通用;CR-22GII高速冷冻离心机 日立;LDJ-25C冷冻干燥系统 北京四环科学仪器有限公司;柱状玻璃管高60cm,直径6cm。
1.2培养条件
柱状培养管中装1L培养液,接种比例1∶10(v/v),连续光照,光照强度为8000Lux,室温下培养,并通入无菌空气,通气速率为10L/h。
1.3实验设计
1.3.1 氮源对纤维藻生长及油脂含量的影响 培养基(除氮源外)按3N-BBM培养基配制,分别用与3N-BBM原配方中相同氮摩尔浓度(8.8mmoL/L)的硝酸钠、亚硝酸钠、氯化铵及尿素作为唯一氮源,每组实验做两组平行。
1.3.2 氮浓度对纤维藻生长及油脂含量的影响 分别以摩尔浓度为0.3、3.0、9.0、18.0、30.0mmoL/L的硝酸钠为氮源,以1.5mmol/L的KH2PO4为磷源,其他成分按3N-BBM培养基配制,每组实验做两组平行。
1.4分析方法
1.4.1 生长曲线及比生长速率 采用紫外可见分光光度仪测定藻溶液在680nm处的吸光值(OD680),并用细胞计数板计数相应浓度下的微藻细胞个数(N),建立微藻的细胞数(N)与吸光度(OD680)的标准曲线[9],曲线方程为:N=1.55×107×OD680-361410(R2=0.99859)。培养期间,每24h取样10mL,在680nm下测定吸光值,按照上述公式转换成细胞数。比生长速率按公式μ=(lnN1-lnN2)/(T1-T2),(N1,N2分别为T1,T2时间点对应的细胞数目)。
1.4.2 色素含量测定 采用90%甲醇按照文献[10]中分光光度法进行色素含量测定。
1.4.3 生物量浓度测定 将藻液于8000r/min离心5min,所得藻泥用去离子水清洗3次,然后采用真空冷冻干燥法进行干燥。生物量浓度采用公式:生物量浓度(g/L)=冻干藻粉(g)/培养液体积(L)进行计算。
1.4.4 油脂含量测定 参考文献[11]氯仿-甲醇(2∶1,v/v)法对总脂进行提取和测定。
1.4.5 氮、磷浓度测定 取5mL藻液于4000r/min下离心15min,取上层清液进行适当稀释后按照文献[12-14]中的过硫酸钾消解紫外分光光度法和钼酸铵分光光度法分别对培养液中总氮及总磷浓度进行测定。
1.4.6 数据处理与分析 分别采用SPSS 20.0和Oringin 8.0软件对数据进行分析和图形绘制。
2 结果与讨论
2.1氮源对纤维藻生长及油脂含量的影响
藻类通常对不同形态氮的利用存在明显差异,浮游植物一般利用无机氮的能力为铵态氮>硝态氮>亚硝态氮[15]。由图1可以看出,纤维藻以氯化铵和亚硝酸钠为氮源时生长最佳,尿素次之,硝酸钠最差。同时,氯化铵比生长速率最高,亚硝酸次之,和氯化铵相差不大,而尿素和硝酸钠没有差异。可以看出氮源对纤维藻细胞生长的促进作用为氯化铵≈亚硝酸钠>尿素>硝酸钠,说明对无机氮而言,纤维藻可能较倾向于优先利用还原态的氮,而有机氮如尿素可能需要经过分解转化成无机氮才能够利用。

图1 Ankistrodsemus sp.在不同氮源中的生长曲线
生物量(表1)表明尿素组的生物量浓度最高,氯化铵组和亚硝酸钠组相同,硝酸钠组最低,可能由于尿素不仅是氮源而且还具有一定的碳源作用,所以生物量较高。单因素ANVOA分析表明,四种氮源对纤维藻的生物量无显著性差异(p=0.850>0.05),说明四种形态氮源对纤维藻生物量积累的影响较小。
叶绿素浓度的高低反映了光合作用的强弱,由图2可以看出,纤维藻在0~8d色素浓度逐渐增高,光合作用随着细胞浓度增大而增强。8~18d色素浓度基本稳定不变,光合作用达到饱和。18~19d色素浓度降低,光合作用减弱。此外可以看出,纤维藻在四种氮源中的色素浓度较高,变化趋势一致且相差不大,说明纤维藻在四种氮源中的生长都较旺盛,光合作用较强。

图2 Ankistrodsemus sp.在不同氮源中叶绿素浓度变化
由图3可以看出,纤维藻以硝酸钠为氮源时油脂含量最高,为30.17%,是油脂含量最低的尿素组的1.26倍。单因素ANVOA分析表明四种氮源对纤维藻油脂含量具有极显著的影响,Turkey HSD分析结果显示亚硝酸钠和硝酸钠组油脂含量无显著差异(p=0.291>0.05),其余各组间均具有显著差异。从总脂产量方面考虑,硝酸钠组最高,为0.81g/L,是产量最低的尿素组的1.17倍。Turkey HSD分析表明硝酸钠和亚硝酸钠组油脂产量无显著差异(p=0.929>0.05),氯化铵和尿素组无显著差异(p=0.783>0.05),说明氧化态的氮较还原态的氮更有利于纤维藻细胞内油脂的积累。四种氮源中硝酸钠为纤维藻油脂积累的最适氮源。
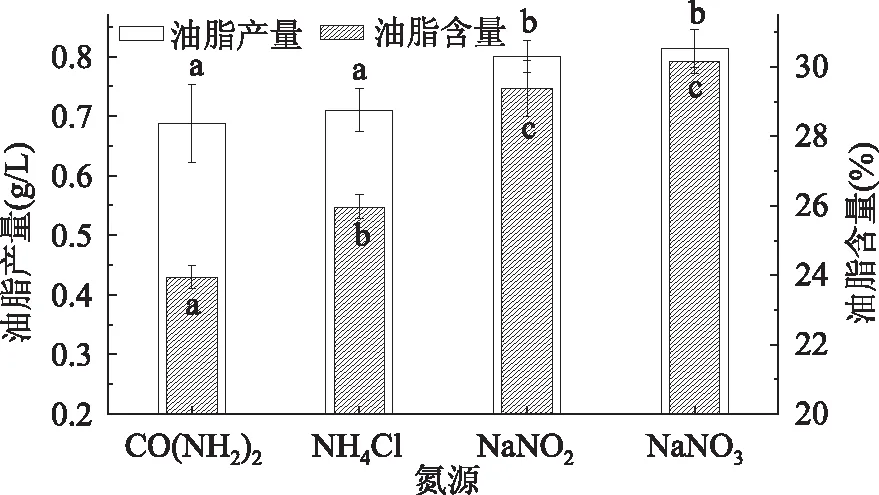
图3 不同氮源下Ankistrodsemus sp.的油脂含量及油脂产量
2.2氮浓度对纤维藻生长及油脂含量的影响
由图4可以看出,纤维藻在9.0、18.0mmol/L硝酸钠下生长状况最佳,30.0mmol/L次之,3.0mmol/L下生长较差,0.3mmol/L组只生长了3d就开始衰退。18.0mmol/L组比生长速率(表2)最高,和9.0、30.0mmol/L组的比生长速率差异较小,0.3mmol/L组的比生长速率最低。从图5可以看出,18.0mmol/L的叶绿素浓度最高,其次分别为30.0、9.0mmol/L组,3.0mmol/L组叶绿素浓度最低,说明纤维藻在18.0mmol/L氮浓度中光合作用最强,生长最旺盛,在3.0mmol/L中光合作用较弱,生长较差。
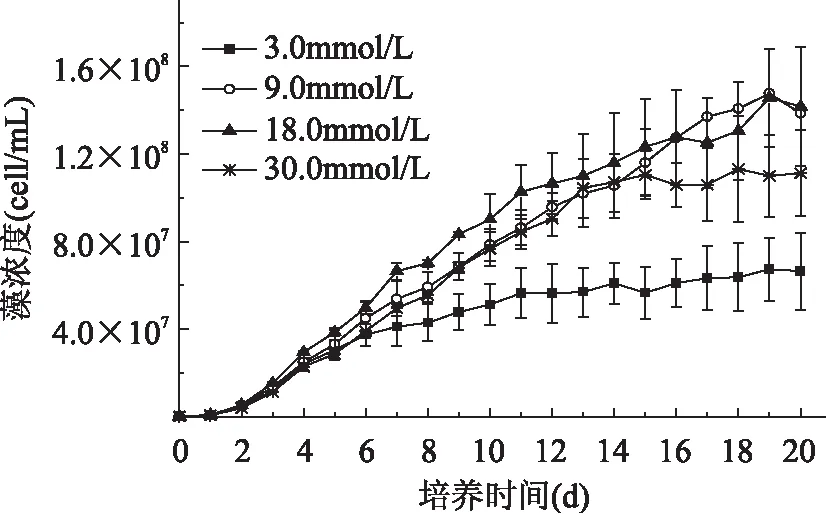
图4 Ankistrodsemus sp.在不同氮浓度下的生长曲线
生物量浓度(表2)结果显示纤维藻在18.0mmol/L中的氮浓度下生物量浓度最高,分别是0.3、3.0、9.0、30.0mmol/L浓度下的15.96、1.54、1.10、1.14倍。30.0mmol/L组的生长速率、色素浓度及生物量均较18.0mmol/L组低,说明过高的氮浓度可能对纤维藻的生长和生物量积累有抑制作用,而缺氮或氮限制(0.3mmol/L)下,纤维藻可能难以生长和存活。Turkey HSD分析显示除0.3mmol/L组外,其余各组间的生物量浓度均无显著性差异,说明在3.0~30.0mmol/L浓度的硝酸钠对纤维藻生物量积累的影响较小。综上,18.0mmol/L的硝酸钠是纤维藻生物量积累的最适氮源浓度。

图5 Ankistrodsemus sp.在不同氮浓度下叶绿素浓度变化
纤维藻在3.0mmol/L的氮浓度下油脂含量最高,为37.37%,分别是0.3、9.0、18.0、30.0mmol/L浓度下的2.12、1.81、2.09、2.18倍。研究表明微藻在缺氮或氮限制条件下,细胞内积累大量油脂[16-18],这与本实验研究结果不一致,可能因为在缺氮或氮限制状态下,该株纤维藻基本难以生长或存活,在细胞内还未开始积累油脂时已经死亡。Turkey HSD分析显示除3.0mmol/L与其余各组具有极显著差异外,其余各组均无显著性差异,说明低氮浓度能明显利于该株纤维藻细胞内的油脂积累,过高或过低的氮浓度均不利于其油脂积累。从总脂产量(图6)考虑,3.0mmol/L组的油脂产量最高,分别是0.3、9.0、18.0、30.0mmol/L氮浓度下的22.25、1.29、1.37、1.62倍,Turkey HSD分析显示0.3、3.0mmol/L与其余各组间均具有显著性差异,而9.0、18.0、30.0mmol/L三组间无显著性差异,说明9.0~30.0mmol/L氮浓度对该株纤维藻油脂产量影响较小。综上,3.0mmol/L硝酸钠最适合该株纤维藻油脂的积累。

表2 纤维藻Ankistrodsemus sp.在不同氮浓度下的生物量浓度及平均比生长速率
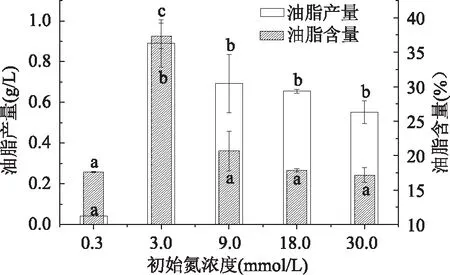
图6 Ankistrodsemus sp.在不同氮浓度中的 油脂含量及油脂产量
2.3纤维藻对培养液中氮、磷的吸收利用
从图7可以看出,3.0mmol/L组的氮源在第5d被完全消耗,9.0mmol/L组在第8d被消耗尽,18.0及30.0mmol/L组在第10~14d氮浓度吸收趋于平稳,最终都存在氮剩余,其中氮利用率分别为79.81%,37.29%。随氮浓度升高,氮的利用率降低,可能因为纤维藻对氮浓度的吸收存在饱和浓度,超出此浓度可能对纤维藻生长产生抑制作用[2]。所有组的磷源在第12~13d被完全消耗,吸收利用速率相差不大。对比氮、磷消耗曲线可以发现,3.0和9.0mmol/L组的氮源分别在第5,8d被完全消耗,而磷的吸收还在继续,说明该株纤维藻在一定氮浓度下,对磷的吸收影响较小。对比氮消耗曲线和色素含量变化曲线可以发现,氮被完全消耗或不再吸收的同时,色素浓度基本稳定不变,可见氮源中有一部分氮可能被直接用来合成叶绿素(叶绿素分子含有氮元素)。对比氮消耗曲线和纤维藻生长曲线可以看出,在氮源被完全消耗或基本不再吸收时,细胞还在继续增殖,这和Li等[2]的研究结果一致,说明纤维藻细胞内可能存在储存氮源的“氮池”,培养基中的氮源可能在吸收过程中有一部分被储存起来,等培养基中的氮完全被消耗完时,被储存的氮此时才被调用。

图7 培养基中氮、磷浓度变化
3 结论
实验以3N-BBM为基础培养基,研究了不同氮源及硝酸钠浓度对一株淡水纤维藻生长、油脂积累及营养吸收的影响。纤维藻以氯化铵、硝酸钠、亚硝酸钠及尿素为氮源时,对纤维藻生物量无显著影响,但对油脂积累影响较大。其在尿素中的生物量浓度最高(2.87g/L),但油脂含量较低,在硝酸钠中的油脂含量(30.17%)和油脂产量(0.81g/L)最高。硝酸钠浓度为0.3mmol/L时,纤维藻生长较差,较难存活;浓度为3.0mmol/L时纤维藻生长较差,生物量浓度较低,但油脂含量(37.37%)和油脂产量(0.89g/L)最高;浓度为9.0~30.0mmol/L氮浓度下该株纤维藻生长旺盛,生物量较高,但油脂含量和油脂产量较低,且生物量和油脂产量没有显著差异。在实验条件下,纤维藻利用氮的饱和浓度小于18.0mmol/L,更高氮浓度不仅不会促进纤维藻的生长和生物量积累,还会导致细胞积累油脂水平下降。综上,四种氮源中,最适纤维藻生长和油脂积累的氮源为硝酸钠且最适浓度为3.0mmol/L。
[1]汪本凡,赵良侠,叶霁,等. 微藻无菌化技术的研究进展[J]. 微生物学通报,2007,34(2):363-366.
[2]Li X,Hu H Y,Zhang Y P. Growth and lipid accumulation properties of a freshwater microalgaScenedesmussp. under different cultivation temperature[J]. Bioresource Technology,2011,102:3098-3102.
[3]Man K L,Keat T L. Microalgae biofuels:A critical review of issues,problems and the way forward[J]. Biotechnology Advances,2012,30:673-690.
[4]Zhu J Y,Rong J F,Zong B N. Factors in mass cultivation of microalgae for biodiesel [J]. Chinese Journal of Catalysis,2013,34(1):80-100.
[5]Li YQ,Horsman M,Wang B,etal. Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans [J]. Applied Microbiology Biotechnology,2008,81:629-636.
[6]Xu N J,Zhang X C,Fan X,etal. Effects of nitrogen source and concentration on growth rate and fatty acid composition ofEllipsoidionsp. (Eustigmatophyta) [J]. Journal of Applied Phycology,2001,13:463-469.
[7]Li X,Hu H Y,Gan K,etal. Effects of different nitrogen and phosphorus concentrations on the growth,nutrient uptake,and lipid accumulation of a freshwater microalgaScenedesmussp.[J].Bioresurce Technology,2010,10:5494-5500.
[8]王溪森,师德强,莫祺晖. 磷对纤维藻生长的影响[J]. 河北渔业,2010,8:4,27.
[9]王立柱,温皓程,邹渝,等. 产油微藻的分离、筛选及自养培养氮源、碳源的优化[J]. 微生物学通报,2010,37(3):336-341.
[10]Lichtenthaler H K. Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J]. Methods in enzyology,1987,148:350-382
[11]刘平怀,张森,杨勋,等. 氮、磷源及海盐对微茫藻细胞生长和油脂积累的影响[J]. 食品工业科技,2013,34(7):186-189.
[12] GB11894-89. 水质总氮的测定-过硫酸钾消解紫外分光光度法[S].
[13] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第四版. 北京:中国环境科学出版社,2002,244-257.
[14] GB11893-89. 水质总磷的测定-钼酸铵分光光度法[S].
[15] Dortch Q,Clayton J J R,Thoresen S S. Species differences in accumulation of nitrogen pols in phytoplankton[J]. Marine Biology,1984,81:237-250.
[16] Chittra Y S,Benjamas C. Effect of nitrogen,salt,and iron content in the growth medium and light intensity on lipid production by microalgae islated from freshwater sources in Thailand[J]. Bioresource Technology,2011,102:3034-3040.
[17] Huang X X,Huang Z Z,Wen W,etal. Effects of nitrogen supplementation of the culture medium on the growth,total lipid content and fatty acid profiles of three microalgae (Tetraselmis subcordiformis,Nannochloropsis oculata and Pavlova viridis)[J]. Journal of Applied Phycology,2013,25(1):129-137.
[18] Feng P Z,Deng Z Y,Fan L,etal. Lipid accumulation and growth characteristics of Chlorella zofingiensis under different nitrate and phosphate concentrations[J]. Journal of Bioscience and Bioengineering,2012,114(4):405-410.
Effect of nitrogen on the growth,lipid accumulation and nutrient uptak of a freshwater microalgaeAnkistrodsemussp.
ZHANGSen,LIUPing-huai*,WANGLi-bo,YANGXun,HAOZong-di,ZHANGLing,LUONing
(College of Materials and Chemical Engineering,Hainan University,Ministry of Education Key Laboratory of Protection and Development Utilization of Tropical Crop Germplasm Resources,Haikou 570228,China)
In order to study effects of nitrogen sources and concentrations on the growth,lipid accumulation,and nutrient uptake of a freshwater microalgaAnkistrodsemussp.,four nitrogen sources such as urea,ammonium chloride,sodium nitrate and sodium nitrite and different nitrogen concentrations were investigated based on 3N-BBM media. The results showed that the growth and biomass were less affected by four nitrogen sources,but it was just opposite for lipid accumulation. The highest biomass(2.87g/L)was obtained with urea as nitrogen source,while the optimal lipid content(30.17%)and lipid productivity(0.81g/L)was gained with sodium nitrate.Ankistrodsemussp. was grown poorly and nearly died just on the fourth day with 0.3mmol/L sodium nitrate. Although the growth and biomass was poor with 3mmol/L sodium nitrate,the lipid content(37.37%)and lipid productivity(0.89g/L)was highest. With higher nitrogen concentration(9.0~30.0mmol/L),Ankistrodsemussp. was grown vigorously and had higher biomass,but the lipid content and lipid productivity were lower. So sodium nitrate was the optimal nitrogen source for growth and lipid accumulation ofAnkistrodsemussp. and the optimal concentration was 3.0mmol/L.
Ankistrodsemussp.;nitrogen;cell growth;lipid accumulation
2013-05-17 *通讯联系人
张森(1988-),男,硕士研究生,主要从事微藻生物能源及生物制药方面研究。
国家科技支撑计划(2011BAD14B01);海南省中药现代化科技专项(ZY201327);基础研究重大项目前期研究专项(2010CB134409);海南大学植物学国家级重点学科(071001)资助。
Q935
:A
:1002-0306(2014)01-0155-05

