冻藏时间对麦谷蛋白和麦醇溶蛋白二级结构及面团性能的影响研究
,, ,,
(郑州轻工业学院食品与生物工程学院,河南郑州 450002)
冻藏时间对麦谷蛋白和麦醇溶蛋白二级结构及面团性能的影响研究
李学红,胡钟毓,陆勇,荆晓燕,刘延奇
(郑州轻工业学院食品与生物工程学院,河南郑州 450002)
分别对小麦醇溶蛋白和麦谷蛋白在-18℃下冻藏0~28d后其巯基和二硫键含量以及二级结构的变化情况进行研究,并分析了变化可能的内在机理;进一步探讨了冻藏导致的面团质构变化与两种面筋蛋白结构变化的对应关系。结果表明:冻藏处理使麦醇溶蛋白和麦谷蛋白中巯基含量增加、二硫键含量减少,α-螺旋和β-转角结构含量下降,β-折叠结构含量升高;其中,冻藏处理对麦谷蛋白二级结构的影响程度要明显大于麦醇溶蛋白。质构研究结果表明:两种蛋白质中二硫键、α-螺旋和β-转角结构含量的减少,对冻藏后面团粘性、弹性、硬度的降低有着重要影响。
麦谷蛋白,麦醇溶蛋白,结构,冻藏,质构
随着冷冻面团技术应用的日益广泛,对其的研究也越发深入,但到目前为止,仍有一些问题没有得到很好解决。例如速冻和冻藏处理导致的面团品质下降就是其中之一。研究已经表明,面团烘焙制品的感官品质与冻藏处理后面团的面筋蛋白结构变化有关[1],冻藏使自由水结晶,从而破坏面筋网络结构,使烘焙面制品质量下降。而麦谷蛋白和麦醇溶蛋白是面筋蛋白的主要组成部分,面筋蛋白的结构变化也由这两种蛋白结构变化决定。所以小麦醇溶蛋白和麦谷蛋白对面筋网络结构和冷冻面团的质量有着重要影响。Yuthana Phimolsiripol、刘国琴等人研究低温对面团、面筋蛋白分子结构的影响[2-3],但冻藏对面筋蛋白的重要组成部分——麦醇溶蛋白和麦谷蛋白的结构影响却鲜见报道。本文就冻藏时间对小麦醇溶蛋白和麦谷蛋白二级结构的影响进行了研究,分析了冻藏处理后这两种蛋白质二级结构变化以及可能的内在机理,并将之与同样冷冻处理后的面团质构性能的变化相印证,从而得出冻藏导致的麦谷蛋白和麦醇溶蛋白结构的变化对面团品质的影响,为提高冷冻面团品质提供理论参考。
1 材料与方法
1.1材料与仪器
甘氨酸、Tris、EDTA、浓盐酸、5,5,-二硫代-2-硝基苯甲酸(DTNB)、脲、盐酸胍、三氯乙酸 分析纯;面粉 郑州金苑面粉有限公司,特一粉。
双波长紫外可见分光光度计 上海奥谱勒仪器有限公司;磁力搅拌器 江苏中大仪器厂;真空干燥箱 上海一恒科学仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;高速离心机 北京医用离心机厂;IR7650型傅里叶红外光谱仪 上海分析仪器厂;TA-XTplus物性测试仪 Stable Micro System;凝胶过滤层析柱 上海康华生化仪器制造厂;BSZ-100自动部份收集器 上海沪西分析仪器厂;紫外检测仪 上海沪西仪器厂。
1.2实验方法
1.2.1 样品处理 取500g的面粉,加水洗去淀粉成为湿面筋蛋白备用(含水量约为50%)。
取部分上述湿面筋(不隔绝空气)在27℃,-100kPa下真空常温干燥18h后得面筋蛋白粉,再从中提取出麦醇溶蛋白和麦谷蛋白进行巯基和二硫键的测定以及红外光谱分析。
取余下湿面筋(不隔绝空气)先在-40℃下速冻40min,然后在-18℃下冻藏7~28d,然后在27℃,-100kPa下真空常温干燥18h后得面筋蛋白粉,再提取两种蛋白质分别进行巯基和二硫键的测定以及红外光谱的分析。
1.2.2 麦醇溶蛋白和麦谷蛋白的提取及纯度分析 取一定量的面筋蛋白粉按1∶35(m/v)的比例加入72%的乙醇,充分混匀后磁力搅拌2h,然后在4000r/min条件下离心20min。提取上清液在50~60℃条件下进行旋转蒸发,取出固体然后在27℃,-100kPa下真空常温干燥10h即得麦醇溶蛋白;将离心后提出的固体直接进行在27℃,-100kPa下真空常温干燥6h即为麦谷蛋白[4-7]。
利用柱层析对提取的两种蛋白质进行纯度分析。层析介质:葡聚糖凝胶G-100、柱子尺寸:1.6cm(直径)×1m、洗脱液:麦醇溶蛋白:0.02mol/L的醋酸溶液,pH4.5;麦谷蛋白:0.05mol/L Tris-HCl,0.1mol/L KCl,pH7.5。
1.2.3 蛋白质巯基和二硫键的测定 首先配制好Tris-甘氨酸缓冲液、Ellman’s试剂、脲溶液、脲+盐酸胍溶液[8]。将15mg麦醇溶蛋白或麦谷蛋白样品加入到1mL Tris-甘氨酸缓冲液中,充分混匀后再加入4.7g固体盐酸胍,然后用缓冲液定容至10mL待用。
巯基的测定:取定容后1mL溶液加0.05mL Ellman’s试剂以及4mL脲-盐酸胍溶液,在412nm处测定吸光度并做平行实验取平均值。
二硫键的测定:取定容后1mL溶液加入4mL脲-盐酸胍溶液以及0.05mL二巯基乙醇,将其在25℃水浴下保温1h,继续加入10mL 12%的三氯乙酸后,再于25℃水浴下保温1h,在3000r/min下离心10min,再用5mL 12%三氯乙酸清洗沉淀物,最后将沉淀溶于10mL 8mol/L的脲溶液中,加0.04mL Ellman’s试剂,在412nm处测吸光度并做平行实验取平均值[9-10]。
巯基、二硫键计算公式:
巯基(SH,μmol/g)=73.53A412×D/C,其中A412是所测的吸光值,C是样品浓度,本实验即为15mg/mL,D为稀释因子,计算巯基时取5.02,计算总巯基时取10。二硫键的量即为总巯基数减去巯基数。
1.2.4 两种蛋白质的红外光谱分析 对冻藏处理前后的两种蛋白质测IR光谱,光谱范围为4000~550cm-1,光谱分辩率为4cm-1。
1.2.5 冻藏时间对面团质构性能的影响 取面粉50g加入30mL蒸馏水制成直径约3cm的面团,制作25个上述面团平均分为5组,除第一组不做任何处理外,其他四组先在-40℃下速冻40min,然后在-18℃下分别冻藏7、14、21、28d。冻藏处理后样品在测定质构时需在30℃下解冻15min,然后采用物性测试仪(TPA模式)测定面团的质构性能。
具体实验条件如下:使用质构仪P50探头,参数设定为:测前速度:3.00mm/s,测试速度:1.00mm/s,测后速度:5.00mm/s,样品模式:距离:5mm,间隔时间:3s,探头类型:自动,探头力度:5.0g。
2 结果与讨论
2.1麦醇溶蛋白和麦谷蛋白提取后的纯度分析
图1、图2分别为麦醇溶蛋白和麦谷蛋白的凝胶柱层析图。由图可知,提取出的麦醇溶蛋白只有一个峰,说明没有其他物质参杂。而麦谷蛋白的层析图出现两个峰则是由于麦谷蛋白有低相对分子质量亚基和高相对分子质量亚基所致。所以两种提取蛋白纯度较高,可以进一步分析研究使用。
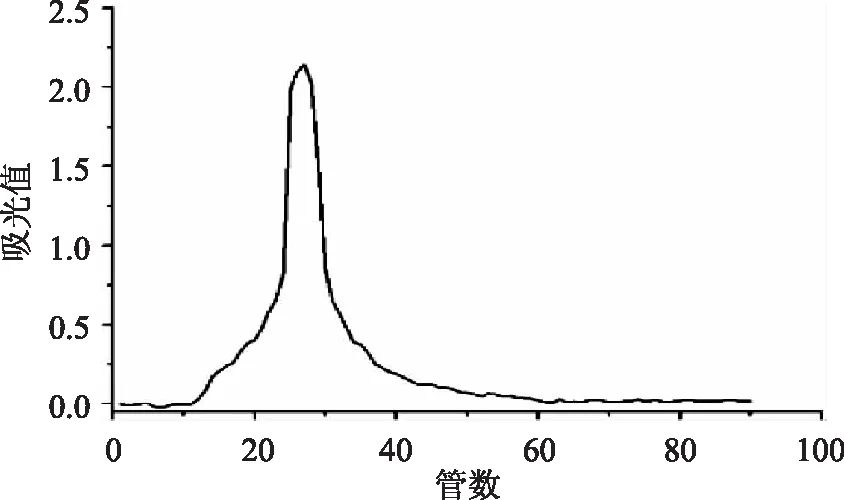
图1 麦醇溶蛋白柱层析图
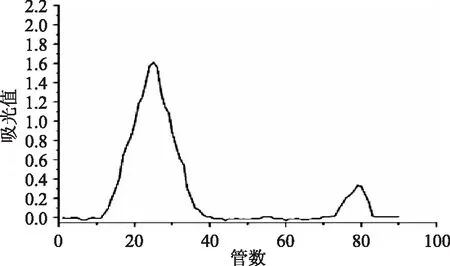
图2 麦谷蛋白柱层析图
2.2冻藏时间对麦醇溶蛋白和麦谷蛋白巯基和二硫键的影响
巯基和二硫键对维持蛋白质结构有重要作用。将速冻40min后的湿面筋蛋白放入-18℃下贮藏0~30d,冻藏时间分别为0、7、14、21、28d,再从中提出两种蛋白质分别测定巯基和二硫键的含量,以观察冻藏时间对麦醇溶蛋白和麦谷蛋白的巯基和二硫键的影响。
从图3和图4中可以看出,小麦醇溶蛋白和麦谷蛋白的自由巯基含量都逐渐增加,二硫键含量都逐渐降低。造成这种结果的原因有两方面,一是冻藏过程中冰晶随冻藏时间不断生长或重结晶,这种机械力使面筋蛋白的结构发生改变,导致蛋白分子内外部的二硫键部分断裂、分子内部的巯基暴露,进而使游离的巯基含量增加。另外则是由于自由水含量的减少,冻藏处理会引起浓缩效应,使蛋白质分子内和分子间二硫键交换反应增多[11]。
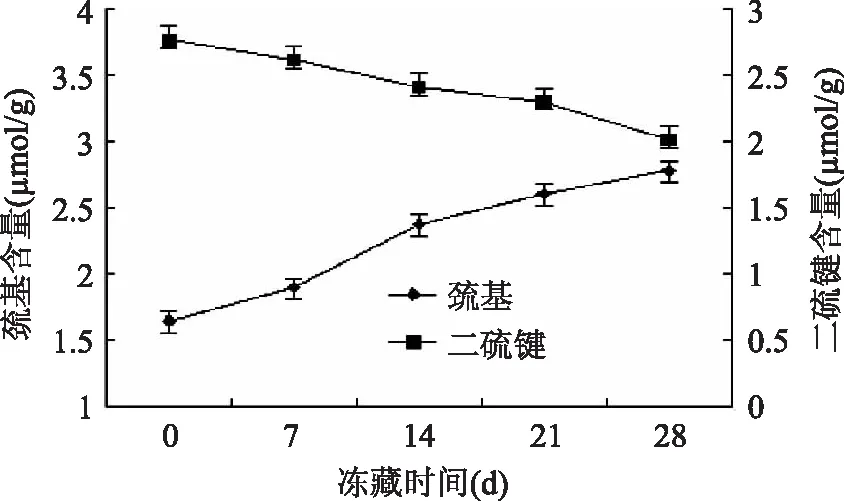
图3 冻藏时间对麦醇溶蛋白巯基和二硫键的影响
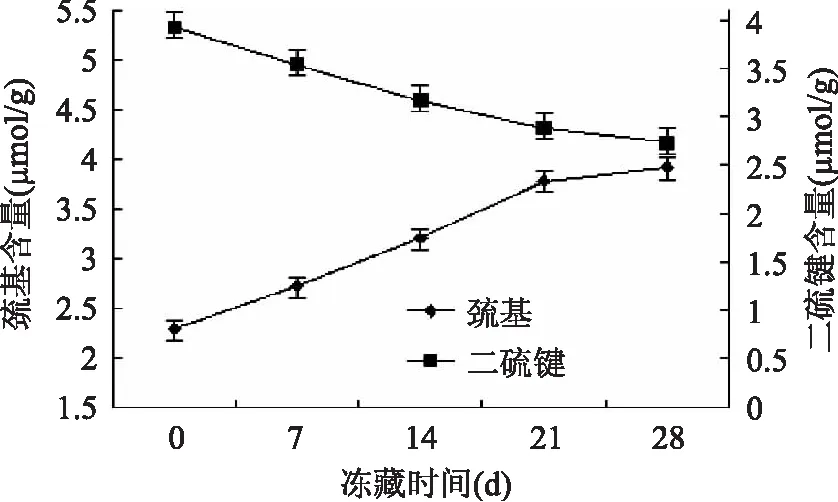
图4 冻藏时间对麦谷蛋白巯基和二硫键的影响
总体来看,麦谷蛋白的巯基和二硫键变化程度均要大于醇溶蛋白的巯基和二硫键变化程度。这可能是由两方面原因造成的:一是因为两种蛋白的结构不同,麦醇溶蛋白的二硫键均分布在分子内部,与外部环境有一定隔离,而麦谷蛋白分子外部也有裸露的二硫键,这些二硫键容易受到影响而发生断裂,故麦谷蛋白的变化程度要大于麦醇溶蛋白。二是由面筋蛋白的结构决定的,在面筋形成过程中,醇溶蛋白与麦谷蛋白相互作用,醇溶蛋白进入麦谷蛋白之中,麦谷蛋白起着拉动和包裹的作用,在面筋蛋白的外侧,而醇溶蛋白则相对在内侧[12]。由于麦谷蛋白紧邻外部环境,所以可能在速冻过程中受到环境的影响也比较大。
2.3冻藏处理后麦醇溶蛋白和麦谷蛋白的红外光谱分析
2.3.1 蛋白质红外酰胺Ⅲ带各峰的指认标准[14]其中α-螺旋的峰位置在1330~1290cm-1,β-折叠的峰位置在1220~1250cm-1,β-转角的峰位置在1265~1295cm-1。
2.3.2 冻藏处理麦醇蛋白、麦谷蛋白的二级结构指认、各结构含量及分析 通过去卷积和二阶导数处理的红外光谱酰胺Ⅲ带(1220~1330cm-1)的方法来研究冻藏时间对麦醇溶蛋白、麦谷蛋白二级结构的影响。
图5为冻藏0、14、28d后麦醇溶蛋白的红外光谱酰胺Ⅲ带原始图,经去卷积、二阶导数处理后,麦醇蛋白酰胺Ⅲ带中的各子峰的结构归属见表1;图6为冻藏0、14、28d后麦谷蛋白的红外光谱酰胺Ⅲ带原始图,经去卷积、二阶导数处理后,麦谷蛋白酰胺Ⅲ带中的各子峰的结构归属见表2。经冻藏处理后的麦醇溶蛋白、麦谷蛋白根据其各子峰面积占总峰面积的比等于对应结构含量的原则,对麦醇溶蛋白样品中各结构的含量进行计算(表1、表2)。
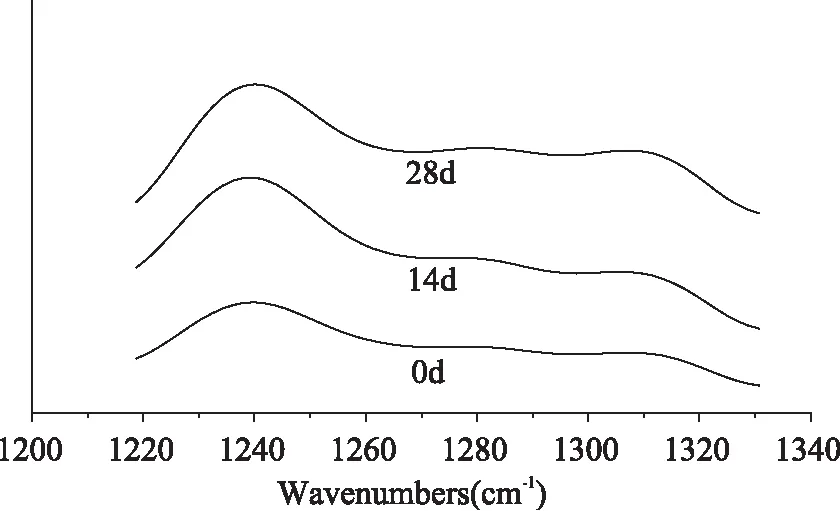
图5 冻藏处理0~28d后麦醇溶蛋白的红外光谱去卷积酰胺Ⅲ带
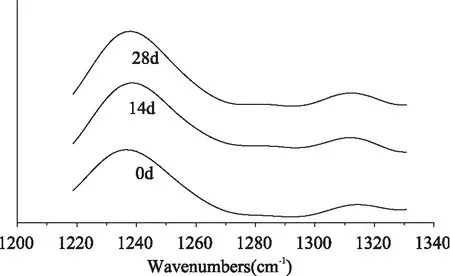
图6 冻藏处理0~28d后麦谷蛋白的红外光谱去卷积酰胺Ⅲ带
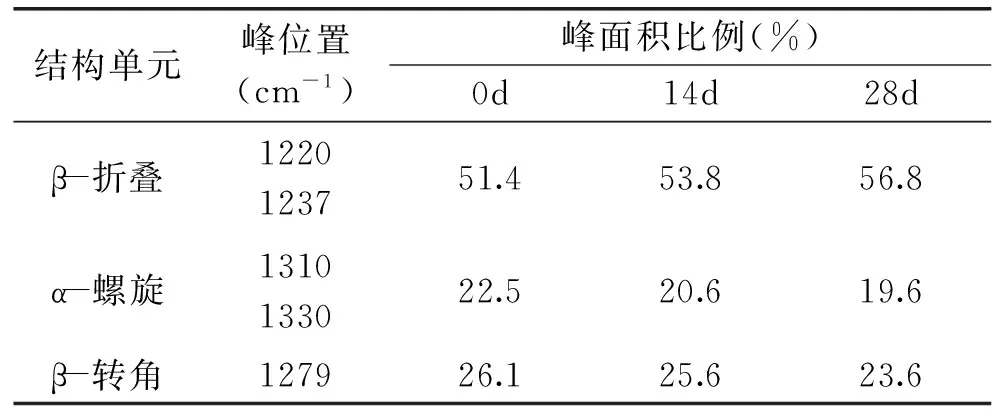
结构单元峰位置(cm-1)峰面积比例(%)0d14d28dβ-折叠1220123751.453.856.8α-螺旋1310133022.520.619.6β-转角127926.125.623.6
由表1可知,与未冻藏的麦醇溶蛋白相比,经冻藏处理后,其二级结构中α-螺旋、β-转角的含量也随着冻藏时间的延长逐渐减少,而β-折叠的含量则随着冻藏时间增加。
由表2可知,与未冻藏的麦谷蛋白相比,经冻藏处理后,其二级结构中α-螺旋和β-转角的含量随着冻藏时间的延长显著减少,而β-折叠则随着冻藏时间明显增加。

表2 冻藏处理0~28d后麦谷蛋白的 二级结构指认及各结构含量
由表1、表2可知,随着冻藏时间的增加,两种蛋白中的α-螺旋和β-转角的含量逐渐减少,β-折叠的含量持续增加。α-螺旋和β-转角减少是由于在冻藏过程中水合环境的改变,冰晶生长产生的机械力、自由水的减少使维持α-螺旋、β-转角的氢键断裂、减少,螺旋和转角结构遭到了破坏,形成小分子物质,在自由水减少的同时,小分子物质在非共价键的作用下发生相互聚集,从而使β-折叠含量升高。
麦醇溶蛋白为球状蛋白,麦谷蛋白多为大聚体。对比表1、表2可以看出麦谷蛋白中β-转角的含量明显少于麦醇溶蛋白,这是由于β-转角通常出现在球状蛋白表面的缘故。而麦谷蛋白α-螺旋和β-折叠的巨大变化是由于麦谷蛋白接触水合环境的面积远远大于麦醇溶蛋白,麦谷蛋白受水合环境的影响大,则对其α-螺旋结构的破坏程度和蛋白质聚集的加剧程度也比醇溶蛋白要大。
2.4冻藏时间对面团质构性能的影响
食品的TPA测定是指在对人们进食时咀嚼力的分析基础上,对食品机械特性中的硬度、粘着性、弹性、恢复性、咀嚼性等给以定量的评价。模拟进食时咀嚼动作对食品进行处理,从而能得到其在受力过程中所表现出的特性变化规律,不同的食品一般具有差别很大的质构性能。表3是在分别冻藏处理0、7、14、28d后,面团的TPA实验测定结果。
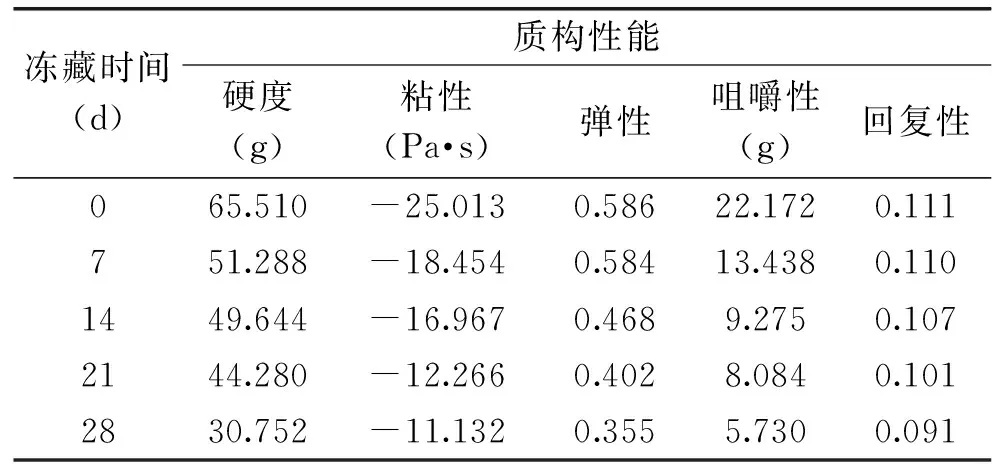
表3 冻藏时间对面团质构性能的影响
由表3可以看出,随着冻藏时间的延长,面团的各种质构性能均不同程度的下降,其中硬度、粘性和咀嚼性在0~7d内变化比较大,而弹性、回复性则在14~28d内变化比较大。
麦醇溶蛋白为单体蛋白,球形,与麦谷蛋白相比,表面积较小,分子间作用比较弱,其对面团的粘性和延展性起决定作用[15]。由于冷冻过程使醇溶蛋白二硫键减少,醇溶蛋白分子内部结构强度降低,则不可避免地造成面团的延展性降低;而β-转角对蛋白质的粘性有重要影响[16],冻藏后的麦醇溶蛋白红外图谱中β-转角的减少则会导致面团粘性降低。
麦谷蛋白聚集体的主要依靠二硫键维持大分子结构,而麦谷蛋白聚集体又是面团弹性和硬度的决定性因素,所以麦谷蛋白二硫键的减少导致麦谷蛋白大聚体的减少,这是面团的弹性和硬度降低的主要原因。α-螺旋结构性质稳定,坚韧又富有弹性,其含量的减少对面团的弹性和硬度的降低也起着重要作用。麦谷蛋白大聚体的形成会促进β-折叠的形成,但β-折叠结构的增多并不能完全说明麦谷蛋白大聚体数量的增多[14]。麦谷蛋白又是决定烘焙品质的主要因素,其与面团的强度和烘焙后面包的持气能力有非常重要的关系,冷冻对其结构的影响也直接导致面团强度下降,烘焙后产品的品质降低[13]。
3 结论
随着速冻时间的延长,两种蛋白质中的巯基含量增加,二硫键的含量减少。随着冻藏时间的延长,两种蛋白质中的α-螺旋、β-转角结构含量下降,而β-折叠结构则升高。
从实验中看出,麦谷蛋白巯基、二硫键、α-螺旋、β-转角和β-折叠含量的变化程度均大于麦醇溶蛋白,这可能是由于面筋蛋白形成时麦谷蛋白对麦醇溶蛋白的包裹、拉伸以及麦谷蛋白、醇溶蛋白本身的结构不同造成的结果。
通过质构性能的测定将面团性质的变化与两种蛋白二级结构的变化联系起来,实验表明速冻和冻藏对于麦谷蛋白和麦醇溶蛋白的结构有较大的影响,而两种蛋白质结构的变化使面团的性质也发生了很大的变化。我们可以通过保护两种蛋白质的结构来提高面团品质。
[1]Yi Jinhee,William L,Kerr. Combined effects of freezing rate,storage temperature and time on bread dough and baking properties[J]. Food Science and Technology,2009,42(9):1474-1483.
[2]Phimolsiripol Y,Siripatrawan U. Effects of freezing and temperature fluctuations during frozen storage on frozen dough and bread quality[J]. Journal of Food Engineering,2008,84(1):48-56.
[3]刘国琴,柳小军,李琳,等.冻藏时间对小麦湿面筋蛋白结构和热性能的影响[J].河南工业大学学报,2011,32(5):5-9.
[4]Schofield J D,Booth M R.Wheat proteins and their technological significance[J].Dvelelopments in food protein[C]. Applied Science Publication Ltd,Barking,Esses,UK.1983,2:1-65.
[5]司学芝,李建伟,王金水,等.麦醇溶蛋白和麦谷蛋白提取条件的研究[J].郑州工程学院学报,2004,25(3):33-39.
[6]Sugimotorr,TanakaK,Kasaiz.Improved Extraction of Rice Prolamin[J].Agric Biol Chem,1986,50(9):2409-2411.
[7]刘文豪,徐志宏,孙智达. 麦谷蛋白提取工艺研究[J]. 现代食品科技,2007,24(9):888-890.
[8]罗明江,罗春霞. Ellman’s试剂比色法测定食品中蛋白质的巯基和二硫键[J]. 郑州粮食学院学报,1896,1(1):92-95.
[9]郑田要,杨晓泉.不同物理法提取高温大豆粕中蛋白的比较研究[J]. 中国油脂,2009,34(12):22-26.
[10]易翠平,姚惠源,谢定. 碱处理对大米蛋白分子间作用力的影响[J]. 中国粮油学报,2007,22(4):1-4.
[11]Gu Jian Hua,Beekman A. Beyond Glass Transitions:Studying the Highly Viscous and Elastic Behavior of Frozen Protein Formulations Using Low Temperature Rheology and Its Potential Implications on Protein Stability[J]. Pharm Research,2013,30(2):387-401.
[12]王亚平,安艳霞. 小麦面筋蛋白组成、结构和功能特性[J]. 粮食与油脂,2011,1(1):1-4.
[13]韩彬,Shepherd K W. 低分子量谷蛋白亚基与醇溶蛋白的关系及其对小麦烘烤品质的影响[J]. 中国农业科学,1991,2(4):19-25.
[14]A S Sivam.,Application of FT-IR and Raman spectroscopy for the study of biopolymers in breads fortified with fibre and polyphenols[J]. Food Research International,2013,50(2):574-585.
[15]Graveland A,Bongers P,Bosveld P. Extraction and fractionation of flour proteins[J].Journal of the Science of Food and Agriculture,1979,30(1):71-84.
[16]Parvez I,Haris,FTIR spectroscopic characterization of protein structure in aqueous and non-aqueous media[J]. Journal of Molecular Catalysis B,1999,7(1):207-221.
Effect of the time of frozen on secondary structure of glutenin and gliadin and textural properties of dough
LIXue-hong,HUZhong-yu,LUYong,JINGXiao-yan,LIUYan-qi
(Department of Food and Bioengineering,Zhengzhou University of Light Industry,Zhengzhou 450002,China)
The changes of the contents of-SH and-SS and secondary structure in the wheat gliadin and glutenin at the condition of-18℃ for frozen storage 0~28days were investigated,and the relation of the changes of the contents of-SH and-SS and secondary structure in the wheat gliadin and glutenin were discussed. The results showed that the contents of-SS,β-folded increased,the content of-SH,α-helix,β-turn reduction decreased. These changes of glutenin were greater than gliadin. Texture results showed that:the viscosity,elasticity and hardness of frozen dough were influenced by the reduction of the contents of the SS,α-helix and β-turn structure in two proteins.
glutenin;gliadin;structure;frozen storage;texture
2013-06-13
李学红(1969-),女,博士,教授,研究方向:淀粉资源开发。
科技部十二五科技支撑计划项目(2012BAD37B06-08);2012年郑州市科技攻关项目。
TS205.7
:A
:1002-0306(2014)01-0083-05

