海兰褐壳蛋鸡含黄素单氧化酶3基因型频率分布及其对蛋品质的影响
王 晶 武书庚 张海军 岳洪源 齐广海
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放试验室,北京 100081)
蛋鸡的鱼腥味综合征(fish odour syndrome)系由含黄素单氧化酶3(flavin-contain monenzyme,FMO3)基因突变导致鸡体无法正常代谢三甲胺(trimethylamine,TMA),从而沉积于卵泡中,形成鱼腥味鸡蛋。近年来,消费者对畜禽产品安全性、营养保健性、风味等要求不断提高,其中,鱼腥味严重影响了鸡蛋的风味和可接受性。通过标记辅助选择可以剔除群体中易感基因型个体,减少鱼腥味鸡蛋的检出率,提高鸡蛋品质。因此,需要了解突变基因型个体在鸡群中的分布及基因型对鸡蛋风味的影响。1932年,Vondell首次报道了鱼腥味鸡蛋;1973年,确定TMA是引起鸡蛋鱼腥味的主要物质,95%存于蛋黄中[1]。TMA生成的前体物质有芥子碱、胆碱、氧化三甲胺等,当饲粮中添加菜籽及其加工物、鱼粉或胆碱时极易诱发鱼腥味蛋的产生[2-5]。正常情况下,体内产生的TMA在肝脏FMO3催化下,生成无味的氧化三甲胺,随尿液代谢出体外。通过鸡FMO3基因测序,发现位于编码区第984个碱基位置的突变[由腺嘌呤(A)突变成胸腺嘧啶(T)]与蛋鸡鱼腥味综合征显著相关,该位点引起FMO3第329个氨基酸由苏氨酸突变为丝氨酸,导致FMO3功能异常[6]。在人和牛上的研究也表明,FMO3基因突变能够引起鱼腥味综合征[7-8]。针对T329S位点的变化,可将蛋鸡个体分为AA(野生型)、AT(杂合型)和TT(突变型)基因型。FMO3基因位于鸡的8号染色体末端,所在区域包括多个与经济性状有关的基因和数量遗传位点[9]。相关研究多集中于基因型、前体物质水平对鸡蛋TMA含量的影响上,然而关于基因型频率分布、基因型对蛋品质的影响等方面报道较少。本试验旨在检测FMO3 T329S突变位点在我国商品代海兰褐壳蛋鸡群体中的分布,观察基因型对蛋品质和鸡蛋TMA含量的影响,为鸡蛋鱼腥味的研究积累基础资料。
1 材料与方法
1.1 海兰褐产蛋鸡FMO3基因型频率分布
1.1.1 试验动物
试验从中国农业科学院饲料研究所留民营蛋鸡试验基地随机选择150日龄海兰褐蛋鸡800只作为试验鸡。
1.1.2 基因组DNA提取及聚合酶链式反应(PCR)反应体系及程序
每只鸡翅下静脉采血,乙二胺四乙酸(EDTA)抗凝,用血液基因组DNA提取试剂盒(TIANGEN,DP318)提取 DNA。根据 GenBank上鸡FMO3的基因序列(GI:AJ431390),针对 T329S位点设计引物,引物序列为:上游5'-ATGAGGCTATCTGTTCCCAAAG-3',下 游 5'-GACCAATCCAATGACTGCCA-3',扩增片段长度为397 bp。
PCR 扩增反应体系为 10 μL:dd H2O 8 μL,10 μmol/L上下游引物各 0.1 μL,10 × Taq PCR Mix 1 μL,DNA 模板 0.3 μL,DreamTaq(5 U/μL)0.06 μL,dNTP(2.5 mmol/L)0.5 μL。PCR 反应程序为95℃ 5 min;94℃ 30 s,66.1℃ 30 s,72℃30 s,35个循环;72℃延伸10 min;4℃保温。
1.1.3 酶切反应体系及程序
采用聚合酶链式反应-限制性片段长度多态性分析方法(PCR-RFLP)检测个体基因型,限制性内切酶为BsrⅠ,该内切酶所切序列为:5'-ACTGGN↓-3',3'-TGAC↑CN-5'。其中箭头所指位置为酶切位点,酶切温度65℃,时间4 h。酶切体系20 μL:PCR 产物 10 μL,dd H2O 7 μL,10 × Buffer 2 μL,BrsⅠ酶 1 μL。酶切完成后,2% 的琼脂糖凝胶(含0.3%Golden View)电泳检测,EDAS290凝胶成像(Kodak公司)系统观察结果。
1.2 FMO3基因型对蛋品质和鸡蛋TMA含量的影响
1.2.1 试验设计
46周龄时,选用已确定FMO3基因型海兰褐产蛋鸡120只,分为3个组,其中AT基因型、TT基因型各54只,每组6个重复,每个重复9只;AA基因型12只,每组6个重复,每个重复2只。预试期1周,试验期6周。
1.2.2 试验饲粮和饲养管理
参照《鸡的饲养标准》(NY/T 33—2004),配制玉米-豆粕型试验饲粮(表1)。所有参试蛋鸡采用相同的常规饲养管理。
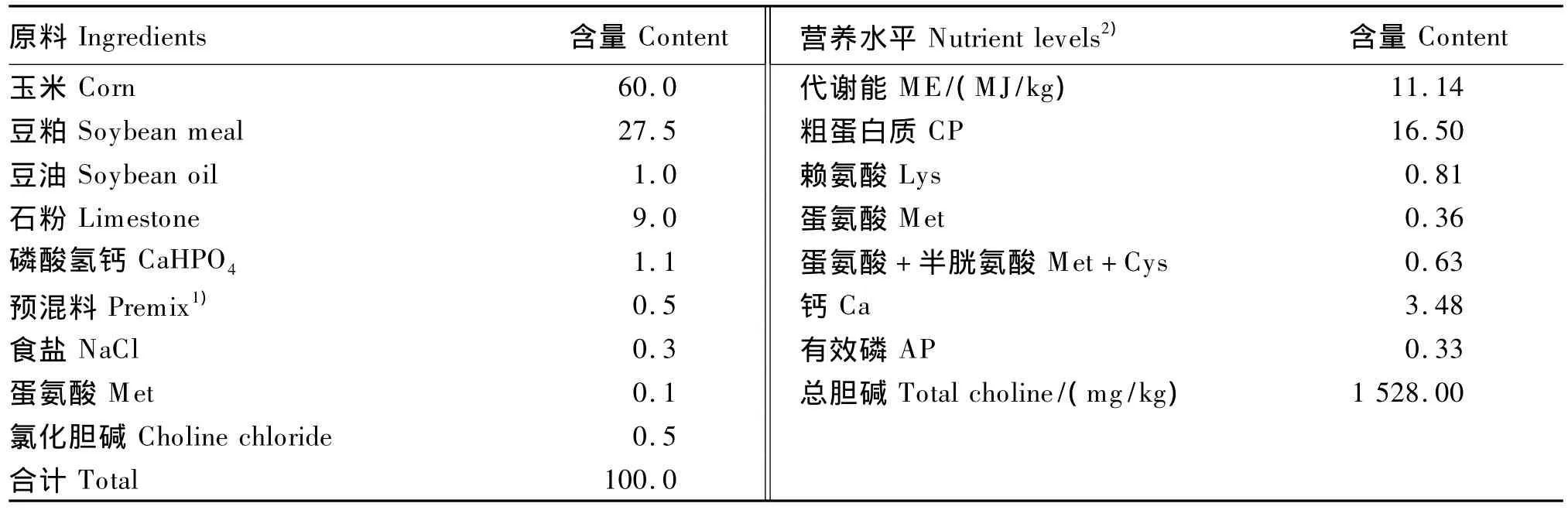
表1 试验饲粮组成及营养水平Table 1 Composition and nutrient levels of the experimental diet %
1.2.3 测定指标及方法
蛋品质测定:于试验第40~42天,每重复收集6枚鸡蛋(AA基因型收集4枚),4℃保存。蛋黄颜色、蛋白高度、哈夫单位采用鸡蛋品质测定仪(以色列ORKA Food Technology Ltd.)测定;蛋壳厚度用蛋壳厚度测量计(ESTG-1,以色列ORKA Food Technology Ltd.)测定;蛋壳强度用蛋壳强度分析仪(Egg Force Reader,以色列 ORKA Food Technology Ltd.)测定。
鸡蛋 TMA 测定:试验第7、14、21、28、35 和42天,每重复取3枚蛋,分离蛋黄,混匀,取50 mL于-20℃保存,记录蛋重和蛋黄重。采用苦味酸比色法[10]测定蛋黄TMA含量。
1.3 数据统计分析
海兰褐产蛋鸡FMO3基因型频率分布:根据PCR-RFLP检测结果,统计不同基因型个体数量,计算群体基因频率和基因型频率,采用SPSS 16.0中的卡方检验进行哈代-温伯格(Hardy-Weinberg)平衡性检测。
FMO3基因型对产蛋鸡蛋品质影响:采用SPSS 16.0软件的one-way ANOVA程序进行统计分析,Duncan氏法进行多重比较,以P<0.05为差异显著性标准。结果以“平均值±标准差”表示。
2 结果
2.1 海兰褐产蛋鸡FMO3基因型频率分布
2.1.1 PCR-RFLP分析
根据设计引物扩增出的条带特异性较好,大小与理论值一致。酶切结果(图1)表明,TT基因型为1条带,397 bp;AA基因型为2条带,267和130 bp;AT基因型为3条带,分别为397、267和130 bp。
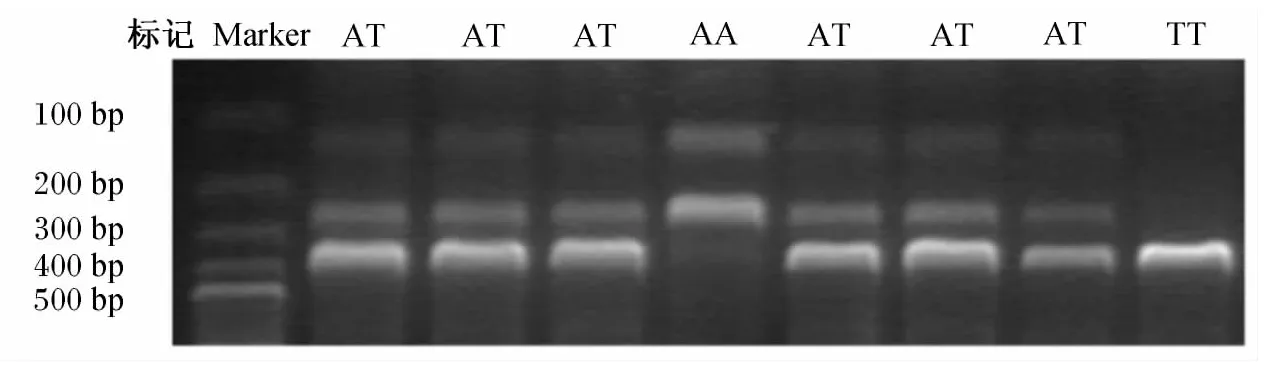
图1 FMO3基因突变位点的PCR-RFLP检测Fig.1 PCR-RFLP detect of mutation in FMO3 gene
2.1.2 序列分析
对FMO3基因在海兰褐蛋鸡血液DNA中的扩增片段突变情况进行分析,将AA、AT和TT基因型个体的PCR扩增产物进行测序,结果见图2。图2中黑框标明变异位点。通过测序检验,表明采用PCR-RFLP检测能准确地针对T329S位点分离筛选FMO3基因型。
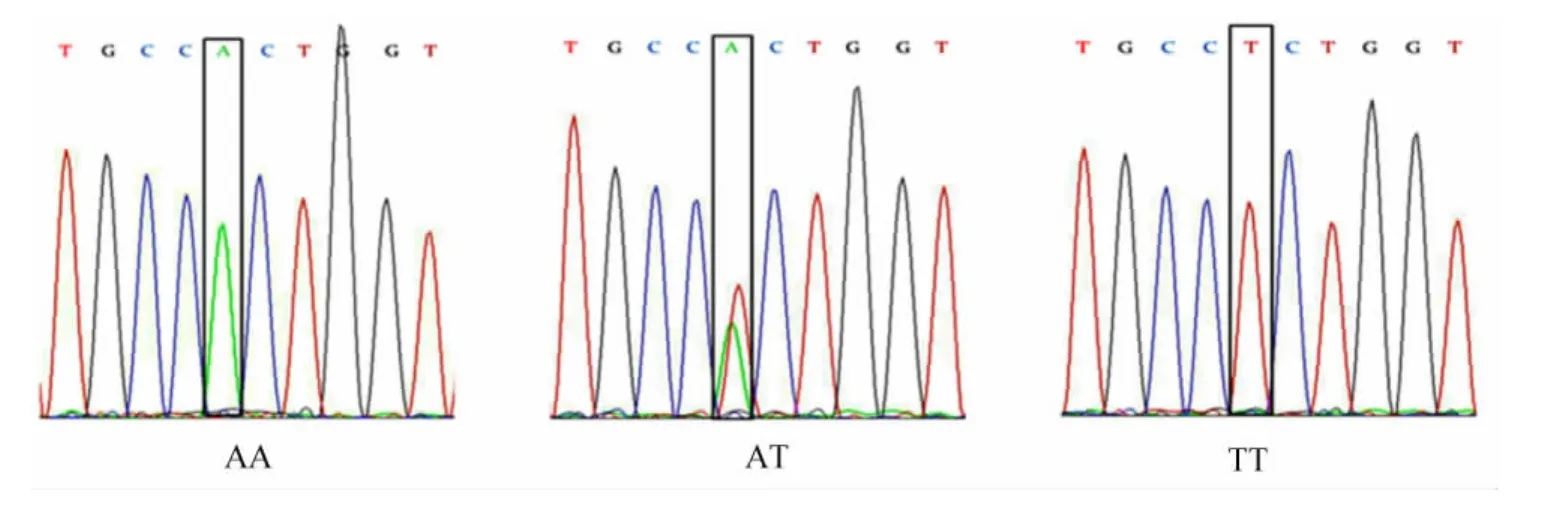
图2 FMO3基因序列对比Fig.2 Sequence comparison of FMO3 gene
2.1.3 基因型频率及等位基因频率分析
根据PCR-RFLP检测结果,统计海兰褐壳蛋鸡群体内FMO3基因型频率及等位基因频率(表2,有效数据731只)。在海兰褐蛋鸡品系内,对该位点而言,AT和TT基因型频率明显地高于AA基因型,T等位基因频率高于A等位基因。用卡方检验对FMO3基因型分布进行服从Hardy-Weinberg平衡的检验,表明该基因在海兰褐蛋鸡品系内极显著偏离了Hardy-Weinberg平衡(P<0.001,表 3)。
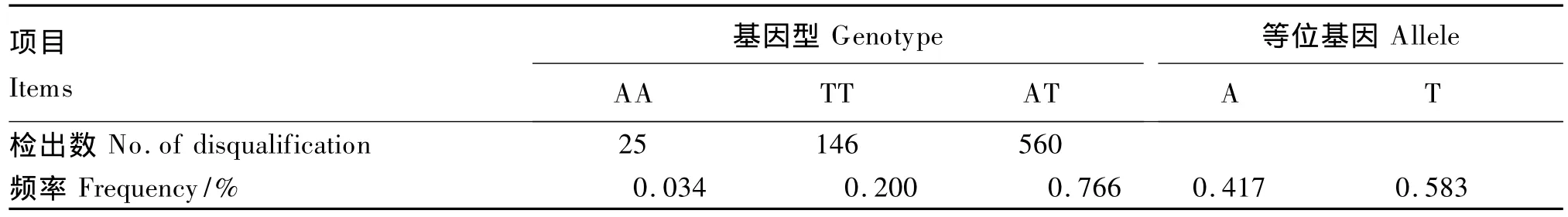
表2 海兰褐壳蛋鸡FMO3基因型频率及等位基因频率Table 2 Frequencies of genotype and allele of FMO3 gene of Hy-Line brown laying hens

表3 FMO3基因T329S位点Hardy-Weinberg平衡检验Table 3 Hardy-Weinberg equilibrium test for T329S site of FMO3 gene
2.2 FMO3基因型对蛋品质和鸡蛋TMA含量的影响
由表4可知,FMO3基因型对鸡蛋常规品质无显著影响(P>0.05)。由表5可知,FMO3基因型显著影响了蛋黄TMA含量(P<0.05)。试验第7天,TT基因型蛋黄中TMA含量显著高于AA基因型(P<0.05),而与AT基因型无显著差异(P>0.05);试验第35和42天,TT基因型蛋黄中TMA含量显著高于AA和AT基因型(P<0.05)。
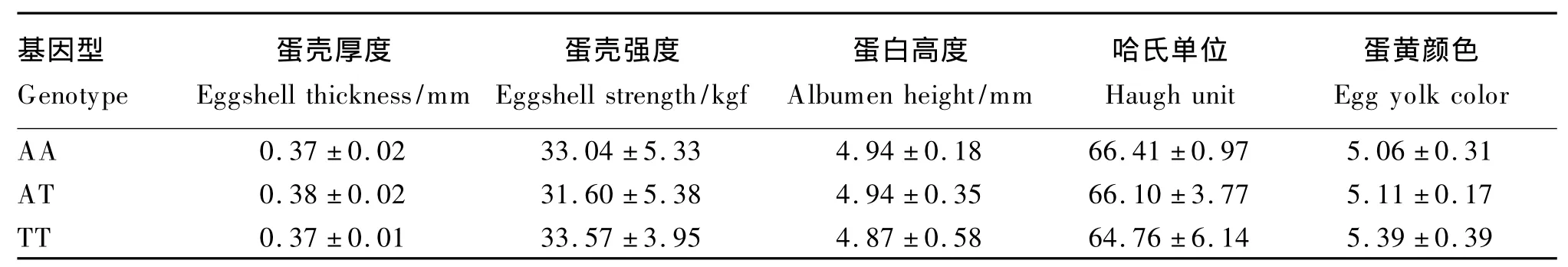
表4 FMO3基因型对蛋鸡蛋品质的影响Table 4 Effects of FMO3 genotype on egg quality of laying hens
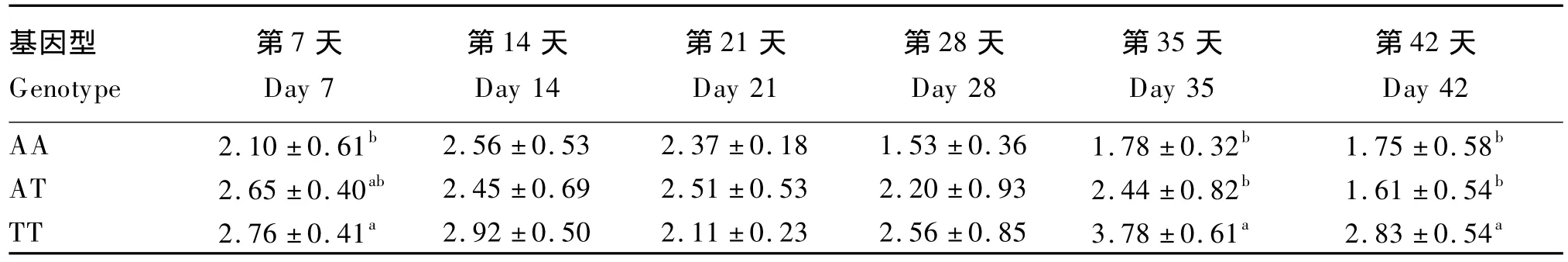
表5 FMO3基因型对蛋黄三甲胺含量的影响Table 5 Effects of FMO3 genotype on TMA content in egg yolks μg/g
3 讨论
3.1 海兰褐产蛋鸡FMO3基因型频率分布
鸡蛋的鱼腥味问题一直困扰着蛋鸡生产者和学者。20世纪70年代,有学者提出鸡的常染色体半显性基因突变引起FMO3活性降低是导致产生腥味蛋的遗传因素[11-12]。研究证实,FMO3是体内TMA代谢的唯一有效酶[13]。因遗传背景及选育程度等因素影响,T329S突变位点在各鸡种中的分布不同。伊莎褐蛋鸡群体中,TT基因型频率约 15%[6,14];罗曼褐蛋鸡经剔除突变位点后,突变基因型频率已从 14.44%[6]降到了1.00%[14]。我国地方鸡种中,丝羽乌骨鸡TT基因型频率高达60.40%[15],太 湖 鸡 为 20.40%,北 京 油 鸡 为14.60%[16]。本试验中,海兰褐蛋鸡TT基因型个体数占群体20.0%,与Ward[14]的检测结果相似(检测个体数 598只,AA 1%,AT 79%,TT 20%)。张龙超[15]所测父母代海兰褐母系(检测个体数79只)FMO3基因型频率分别为68.4%(AA)、17.7%(AT)、13.9%(TT)。二者结果都显示该位点在海兰褐蛋鸡群体中均处于Hardy-Weinberg不平衡状态。由于试验选用的为商品代蛋鸡,对该品系的培育和对经济性状的人为选择可能是造成FMO3基因型分布不平衡的主要原因。
3.2 FMO3基因型对蛋品质和鸡蛋TMA含量的影响
FMO3基因型对鸡蛋常规品质的影响报道较少。本试验结果表明,基因型对蛋品质无显著影响。此外,基因型间蛋黄比例、含水量、粗蛋白质和粗脂肪含量都无显著差异(数据未显示)。因此选育过程中,可忽略对鸡蛋上述品质的影响。
鸡蛋中TMA含量受遗传因素和营养因素的共同作用。T329S突变导致FMO3酶活性的下降是造成TT基因型个体代谢TMA异常的遗传因素[10]。FMO3基因型对蛋黄TMA含量的影响主要表现为高剂量前体物存在时,TT和AT基因型蛋鸡蛋黄TMA含量显著升高。而常规水平添加氯化胆碱(0~2 200 mg/kg)可被鸡体充分吸收,导致无足够的胆碱进入盲肠用于TMA的生成,不会诱发突变个体的鱼腥味综合征[2,5,17]。本试验中,受饲粮前体物剂量所限,鸡蛋TMA含量低于嗅觉阈值,虽未表现出鱼腥味,但可见TT基因型蛋鸡TMA代谢的异常,提示生产中需注意TT基因型个体对鸡蛋风味的潜在危害。
感官可探测全蛋中TMA的最低含量约为1 μg/g[18],蛋黄中为 3.79 μg/g[19]。消费者可以接受蛋黄中TMA含量略高于感官检测基准点的鸡蛋[5]。本试验中,TT基因型蛋鸡鸡蛋TMA含量在第7、35和42天时显著高于AA基因型,最大值为3.58 μg/g,均低于人们的嗅觉阈值,在可接受性范围内。
4 结论
商品代海兰褐壳产蛋鸡群体中(n=731),AA、AT和TT基因型频率分别为3.4%、76.6%和20.0%,偏离了Hardy-Weinberg平衡状态。饲粮中常规水平添加氯化胆碱,可见TT基因型蛋鸡TMA代谢异常,但不会诱发产生鱼腥味鸡蛋。
[1]HOBSON-FROHOCK A,LAND D G,GRIFFITHS N M,et al.Egg taints:association with trimethylamine[J].Nature,1973,243(5405):304-305.
[2]KRETZSCHMAR K,DAÄNICKE S,SCHMUTZ M,et al.Interactions of flavin containing monooxygenase 3(FMO3)genotype and feeding of choline and rapeseed cake on the trimethylamine(TMA)content in egg yolks of laying hens[J].Archives of Animal Nutrition,2009,63(3):173-187.
[3]DÄNICKE S,UEBERSCHÄR K H,REESE K,et al.Investigations on the effects of rape oil quality,choline and methionine concentration in diets for laying hens on the trimethylamine content of the eggs,on trimethylamine metabolism and on laying performance[J].Archives of Animal Nutrition,2006,60(1):57-59.
[4]PEARSON A W,GREENWOOD N M,BUTLER E J,et al.The involvement of trimethylamine oxide in fish meal in the production of egg taint[J].Animal Feed Science and Technology,1983,8(2):119-127.
[5]WARD A K,CLASSEN H L,BUCHANAN F C.Fishy-egg Tainting is recessively inherited when brown-shelled layers are fed canola meal[J].Poultry Science,2009,88(4):714-721.
[6]HONKATUKIA B M,REESE K,PREISINGE R,et al.Fishy taint in chicken eggs is associated with a substitution within a conserved motif of the FMO3 gene[J].Genomics,2005,86(2):225-232.
[7]MARKS R,GREAVES M,PROTTEY C,et al.Trimethylaminuria:the use of choline as an aid to diagnosis[J].British Journal of Dermatology,1977,96(4):399-402.
[8]LUNDÉN A,GUSTAFSSON V,IMHOF M,et al.High trimethylamine concentration in milk from cows on standard diets is expressed as fishy off-flavour[J].Journal of Dairy Research,2002,69(3):383-390.
[9]FULTON J.Molecular genetics in a modern poultry breeding organization[J].World’s Poultry Science Journal,2008,64(2):171-176.
[10]王晶.FMO3基因型和胆碱对鸡蛋三甲胺含量影响的研究[D].博士学位论文.哈尔滨:东北农业大学,2009.
[11]BOLTON W,CARTER T,JONES R M.The hen’s egg:genetics of taints in eggs from hens fed on rapeseed meal[J].British Poultry Science,1976,17(3):313-320.
[12]PEARSON A W,BUTLER E J,FRANK CURTIS R,et al.Effect of rapeseed meal on trimethylamine metabolism in the domestic fowl in relation to egg taint[J].Journal of Science of Food and Agriculture,1979,30(8):799-804.
[13]LANG D H,YEUNG C K,PETER R M,et al.Isoform specificity of trimethylamine N-oxygenation by human flavin-containing monooxygenase(FMO)and P450 enzymes:selective catalysis by FMO3[J].Biochemical Pharmacology,1998,56(8):1005-1012.
[14]WARD A K.Genetic and dietary interactions of fishyegg taint in brown-shelled laying hens[D].Master Thesis.Saskatoon:University of Saskatchewan,2008.
[15]张龙超.鸡蛋品质性状遗传参数及相关候选基因研究[D].博士学位论文.北京:中国农业大学,2007.
[16]王晓亮.遗传与环境因素对鸡蛋品质性状参数的影响及相关候选基因的研究[D].博士学位论文.北京:中国农业大学,2009.
[17]GOH Y K,CLANDININ D R,ROBBLEE A R.The effect of level of sinapine in a laying ration on the incidence of fishy odor in eggs from brown-shelled egg layers[J].Canadian Journal of Animal Science,1979,59(2):313-316.
[18]GRIFFITHS N M,LAND D,HOBSON-FROHOCK A.Trimethylamine and egg taint[J].British Poultry Science,1979,20(6):555-558.
[19]WANG J,WU S G,ZHANG H J.Trimethylamine deposition in the egg yolk from laying hens with different FMO3 genotypes[J].Poultry Science,2013,92(3):746-752.

