酿酒葡萄皮渣经贮存和红外干燥后的质量变化比较
,,,2,,2,3,,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.陕西省葡萄与葡萄酒工程研究中心,陕西杨凌 712100;3.合阳葡萄实验示范站,陕西渭南 715300)
酿酒葡萄皮渣经贮存和红外干燥后的质量变化比较
隋银强1,郑亚蕾1,杨继红1,2,李华1,2,3,王华1,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.陕西省葡萄与葡萄酒工程研究中心,陕西杨凌 712100;3.合阳葡萄实验示范站,陕西渭南 715300)
本文研究了酿酒葡萄皮渣在未经干燥下的贮存过程中及其经红外干燥处理后的质量变化,一方面对其在存放过程中的质量变化进行分析,另一方面探究红外干燥处理酿酒葡萄皮渣的可能性。处理方式为将收集到的葡萄皮渣分别贮存0、1、3、5和7d后晒干,贮存1d的皮渣分别进行葡萄皮和葡萄籽超微粉碎处理,其余的只进行葡萄籽超微粉碎处理;取适量贮存1d的皮渣进行红外干燥并分别进行葡萄皮和葡萄籽超微粉碎处理。通过对超微粉的微生物(酵母菌、霉菌和细菌)、单体酚(8种)和真菌毒素(展青霉毒毒素和赭曲霉毒素)的含量变化进行检测分析,发现随着贮存时间的延长,酵母菌含量先升高后降低,霉菌和细菌以及真菌毒素含量均显著升高,各单体酚含量则显著降低;贮存1d后进行红外干燥处理的超微粉的微生物含量明显降低,说明红外干燥具有很好的灭菌效果,各单体酚有一定损失,而真菌毒素含量没有明显变化。综合考虑,酿酒葡萄皮渣收集后应立即进行干燥处理,红外干燥可以用于酿酒葡萄皮渣的干燥处理。
葡萄皮渣,红外干燥,灭菌,单体酚,真菌毒素
据OIV统计,在2012年,全世界生产出2.52亿升葡萄酒。在葡萄酒生产过程中,每年会产生约占葡萄总质量20%的皮渣,约为800万吨[1]。
葡萄皮渣包括葡萄皮和葡萄籽,含有丰富的具有高利用价值的成分,包括苹果酸、酒石酸以及膳食纤维[2]等。尤其是具有许多生理作用(抗氧化、抗衰老、抗癌和抑制心脑血管疾病等)的多酚和原花青素物质[3-6],大量存在于葡萄皮渣中。
酿酒葡萄皮渣为酿酒过程中经浸渍发酵(白葡萄酒制作中葡萄皮渣在发酵前分离)后分离出的副产物,含有大量的水分、糖以及大量的微生物(酵母菌、霉菌和细菌)。因此,若不及时进行干燥处理,酿酒葡萄皮渣会在短时间内变质,降低利用价值。目前最常用的干燥方式为晒干,但是晒干过程中原料容易受到污染,且其干燥速度慢、对天气依赖性强,操作性差。传统的热风干燥也是一种常用的干燥方法,干燥速度相对较快,但是热风干燥的产品的品质较低,而且能源利用率低、能耗大[7]。近些年,红外干燥作为一种高效的干燥方法已经广泛用于诸如洋葱、草莓、苹果、杏仁等果蔬的干燥处理,其干燥速度快、干燥品质好、干燥过程方便易操作而且杀菌效果明显[7-9],拥有许多热风干燥和自然晒干没有的优点。本实验室在之前的实验中已经比较了传统热风干燥与红外干燥对酿酒葡萄皮渣的干燥处理,证明了无论是在干燥效率、干燥质量还是灭菌效果方面,红外干燥都明显优于热风干燥。
本文的研究目的包括两方面:一是通过对未经干燥处理的酿酒葡萄皮渣在贮存过程的质量变化进行检测分析,探究其质量变化规律;二是比较经红外干燥处理后的质量变化,探究红外干燥的应用可行性。
1 材料与方法
1.1材料与仪器
2013年于西北农林科技大学葡萄酒学院葡萄园采摘媚丽葡萄(葡萄酒学院选育葡萄品种)进行酿酒。经发酵后充分压汁至无葡萄汁流出,分离出葡萄皮渣并收集。
LC2010A高效液相色谱仪 日本岛津公司;6B-I型贝利微粉机 济南贝利粉体技术工程有限公司;404-1型红外线干燥箱 上海实验仪器厂;DGX-9053B热风干燥箱 上海福玛实验设备有限公司;KQ-250DE超声波清洗器 昆山超声仪器有限公司;R214 旋转蒸发器 上海申生科技有限公司;TGL-18M 高速冷冻离心机 上海卢湘仪离心机仪器有限公司。
孟加拉红培养基 北京奥博星生物技术有限责任公司;平板计数琼脂培养基 北京路桥技术有限公司;没食子酸、儿茶素、绿原酸、丁香酸、表儿茶素、香豆酸、阿魏酸和芦丁等标准样品纯度均为色谱纯,金测分析技术天津有限公司;用于HPLC的甲醇、乙腈和乙酸为色谱纯,其他试剂均为分析纯。
1.2实验方法
1.2.1 葡萄皮、籽超微粉碎处理 将适量酿酒葡萄皮渣放置1d后进行红外干燥处理,此外将其余皮渣分别存放0、1、3、5和7d后进行自然晒干处理。将红外干燥处理后的葡萄皮和葡萄籽分离,分别进行超微粉碎处理,样品记为H1-皮粉、H1-籽粉;将存放1d后晒干处理的葡萄皮、籽超微粉分别记为S1-皮粉、S1-籽粉。其它存放并晒干处理的样品只进行葡萄籽超微粉碎处理,分别记为S0-籽粉、S3-籽粉、S5-籽粉和S7-籽粉。
葡萄皮超微粉处理参照范毅强[10]等人的方法,葡萄籽超微粉参照李华[11]等人的方法。
红外干燥是将皮渣(250g)平铺于底部有细孔的不锈钢托盘中(直径25cm);物料与红外发射源距离约20cm,干燥时间为42min,干燥后的皮渣干基含水率<10%。
1.2.2 微生物检测 参考GB4789.15-2010对酵母菌、霉菌进行测定;参考GB4789.2-2010对细菌菌落总数进行测定。结果以每克超微粉干基所含微生物菌落数的对数表示/lg(CFU/g DW)。
1.2.3 单体酚含量测定 样品提取:将样品(葡萄籽超微粉称取5g,葡萄皮超微粉称取2.5g,精确至0.001g)于50mL离心管中加入25mL 80%甲醇,超声提取30min,5000r/min离心10min,收集上清液,重复提取三次。合并上清液,定性滤纸过滤,35℃旋转蒸干。用甲醇溶解定容至25mL,-20℃冰箱中保存备用。测定前用0.45μm针头式过滤器过滤。
HPLC条件:色谱柱:反相C18柱(250mm×4.6mm,5μm);检测波长:280nm;柱温:30℃;进样量:10μL;流速:1.0mL/min;流动相A:甲醇,流动相B:超纯水(用磷酸调pH为2.6)。梯度洗脱程序:0min 15% A,85%B;15~25min 25% A,75% B;65 min 75% A,25% B;70 min 15% A,85% B。
结果以每千克超微粉干基所含单体酚的毫克数表示(mg/kg DW)。
1.2.4 真菌毒素测定 展青霉毒素和赭曲霉毒素是水果中存在最广泛的真菌毒素,而且这两种毒素对人体危害很大,具有很好的研究代表性,因此本实验选取这两种真菌毒素进行测定。
1.2.4.1 展青霉毒素测定 样品提取:称取5g(准确至0.001g)样品于50mL离心管中,加入25mL乙腈,涡旋3min,5000r/min离心10 min,吸取上清液,过滤,于35℃旋转蒸干,用2mL乙腈溶解。使用0.22μm注射式过滤器将溶液过滤。
HPLC条件:检测波长:276 nm;色谱柱:反相C18柱(250mm×4.6mm,5μm);柱温:30℃;流动相:V(乙腈)∶V(水)=1∶9;流速:1mL/min;进样量:20μL;
1.2.4.2 赭曲霉毒素测定 提取方法同1.3.4.1。HPLC条件:荧光检测器检测波长:激发波长330nm,发射波长460nm;色谱柱:反相C18柱(250mm×4.6mm,5μm);柱温:30℃;流动相:V(乙腈)∶V(水)∶V(乙酸)=99∶99∶2;流速:1.0 mL/min;进样量:20μL。
真菌毒素含量结果以每千克超微粉干基所含毒素的微克数表示(μg/kg DW)。
1.2.5 数据分析 所有实验均重复3次,结果以每单位干基的物质含量表示,取平均值。数据采用ANOVA进行邓肯氏多重差异分析(p<0.05)(SPSS19.0)。
2 结果与讨论
2.1微生物含量
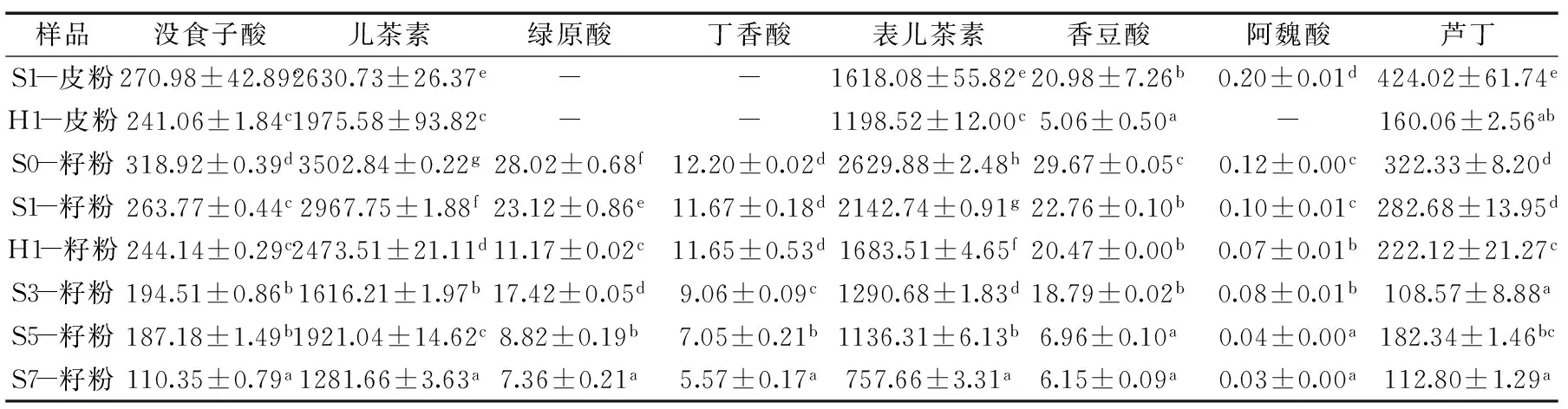
表1 葡萄皮和葡萄籽超微粉的单体酚含量(mg/kg DW)Table 1 Phenolic acid content of wine grape skin and seed ultramicro-pulverised powder(mg/kg DW)
注:同列中不同字母表示差异显著(p≤0.05);“-”表示未检测出。
表1为不同处理的葡萄皮和葡萄籽超微粉的微生物(酵母菌、霉菌和细菌)含量。从表1中可以看出,经过红外干燥处理,无论是葡萄皮超微粉还是葡萄籽超微粉,其各种微生物的含量均明显降低(H1-皮粉与S1-皮粉,H1-籽粉与S1-籽粉之间比较),差异显著(p≤0.05);而且,H1-籽粉的微生物含量也显著低于S0-籽粉的微生物含量(p≤0.05)。这两个现象充分说明红外干燥处理具有很好的灭菌效果。
通过S1-皮粉与S1-籽粉之间的微生物含量比较,可以发现,相比葡萄籽超微粉,葡萄皮超微粉具有更高的微生物含量。这可能是由葡萄皮超微粉和葡萄籽超微粉的特点决定的:单位面积的葡萄皮和葡萄籽的微生物含量相同,但是葡萄皮的面积与体积比要大于葡萄籽的面积与体积比,经超微粉碎处理后,单位体积的葡萄皮超微粉含有更高的微生物含量。此外,H1-皮粉和H1-籽粉之间的细菌含量有明显差异,而酵母菌和霉菌含量没有明显差异(p≤0.05),这可能是由红外干燥的灭菌作用造成的:红外干燥后葡萄皮和葡萄籽的微生物含量较少,降低了它们之间的差异性。
比较贮存不同时间后晒干处理的葡萄籽超微粉的微生物含量,可以发现S7-籽粉含有最高的细菌和霉菌含量,而S0-籽粉的这两种微生物含量最低,即随着贮存时间的延长,细菌和霉菌的微生物含量不断增大。但是,与细菌和霉菌的变化不同,葡萄籽在存放0~3d后晒干制成的葡萄籽超微粉的酵母菌含量不断升高,但是存放5d后其酵母菌含量明显低于存放3d时葡萄籽超微粉的酵母菌含量,即S5-籽粉和S7-籽粉的酵母菌含量要显著低于S3-籽粉的酵母菌含量。这可能是由于酵母菌与霉菌之间生长竞争造成的,在这个环境下(贮存过程中或者在孟加拉红培养基中),霉菌的生长抑制了酵母菌的生长。
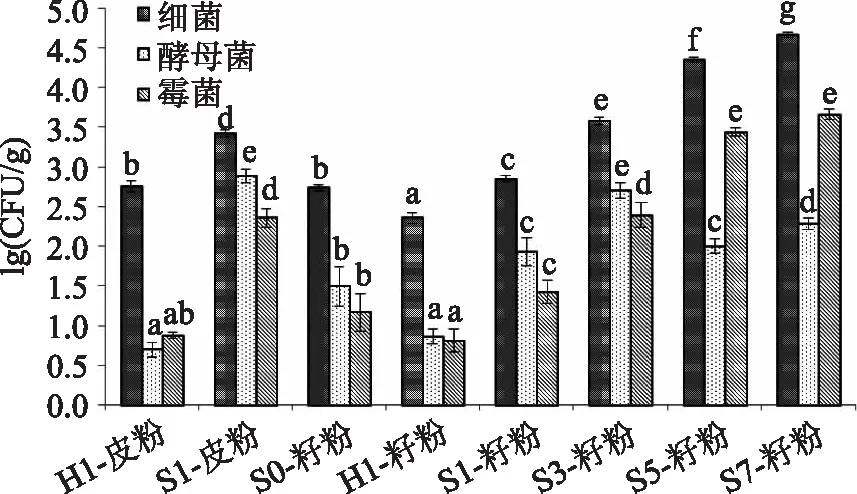
图1 葡萄皮和葡萄籽超微粉的微生物含量Fig.1 Microorganism count of wine grape skin and seed ultramicro-pulverised powder注:不同字母表示差异性显著(p≤0.05)。
2.2单体酚含量
表1为各处理超微粉的单体酚组成及含量。
从表1中可以看出,相比葡萄籽超微粉,葡萄皮超微粉不含有绿原酸和丁香酸。通过比较S1-皮粉与S1-籽粉的单体酚含量,可以发现除了没食子酸、阿魏酸和芦丁外,葡萄皮中其它种类单体酚的含量均低于葡萄籽中的单体酚含量。
通过比较S1-皮粉与H1-皮粉、S1-籽粉与H1-籽粉,无论是哪种单体酚,经过红外干燥后,其含量都降低,说明红外干燥处理对单体酚具有一定的破坏作用。而且还可以发现,红外干燥处理对葡萄皮中的单体酚的破坏作用更大。
除此之外,S0-籽粉具有最高的单体酚含量,S7-籽粉的单体酚含量最高,随着存放时间的延长,每种单体酚的含量都显著降低(p≤0.05),S7-籽粉的单体酚含量(没食子酸、儿茶素、绿原酸、表儿茶素、阿魏酸和香豆酸)相比S0-籽粉损失达2/3以上,其余两种单体酚(丁香酸和芦丁)的损失也在1/2以上。这可能是由于贮存过程中微生物的生长分解利用了单体酚造成的。从2.1的分析结果可以看出,霉菌和细菌的含量均随着贮存时间明显升高,微生物在生长过程中可以将多酚作为碳源生长,谢美华等人[12]即发现普洱茶发酵微生物(富含酵母菌和霉菌)均可以利用茶多酚作为唯一碳源生长;此外,单体酚含量的降解还可能是由于多酚氧化酶的作用,多酚氧化酶在真菌中广泛存在,能够使多酚转化成相应的醌类化合物[13]。
2.3真菌毒素含量
对不同处理的葡萄皮和葡萄籽超微粉的展青霉毒素和赭曲霉毒素的含量进行了测定,结果见表2。
从展青霉毒素的含量分析,葡萄皮超微粉的毒素含量最高,明显高于葡萄籽超微粉(p≤0.05)。S1-皮粉与H1-皮粉的展青霉毒素含量没有明显差异(p≤0.05),说明红外干燥处理不会对毒素含量造成影响。从表2中还可以看出,葡萄皮渣存放0、1和3d后制得的葡萄籽超微粉没有检测出展青霉毒素,存放5d和7d后的葡萄籽超微粉含有少量的展青霉毒素。
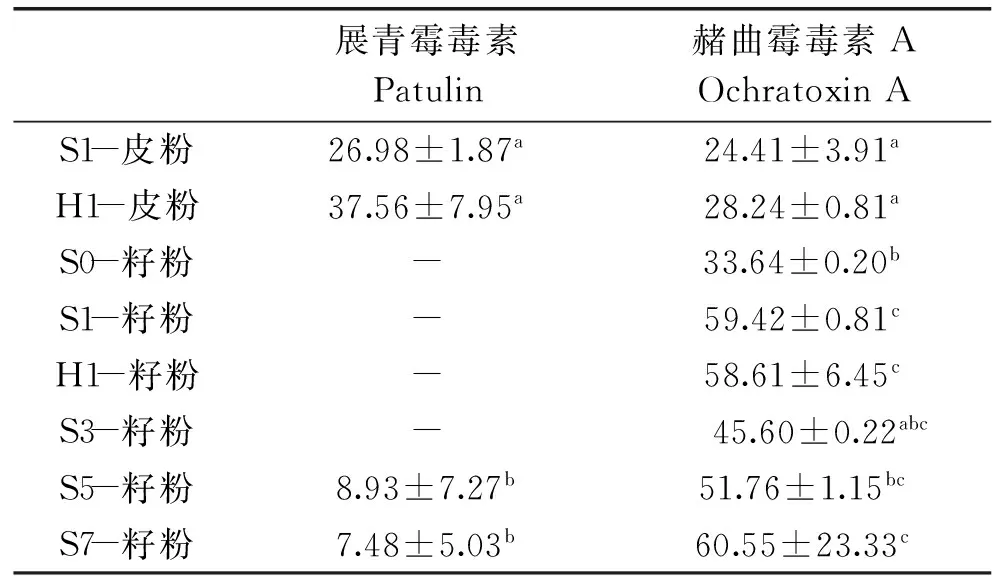
表2 葡萄皮和葡萄籽超微粉真菌毒素含量(μg/kg DW)Table 2 Fungaltoxin content of wine grape skin and seed ultramicro-pulverised powder(μg/kg DW)
注:同列中不同字母表示差异显著(p≤0.05);“-”表示未检测出。
对于赭曲霉毒素A,与展青霉毒素相反,葡萄皮超微粉的赭曲霉毒素A含量最低。随着存放时间的延长,葡萄籽超微粉的赭曲霉毒素A含量有升高的趋势,其中S0-籽粉的毒素含量最低,其余葡萄籽超微粉的赭曲霉毒素A毒素含量无明显差异(p≤0.05)。相比展青霉毒素,赭曲霉毒素A含量的变化规律不是非常明显,这可能是由于实验样品的测定过程中没有对赭曲霉毒素A提取物进行纯化(免疫亲和柱净化),使得在HPLC检测中有杂质峰干扰,影响了测定结果。
根据GB2761-2011对食品中真菌毒素限量的规定,由酿酒葡萄皮渣制成的葡萄皮和葡萄籽超微粉的展青霉毒素在限量范围之内(50μg/kg),而赭曲霉毒素A的含量已经超过规定范围(5μg/kg)。
3 结论
酿酒葡萄皮渣在未进行干燥处理的情况下,由于微生物的活动,随着贮存时间的延长,微生物及真菌毒素含量均明显升高而各单体酚含量明显降低,说明在酿酒过程中得到的葡萄皮渣应立即进行干燥处理,避免其利用价值降低。虽然葡萄皮、籽超微粉经过红外干燥处理后会损失一定的酚类物质,但是其微生物含量明显下降,灭菌效果明显,对真菌毒素的含量没有显著影响。整体来看,红外干燥可以用来对酿酒葡萄皮渣进行干燥处理。
[1]Hoye C Jr,Ross C F. Total phenolic content,consumer acceptance,and instrumental analysis of bread made with grape seed flour[J]. Journal of Food Science,2011,76(7):428-436.
[2]Deng Q,Penner M H,Zhao Y Y. Chemical composition of dietary fiber and polyphenols of five different varieties of wine grape pomace skins[J]. Food Research International,2011,44(9):2712-2720.
[3]Cazzola R.,Cestaro B. Red wine polyphenols protect n-3 more than n-6 polyunsaturated fatty acid from lipid peroxidation[J]. Food Research International,2011,44(9):3065-3071.
[4]Amarnath K,Kumar J,Reddy T,etal. Synthesis and characterization of chitosan and grape polyphenols stabilized palladium nanoparticles and their antibacterial activity[J]. Colloids and Surfaces. B,Biointerfaces,2012,92:254-261.
[5]Lizarraga D,Vinardell M P,Noe V,etal. A lyophilized red grape pomace containing proanthocyanidin-rich dietary fiber induces genetic and metabolic alterations in colon mucosa of female C57BL/6J mice[J]. Journal of Nutrition,2012,142(2):1597-1604.
[6]Guler A,Sahin M. A,Yucel O,etal. Proanthocyanidin prevents myocardial ischemic injury in adult rats[J]. Medical Science Monitor,2011,17(11):326-331.
[7]Gabel M M,Pan Z,Amaratunga K S P,etal. Catalytic infrared dehydration of onions[J]. Journal of Food Science,2006,71(9):351-357.
[8]Yang J,Bingol G,Pan Z,etal. Infrared heating for dry-roasting and pasteurization of almonds[J]. Journal of Food Engineering,2010,101(3):273-280.
[9]Zhu Y,Pan Z L,McHugh T H,etal. Processing and quality characteristics of apple slices processed under simultaneous infrared dry-blanching and dehydration with intermittent heating[J]. Journal of Food Engineering,2010,97(1):8-16.
[10]范毅强,王华,徐春雅,等. 葡萄皮超微粉碎工艺的研究[J]. 食品工业科技,2008(6):223-225,227.
[11]李华,袁春龙,沈洁. 超微粉碎技术在葡萄籽加工中的应用[J]. 华南理工大学学报:自然科学版,2007,35(4):123-126.
[12]谢美华,陈华红,陈玉红,等. 几种普洱茶发酵微生物对茶多酚代谢的初步研究[J]. 食品科技,2013,38(5):82-85.
[13]赵淑娟,王坤波,傅冬和,等. 微生物多酚氧化酶研究进展[J]. 中国茶叶,2008,30(3):18-20.
Quality variation of wine grape pomace dried by infrared drying or during storage without drying
SUIYin-qiang1,ZHENGYa-lei1,YANGJi-hong1,2,LIHua1,2,3,WANGHua1,2,3,*
(1. Northwest Agricultural and Forestry University,Yangling 712100,China;2. Shaanxi Engineering Research Center for Viti-Viniculture,Yangling 712100,China;3. Heyang Experimental and Demonstrational Stations for Grape,Weinan 715300,China)
To study the characteristic of quality variation during wine grape pomace’s storage and the possibility to apply infrared drying to wine grape pomace’s dehydration,the quality of wine grape pomace was evaluated. The pomace were dried by solar drying after being stored for 0,1,3,5 or 7d,for the pomace dried after being stored for 1d,grape seed and grape skin ultramicro-pulverised powder were made,for the other pomace,the grape skin ultramicro-pulverised powder were made;some pomace were dried by infrared drying after being stored for 1d,and the grape skin and grape seed ultramicro-pulverised powder were made. The content of microorganism(yeast,mould and bacteria),8 kinds of phenolic acid and fungaltoxin(patulin and ochratoxin A)of ultramicro-pulverised powder was determined. It was found that with the storage time prolonged,the content of yeast increased at first and decreased in the next,the content of microorganism and fungaltoxin increased and the content of phenolic acid decreased. The ultramicro-pulverised powder which were stored for 1d and dried by infrared drying possessed less microorganism which meant that infrared drying owned a good sterilizing effect;the phenolic acid met with some loss and no influence was found for fungaltoxin. In conclusion,wine grape pomace should be dried immediately after separated from wine making process and infrared drying could be a proper way for their dehydration.
wine grape pomace;infrared drying;sterilization;phenolic acid;fungaltoxin
2013-12-30 *通讯联系人
隋银强(1989-),男,硕士研究生,主要从事葡萄酒副产物加工利用研究。
中国(杨凌)葡萄酒产业技术升级公共平台(2011GH551976);果蔬食品制造关键技术与产业化(2012BAD31B00)。
TS201
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.000

