猪肺管硫酸软骨素的提取分离与抗氧化活性研究
,,
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.西南科技大学食品科学研究所,四川绵阳 621010)
猪肺管硫酸软骨素的提取分离与抗氧化活性研究
熊双丽1,2,李安林1,张晓娟1
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.西南科技大学食品科学研究所,四川绵阳 621010)
首先比较稀碱、全酶和稀碱-酶法结合提取猪肺管硫酸软骨素的工艺,探究猪肺管硫酸软骨素的最大得率,再采用乙醇沉淀、DEAE-Sepharose Fast Flow离子交换柱层析和Sephadex G-75分离纯化得到高纯度硫酸软骨素,然后采用紫外光谱、红外光谱和核磁共振技术对其进行结构鉴定,最后探讨其抗氧化活性。结果发现,全酶法提取硫酸软骨素得率最高,得率为4.86g/100g湿软骨。纯化后,97%纯度的硫酸软骨素得率28g/100g粗品。光谱、核磁共振和抗氧化数据显示,该硫酸软骨素结构与鸡胸软骨和猪喉软骨硫酸软骨素的结构和抗氧化活性相似。因此,猪肺气管软骨可以作为硫酸软骨素的优质大宗提取资源。
猪肺,硫酸软骨素,分离,鉴定,抗氧化活性
肉类加工业是“十二五”时期我国食品工业发展的重点行业。2013年全球猪肉产量将增长270万t,达创纪录的1.074亿t,中国猪肉产量将达创纪录的5380万t。按猪肺占1%的比例计算,仅中国来源猪肺可达54万t。资源比较丰富。目前对猪肺的利用主要作为普通食物和饲料添加剂,也有关于其肝素钠、胶原蛋白、肽、表面活性物质提取利用的研究报道[1-4],但都未涉及猪肺管的利用,造成猪肺管的资源浪费和废弃后的环境污染。利用畜禽加工中副产物(废弃物),研究其综合利用技术,进行资源化利用,属于《国家中长期科学和技术发展规划纲要(2006~2020年)》中重点领域环境内容中的优先主题。在实验室前期研究的基础上发现,猪肺管含有硫酸软骨素。本论文重点研究硫酸软骨素的提取分离工艺和主要抗氧化活性,为猪肺的综合利用奠定良好的理论和应用基础。
1 材料与方法
1.1材料、试剂与仪器
猪肺管 绵阳屠宰场;碱性蛋白酶(≥250μ/mg),木瓜蛋白酶(≥1000μ/mg)和胰蛋白酶(≥250μ/mg)北京博润莱特科技有限公司;DEAE-Sepharose Fast Flow离子交换剂和Sephadex G-75 Phamacia公司;三氯乙酸 皆为分析纯;硫酸软骨素A,葡萄糖醛酸标准品,乙酰氨基葡萄糖标准品、间羟基联苯 Sigma公司;水杨酸、过氧化氢、邻苯三酚等 皆为分析纯;鸡胸软骨和猪喉硫酸软骨素 均为实验室纯化产品,纯度98%。
紫外可见分光光度计(UV-5800) 上海元析仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,SHB-IIS循环水式多用真空泵 郑州长城科工贸有限公司;MODULYOD冷冻真空干燥机 美国Thermo Electron公司;Waters2410型高效液相色谱仪 美国Waters公司;红外光谱仪Nicolet-5700 美国尼高力仪器公司;DPX 400 Bruker核磁共振仪 德国布鲁克公司。
1.2猪肺管硫酸软骨素提取工艺
1.2.1 稀碱工艺 20g软骨粉末→300mL 3%(2%、4%)氢氧化钠,35℃反应11h→2mol/L盐酸调节pH为2.35,搅拌10min,静止2h后离心(4800r/min,15min)→1mol/L氢氧化钠调节pH为6.5,50℃真空旋转浓缩至一定体积后加入3倍体积的无水乙醇进行沉淀过夜(4℃)→离心收集沉淀,55℃干燥后分别得样品1(3%氢氧化钠)、样品2(2%氢氧化钠)和和样品3(4%氢氧化钠)。
1.2.2 全酶酶解工艺 20g软骨粉末→300mL去离子水,用1mol/L盐酸调节pH为8.80,加入0.05g碱性蛋白酶和0.05g胰蛋白酶,50℃反应4h→调节pH为6.5,加入0.03g木瓜蛋白酶,继续反应4h,→1mol/L盐酸调节pH为2.35,搅拌10min,静止2h后离心(4800r/min,15min)→1mol/L氢氧化钠调节pH为6.5,50℃真空旋转浓缩至一定体积后加入3倍体积的无水乙醇进行沉淀过夜(4℃)→离心收集沉淀,55℃干燥得样品4。考虑到酶添加量的影响,在此基础上,加大酶量(0.06g碱性蛋白酶和0.06g胰蛋白酶,0.06g木瓜蛋白酶),减少酶量(0.03g碱性蛋白酶和0.03g胰蛋白酶,0.02g木瓜蛋白酶)进行全酶酶解实验,分别得到样品5和样品6。
1.2.3 稀碱-酶解工艺 20g软骨粉末→300mL 3%氢氧化钠,35℃反应4h→2mol/L盐酸调节pH为9.45,加入0.05g碱性蛋白酶和0.05g胰蛋白酶,50℃反应4h→1mol/L盐酸调节pH为2.35,搅拌10min,静止2h后离心(4800r/min,15min)→1mol/L氢氧化钠调节pH为6.5,50℃真空旋转浓缩至一定体积后加入3倍体积的无水乙醇进行沉淀过夜(4℃)→离心收集沉淀,55℃干燥得样品7。
猪肺硫酸软骨素得率(%)=硫酸软骨素产品质量/20×100
1.3猪肺管硫酸软骨素的分离纯化
按照最佳提取工艺,得到干燥后的硫酸软骨素粗品,然后采用DEAE-sepharose Fast Flow离子交换柱层析[5]和Sephadex G-75[5]进行分级分离和精细纯化,得到高纯度硫酸软骨素。
1.4硫酸软骨素的主要成分分析
硫酸根含量、己糖醛酸、氨基己糖分析参照文献[5]的方法进行。
1.5硫酸软骨素的紫外和红外光谱分析[5]
取纯化后的多糖,配制成0.5mg/mL的溶液,于200~400nm范围内进行扫描。取1mg左右的多糖样品,与溴化钾研磨均匀,压片,于400~4000cm-1范围内进行扫描。
1.6硫酸软骨素的核磁共振分析
[6]进行。
1.7硫酸软骨素的羟基自由基清除活性和超氧阴离子自由基清除活性
羟基自由基清除活性采用Fenton-水杨酸体系,并计算半数抑制浓度(自由基清除率为50%时样品的浓度)[7-9]。超氧阴离子自由基清除活性采用邻苯三酚法,并以浓度为横坐标,抑制率为纵坐标,通过Origin 7.5求回归方程,计算半数抑制浓度。
1.8统计分析
所有数据均为3次平均值,采用SPSS v19.0软件单因素ANOVA进行方差分析,LSD多重比较。
2 结果与分析
2.1猪肺管硫酸软骨素的提取工艺分析
从表1中可以看出,酶解工艺提取硫酸软骨素得率最高,稀碱工艺最低,稀碱酶解工艺居中。酶解工艺和稀碱-酶解工艺提取硫酸软骨素得率都极显著高于碱法(p<0.01)。硫酸软骨素得率随稀碱浓度的增加而显著升高,但超过4%以后,得率不再增加,己糖醛酸和还原糖含量不随碱浓度升高而显著变化。考虑到碱浓度增加以后,得率没有显著增加,而产品颜色却显著加深,因此在稀碱酶解工艺中选择碱浓度为3%。酶解工艺结果显示,硫酸软骨素得率随酶浓度增加而显著升高,但是酶浓度升高以后,己糖醛酸含量也显著降低,导致硫酸软骨素含量降低,尤其是木瓜蛋白酶浓度显著增加以后,己糖醛酸和硫酸软骨素含量显著降低。加之酶浓度增加以后,经济成本也显著增加,因此采用4号样品酶浓度进行稀碱酶解工艺提取硫酸软骨素。稀碱酶解工艺中硫酸软骨素得率与低浓度酶解工艺相似,但还原糖含量显著高于全酶解工艺,与稀碱工艺相当,说明稀碱会导致硫酸软骨素分子的降解,影响分子的结构与活性。三种工艺提取的硫酸软骨素蛋白质含量差异不显著。综合考虑,采用全酶解工艺(0.05g碱性蛋白酶和0.05g胰蛋白酶,0.03g木瓜蛋白酶))提取猪肺硫酸软骨素,产品得率为22.10%,己糖醛酸含量为17.40%。
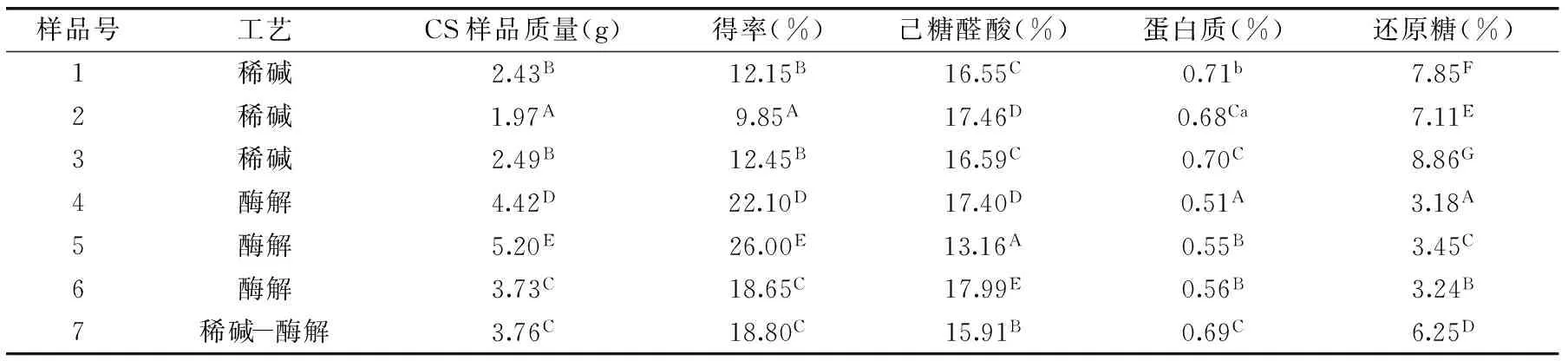
表1 不同工艺提取硫酸软骨素得率及主要成分比较Table 1 Yields and components comparision of chondroitin sulfate by different extracting technology
注:同列不同大写字母的上标数字表示差异极显著(p<0.01),不同小写字母表示差异显著(p<0.05),相同字母表示差异不显著。
2.2硫酸软骨素的色谱分离与纯度分析
硫酸软骨素乙醇沉淀粗品采用DEAE Sepharose Fast Flow 离子交换柱层析分离后得到4种多糖级分(图1),其中采用甲苯胺蓝和己糖醛酸测定,发现D级分为硫酸软骨素,将其采用Sephadex G-75凝胶柱层析精细纯化得到高纯度硫酸软骨素。图2显示,该峰对称性好,纯度97%,得率28g/100g粗品,成分均一,重均分子量为42412Da。化学分析发现该硫酸软骨素葡萄糖醛酸、氨基己糖和总硫酸根含量分别为32.06%、31.75%和11.97%。
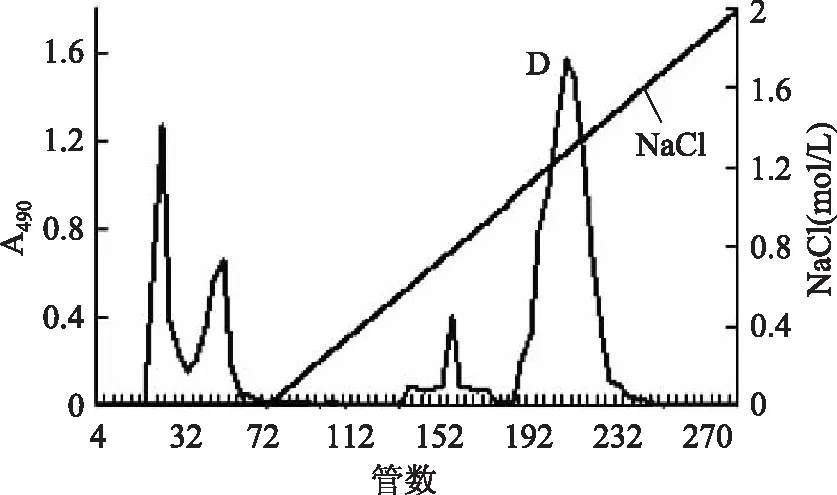
图1 硫酸软骨素的DEAE-Sepharose FF洗脱分离曲线Fig.1 Elution pattern of chondroitin sulfate on DEAE-Sepharose Fast Flow

图2 硫酸软骨素的高效凝胶色谱Fig.2 HPGPC of chondroitin sulfate
2.3硫酸软骨素的紫外和红外光谱
紫外光谱图3显示280nm和260nm处无明显吸收峰,说明无蛋白质和核酸存在。红外光谱图4中看出,1420~1375cm-1处有C-O伸缩振动和O-H变角振动耦合产生的2个吸收峰,说明存在糖醛酸的游离羧基结构。1256.35cm-1处强吸收为S=O伸缩振动。927.61cm-1及8562.71cm-1处的吸收说明猪肺硫酸软骨素为4硫酸化硫酸软骨素[10],与鸡胸、猪喉和牛鼻软骨中硫酸软骨素结构相似。
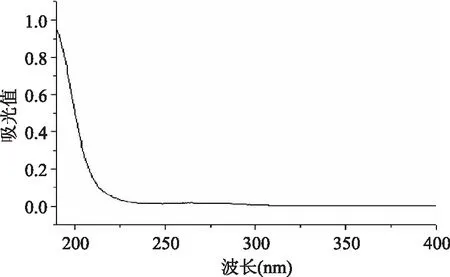
图3 硫酸软骨素的紫外光谱Fig.3 Ultraviolet spectrum of chondroitin sulfate

图4 硫酸软骨素的分红外光谱图Fig.4 IR spectrum of chondroitin sulfate
2.4硫酸软骨素结构的NMR分析
1H-NMR图谱(图5)显示,硫酸软骨素所有质子信号出现在1.96~1.94ppm和3~5ppm区域,与Mucciad等[9]报道的结果一致。13C-NMR图谱进一步显示,δ103.79是4硫酸化软骨素中GlcA的异头碳信号,δ101.99是4硫酸化软骨素中GalNAc的异头碳信号,δ 22.56处的信号峰是乙酰基的甲基碳信号[6,9-10],进一步猪肺管硫酸软骨素为4硫酸化硫酸软骨素,与鸡胸和猪喉软骨硫酸软骨素结构相似。
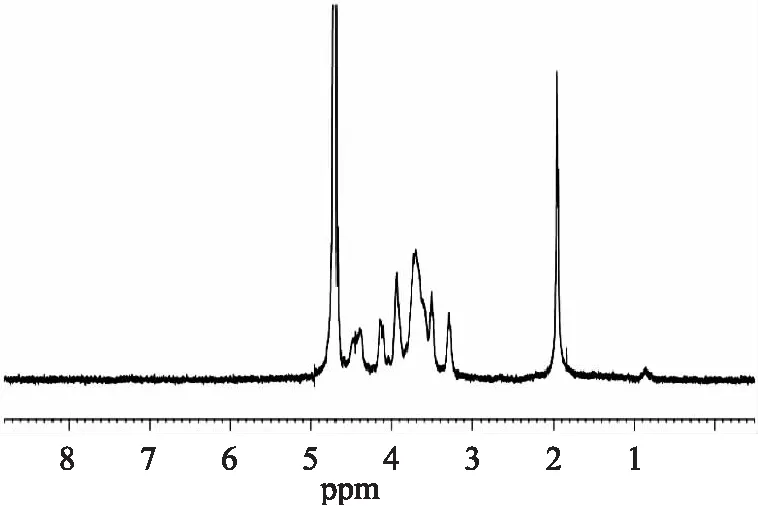
图5 硫酸软骨素的1H-NMR图谱Fig.5 1H NMR spectrum of chondroitin sulfate
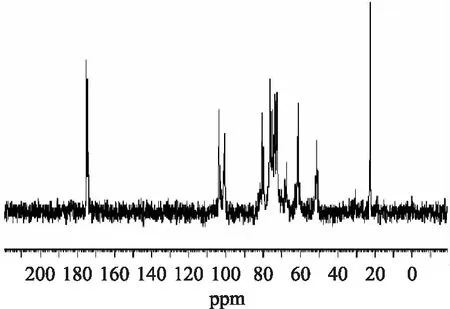
图6 硫酸软骨素的13C-NMR图谱Fig.6 13C-NMR spectrum of chondroitin
2.5猪肺软骨硫酸软骨素的自由基清除活性
生命活动氧化代谢过程中不断产生各种自由基,其中超氧阴离子自由基形成最早,羟基自由基作用最强,两者经常被用于筛选、评价具有清除自由基能力的功能性食品和生化药品。图7显示,猪肺管硫酸软骨素的羟基自由基清除活性和超氧阴离子自由基清除活性都比较高,半数抑制浓度分别为8.77和0.94mg/mL,与鸡胸软骨和猪喉软骨硫酸软骨素差异不显著,它们分别为8.99,1.11,9.07和0.87mg/mL,超氧阴离子自由基清除活性高于羟基自由基清除活性。因此,猪肺管硫酸软骨素也可以作为预防关节炎、调节血脂和预防动脉粥样硬化的商品硫酸软骨素进行深度开发。
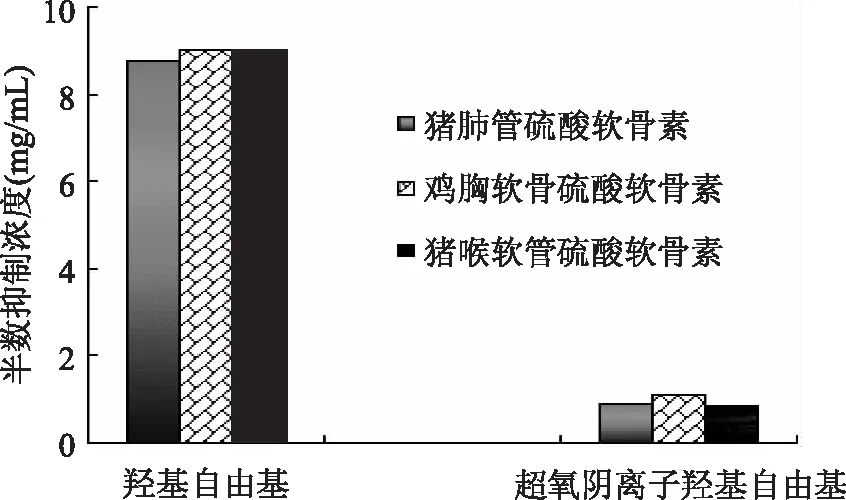
图7 猪肺软骨硫酸软骨素的自由基清除活性Fig.7 Free radical scavenging activity of chondroitin sulfate
3 结论
猪肺管含有丰富的硫酸软骨素,可采用全酶法提取硫酸软骨素,得率为4.86g/100g湿软骨,该粗品
中硫酸软骨素含量为62.68%。DEAE-Sepharose Fast Flow离子交换柱层析和 Sephadex G-75分离纯化可用来对其进行精细纯化,产品纯度达97%以上。该硫酸软骨素的结构和抗氧化活性与鸡胸软骨/猪喉软骨硫酸软骨素一致,可作为硫酸软骨素提取的的重要来源,同时也可以提高猪肺的综合利用效益,延伸农业副产物的产业链,降低环境污染。
参考文献
[1]徐宝成,刘建学,钟先锋,等. 猪肺的加工利用现状及研究展望[J]. 肉类工业,2006,12:26-27.
[2]周霞云,于伟,江国永. 中性蛋白酶酶解猪肺制备蛋白肽的工艺条件研究[J]. 饲料与畜牧:新饲料, 2011,12:54-55.
[3]赵倩,杜江,陈明,等. 超临界CO2萃取猪肺表面活性物质的工艺研究[J]. 中国新药杂志,2004,13(12):1127-1130.
[4]郑川. 猪肺肝素钠提取新技术[J].农村新技术,2000,12:31
[5]熊双丽,罗笑玲,黄妮. 草鱼鱼鳞多糖的提取分离与初步鉴定[J]. 食品工业科技,2012,33(10):253-256.
[6]Lauder RM,Huckerby T N,Nieduszynski I A,etal. Characterisation of oligosaccharides from the chondroitin/dermatan sulphates:1H and 13C NMR studies of oligosaccharides generated by nitrous acid depolymerisation[J]. Carbohydrate Research,2011,346:2222-2227.
[7]Wu G H,Hu T,Li Z Y,etal.Invitroantioxidant activities of the polysaccharides from Pleurotus tuber-regium(Fr.)Sing.[J]. Food Chemistry,2014,148:351-356.
[8]李晓雁,黄海东,李军. 鞘氨醇胶S s 的降解及抗氧化活性的研究[J]. 食品工业科技,2013,34(20):99-101.
[9]Xiong S L,Li A L,Huang N,etal. Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicas[J]. Carbohydrate Polymers,2011,86:1273-1280.
[10]Mucci A,Schendtti N,Volp V.1H and13C nuclear magnetic resonance identification and characterization of components of chondroitin sulfats of various origins[J]. Carbohydrate Polymers,2000,41:37-45.
Purification and antioxidant activity of chondroitin sulfate from pig lung trachea
XIONGShuang-li1,2,LIAn-lin1,ZHANGXiao-juan1
(1. School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China;2. Institute of Food Science,Southwest University of Science and Technology,Mianyang 621010,China)
This article firstly explored yields of chondroitin sulfate from pig lung trachea by comparing low concentration of sodium hydroxide extracting technology,enzymatic hydrolysis technology and low concentration of sodium hydroxide-enzymatic hydrolysis hybrid technology,then isolated and purified it by ethanol precipitation,DEAE-Sepharose Fast Flow anion exchange column chromatograph and Sephadex G-75gel column chromatograph. At last,structure and antioxidant of purified chondroitin sulfate was investigated by ultraviolet spectrum,infra-red spectrum,nuclear magnetic resonance and free radical scavenging activity. The results exhibited that enzymatic hydrolysis technology was the best and the yield of chondroitin sulfate was 4.86g/100g wet trachea. 28g chondroitin sulfate with 97% purify was obtained from 100g crude product. The data of spectral analysis and antioxidant capability of chondroitin sulfate showed that its structure and antioxidant activity was similar to chondroitin sulfate from chicken keel cartilage and pig laryngeal cartilage. Thus,pig lung trachea can be used as good resource of chondroitin sulfate.
Pig lung;chondroitin sulfate;separation;identification;antioxidant activity
2013-01-09
熊双丽(1977-),女,博士,教授,研究方向:碳水化合物与生物技术。
四川省科技厅项目(11ZS2013)。
TS201.1
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001

