5-硝基-2-(3-苯丙胺)苯甲酸对人脑胶质瘤SHG-44细胞增殖的作用及其机制
田 晶,齐 玲,金 宏,陈 雪,王春艳
(1.吉林医药学院生理学教研室,吉林 吉林 132013;2.吉林医药学院病理学教研室,吉林 吉林 132013;3.吉林医药学院实验中心,吉林 吉林 132013)
1 材料与方法
1.1 细胞和主要试剂 人脑胶质瘤SHG-44细胞
(吉林大学第一医院神经外科于洪泉主治医师提供),0.25%胰蛋白酶和小牛血清(美国Gibco公司),NPPB及四甲基偶氮唑(MTT) (美国Sigma公司),二甲基亚砜(DMSO) (美国Thermo公司)。取适量NPPB加入DMSO中,配制成终浓度为0.1mol·L-1的原液备用。
1.2 脑胶质瘤SHG-44细胞的培养 从液氮中取
出冻存的人脑胶质瘤SHG-44细胞,迅速放入37℃水浴箱中复苏,然后将细胞接种于培养瓶中,加入含10%小牛血清的RPMI-1640细胞培养液,将其置入37℃、5%CO2细胞培养箱中培养,隔日换液。
1.3 MTT法检测SHG-44细胞增殖活性 取对数生长期的SHG-44细胞,0.25%胰酶消化后,用含5%小牛血清RPMI-1640细胞培养液重悬细胞,
调整细胞浓度为5×104mL-1。将细胞均匀接种于±s表示,组间比较采用
t检验。
2 结 果
2.1 各组SHG-44细胞的增殖活性 NPPB作用96孔板中,每孔100μL,置入37℃、5%CO2细胞培养箱中进行培养。24h后加入NPPB(终浓度分别为0、50、100和200μmol·L-1),每个浓度设5个复孔,分别作用3、24和48h,每孔再加入MTT 20μL,继续孵育4h,弃上清每孔加入DMSO 150μL,震荡15min,酶联免疫检测仪490nm波长处测定各孔吸光度(A)值,以不加细胞的空白孔调零。
1.4 细胞分析仪检测SHG-44细胞周期 取对数生长期的SHG-44细胞,0.25%胰酶消化后,平均接种于25mm×25mm培养瓶中,每瓶1×106细胞,置入37℃、5%CO2细胞培养箱中培养。24h后加入NPPB(终浓度分别为0、50、100和200μmol·L-1)继续培养24h。消化后用乙醇固定、染色,细胞分析仪检测细胞周期。计算各组细胞的增殖指数,增殖指数=(S+G2)期细胞百分数/(G1+S+G2)期细胞百分数。
1.5 细胞分析仪检测SHG-44细胞凋亡率 取对数生长期的SHG-44细胞,0.25%胰酶消化后,平均接种于4个25mm×25mm培养瓶中,每瓶1×106细胞,置入37℃、5%CO2细胞培养箱中培养。24h后加入NPPB(终浓度分别为0、50、100和200μmol·L-1)继续培养24h。消化后Annexin V/PI染色,细胞分析仪检测各组细胞凋亡率。
1.6 统计学分析 应用SPSS 17.0统计软件进行统计学处理。细胞增殖活性、不同周期细胞所占百分率及细胞凋亡率以3h即可促进细胞增殖,200μmol·L-1NPPB组细胞增殖活性增加,与空白对照组比较差异有统计学意义(P<0.05)。与空白对照组比较,100和200μmol·L-1NPPB组在24和48h时,细胞增殖活性均明显降低(P<0.01)。随着药物浓度增加和作用时间延长,NPPB对细胞增殖的抑制作用加强。见表1。
表1 各组SHG-44细胞增殖活性Tab.1 Proliferation activities of SHG-44cells in various groups (n=5,±s)

表1 各组SHG-44细胞增殖活性Tab.1 Proliferation activities of SHG-44cells in various groups (n=5,±s)
* P<0.05,** P<0.01compared with blank control group.
Group A value(t/h) 3 24 48 Blank control 0.79±0.08 1.50±0.15 1.72±0.38 NPPB(μmol·L-1)50 0.75±0.05 1.46±0.21 1.29±0.12*100 0.90±0.12 0.98±0.04** 0.70±0.04**200 1.09±0.19*0.87±0.13** 0.46±0.06**
2.2 各组SHG-44细胞周期时相变化 细胞分析仪结果显示:空白对照组G1期和S期细胞百分数分别为45.9%和23.1%,增殖指数为52.3%;在50μmol·L-1NPPB组,G1期细胞百分数减少,为40.6%,S期细胞百分数降到19.6%,增殖指数为59.2%;在100μmol·L-1NPPB组,G1期细胞百分数明显增多,为59.2%,而S期细胞百分数 降 到 14.5%,增 殖 指 数 为 40.6%;在200μmol·L-1NPPB 组,G1期细胞百分数为62.0%,S期细胞百分数为15.5%,增殖指数为37.7%。与空白对照组比较,各浓度NPPB组不同周期细胞百分数差异均具有统计学意义(P<0.01)。说明低浓度NPPB促进细胞增殖,高浓度NPPB抑制细胞从G1期过渡到S期,使细胞增殖停滞在G0/G1期。见表2。
2.3 各组SHG-44细胞凋亡率 与空白对照组比较,100和200μmol·L-1NPPB组中细胞早期凋亡数与晚期凋亡数均明显增加,凋亡率分别达到24.64%和 41.85%(P<0.01)。说 明 高 浓 度NPPB能诱导细胞凋亡,并具有浓度依赖性。见图1和表3。
表2 各组SHG44细胞周期时相Tab.2 Cell cycle of SHG-44cells in various groups(n=3,±s,η/%)

表2 各组SHG44细胞周期时相Tab.2 Cell cycle of SHG-44cells in various groups(n=3,±s,η/%)
* P<0.01compared with blank control group.
Group Percentage of SHG-44cells G0/G1 S G2/M Blank control 45.90±1.08 23.10±0.62 29.20±0.59 NPPB(μmol·L-1)50 40.60±1.18* 19.60±0.60* 39.20±1.19*100 59.20±0.36* 14.50±0.12* 26.10±0.26*200 62.00±0.25* 15.50±0.06* 22.50±0.26*
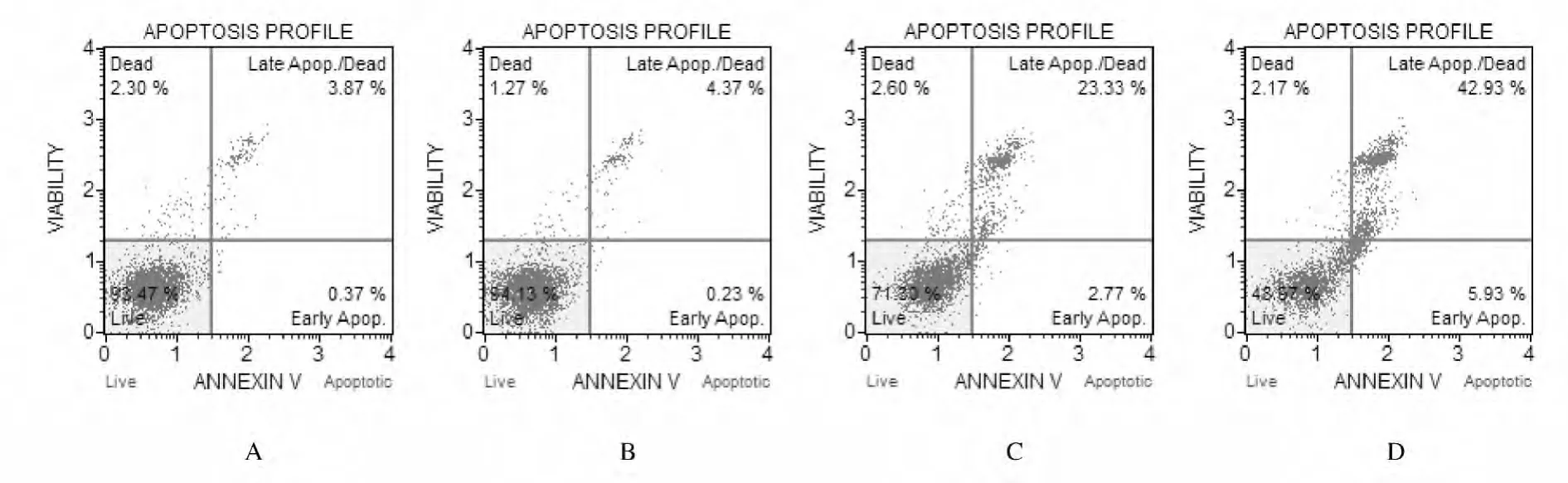
图1 各组SHG-44细胞凋亡率Fig.1 Apoptotic rates of SHG-44cells in various groups
3 讨 论
近年来,在多种细胞及肿瘤细胞普遍存在的容量调节氯通道(volume regulated anion channels,VRAC,ICl,vol)逐渐引起人们的关注。研究[1-5,7-10]表明:VRAC在细胞的容量调节、增殖、凋亡和迁移等功能中均有重要作用。细胞体积增加可以激活VRAC,通过调节性细胞体积减少和调节性细胞体积增加来 维持细 胞体积 的 稳 定[1-3,7-8]。细 胞 增殖是通过细胞周期实现的。G1期是细胞质复制的主要阶段,蛋白质、RNA和多聚核蛋白体都在此期合成,所以细胞容积明显增大。目前发现多种抑制细胞增殖的氯通道阻断剂均使细胞增殖停滞在G1期,这与本研究中100及200μmol·L-1NPPB抑制细胞增殖、使细胞增殖停滞在G1期的结果是一致的,说明VRAC参与细胞周期的进程。He等[8]发现:应用VRAC阻断剂DCPIB可以抑制星形胶质细胞增殖,使细胞周期停滞在G1/S期,并发现这与减少CDK 4和cyclin D1表达、增加p27表达有关,推断是通过影响ERK信号转导途径起作用的。本文作者发现:50μmol·L-1NPPB促进细胞增殖、加速细胞G1/S转换,但低浓度及高浓度NPPB引起的差异原因需进一步研究。VRAC在细胞凋亡中有重要作用。例如,氯通道阻滞剂NPPB阻抑顺铂诱导的鼻咽癌细胞凋亡[3],减 轻 氧 化 应 激 引 起 的 C6 细 胞 损 伤[11],VRAC受损使人肺腺癌细胞对顺铂耐药[12],阻断VRAC可阻止细胞凋亡[4],一些促进凋亡的中药可以激活 VRAC[6,13]等。然而,也有研究[14]发现:阻断VRAC可以促进细胞的凋亡。氯通道阻断剂引起细胞凋亡还是抑制凋亡尚有待进一步研究。
表3 各组SHG-44细胞凋亡率Tab.3 Apoptotic rates of SHG-44cells in various groups (n=3,±s,η/%)

表3 各组SHG-44细胞凋亡率Tab.3 Apoptotic rates of SHG-44cells in various groups (n=3,±s,η/%)
* P<0.05,** P<0.01compared with blank control group.
Necrotic rate Blank control 0.47±0.36 3.70±0.57 4.17±0.90 Group Apoptotic rate Early apoptosis Late apoptosis Total apoptosis 2.16±0.40 NPPB(μmol·L-1)50 0.27±0.19 4.11±0.63 4.38±0.79 1.26±0.02*100 2.57±1.41** 22.07±3.22** 24.64±4.17** 3.23±1.34 200 3.95±1.77** 37.90±7.95** 41.85±9.35**4.74±2.86
目前研究[1,4-5,7]发现:VRAC 参与凋亡可能有2种机制。凋亡性体积减小(apoptotic volume decrease,AVD)已在多种细胞凋亡中观察到,被认为是凋亡过程中具有普遍性意义的标志性事件。有研究[4,7,11-12]发现:K+和 Cl-经钾通道和 VRAC外流是细胞出现AVD的一个重要因素。而AVD是驱动细胞死亡重要因素,给予VRAC阻断剂能够抑制凋亡性容积减少和细胞凋亡。另外,VRAC能够通过转运HCO3-直接降低细胞内pH值,也能够通过易化Cl-/HCO3-交换体分泌HCO3-来间接降低细胞内pH值。细胞内酸化后激活酸性核酸内切酶,进而参与细胞凋亡的过程[15-16]。本研究发现:高浓度NPPB可以抑制细胞增殖并促进细胞凋亡,NPPB是通过阻断VRAC发挥作用的还是另有其他途径诱发细胞凋亡有待进一步研究。肿瘤的发生与细胞增殖和凋亡的平衡失调密切相关,当某一因素促进细胞过度增殖并使凋亡减少时便促使肿瘤发生。本研究发现:高浓度NPPB可以抑制细胞增殖并诱发细胞凋亡,说明NPPB可以作为抗肿瘤新药进行研究和开发。
[1]Jentsch TJ, Valentin S, Frank W,et al. Molecular structure and physiological function of chloride channels[J].Physiol Rev,2002,82(2):503-568.
[2]焦军东,岳 朋,杜智敏,等.氯通道阻滞剂抑制人肾小球系膜细胞增殖 [J].中国药理学通报,2007,23(1):86-90.
[3]范爱辉,陈丽新,毛建文,等.阻断氯通道对鼻咽癌细胞凋亡和细胞增殖的影响 [J].广东医学,2006,27(12):1804-1806.
[4]Okada Y,Shimizu T,Maeno E,et al.Volume-sensitive chloride channels involved in apoptotic volume decrease and cell death[J].J Membr Biol,2006,209(1):21-29.
[5]Hasegawa Y,Shimizu T, Takahashi N,et al. The Apoptotic volume decrease is an upstream event of MAP kinase activation during staurosporine-induced apoptosis in HeLa cells[J].Int J Mol Sci,2012,13(7):9363-9379.
[6]厉冰雪,藤双凤,刘镇锋,等.熊果酸激活低分化鼻咽癌细胞氯通道和减小细胞容积 [J].生理学报,2012,64(6):673-680.
[7]Kurbannazarova RS,Bessonova SV, Okada Y,et al.Swelling-activated anion channels are essential for volume regulation of mouse thymocytes[J].Int J Mol Sci,2011,12(12):9125-9137.
[8]He D,Luo X,Wei WJ,et al.DCPIB,A specific inhibitor of volume-regulated anion channels(VRACs),inhibits astrocyte proliferation and cell cycle progression via G1/S arrest[J].J Mol Neurosci,2012,46(2):249-257.
[9]Ransom CB,O’Neal JT,Sontheimer H.Volume-activated chloride currents contribute to the resting conductance and invasive migration of human glioma cells [J].J Neurosci,2001,21(19):7674-7683.
[10]Cuddapah VA,Sontheimer H.Ion channels and transporters in cancer.2.Ion channels and the control of cancer cell migration[J].Am J Physiol Cell Physiol,2011,301(3):C541-549.
[11]孔晓霞,张宏宇,李 扬,等.NPPB和尼弗灭酸对H2O2损伤C6胶质细胞谷氨酸半胱氨酸合成酶及CLIC4表达的影响 [J].中国病理生理杂志,2008,24(10):1962-1965.
[12]Min XJ,Li H,Hou SC,et al,Dysfunction of volumesensitive chloride channels contributes to cisplatin resistance in human lung adenocarcinoma cells[J].Exp Biol Med,2011,236(4):483-491.
[13]刘善文,李 媛,李华荣,等.小檗碱激活人结肠癌细胞容积敏感的氯通道 [J].生理学报,2011,63(6):517-524.
[14]王 帅,焦保华.他莫昔芬对SHG44人胶质瘤细胞增殖的抑制作用研究 [J].中国应用生理学杂志,2009,25(1):111-113.
[15]Goossens JF, Henichart JP, Dassonnevillel L,et al.Relation between intracellular acidification and camptothecininduced apoptosis in leukemia cells [J].Eur J Pharm Sci,2000,10(2):125-131.
[16]Che XF, Zheng CL, Akiyama S, et al.2-Amimophenoxazine-3-one and 2-amino-4,4α-dihydro-4α,7-dimethyl-3H-phenoxazine-3-one cause cellular apoptosis by reducing higher intracellular pH in cancer cells [J].Proc Jpn Acad Ser B Phys Biol Sci,2011,87(4):199-213.

