不同消化时间下胶原酶对人脐带间充质干细胞分离的影响
协和干细胞基因工程有限公司,天津 300384
不同消化时间下胶原酶对人脐带间充质干细胞分离的影响
郝世凯苏相相洪敬欣
协和干细胞基因工程有限公司,天津 300384
目的比较胶原酶的不同消化时间,观察所获得的间充质干细胞的数量,确定最为理想的消化时间。方法分别采用3h、5h、7h的消化时间分离脐带间充质干细胞;通过传代进行纯化和扩增培养,绘制生长曲线;用流式细胞仪检测其表面标志。结果分离出的间充质干细胞贴壁后为梭形,呈平行排列生长或漩涡状生长,并且消化时间为5h时收获到的细胞数量最多;流式细胞仪检测结果显示,获得的间充质干细胞均表达CD73、CD105、HLA-ABC,不表达CD34、CD45、HLA-DR。结论胶原酶消化法从人脐带中分离培养的细胞具有间充质干细胞的生物学特性,并且消化5h收获得的间充质干细胞数量最多,生长状况最好。
胶原酶;脐带;间充质干细胞;分离;消化时间
Abstract:ObjectiveComparing the quantity of MSCs acquired from umbilical cord that digested by collagenase II in different hours, ascertain an ideal digesting time and culture and appraise the cells acquired.MethodsMSCs were isolated from human umbilical cord through collagenase digestion respectively in 3h, 5h, 7h, then passaged to purify and culture, drew the growth curve.Their surface markers and cells cycle were detected by flow cytometry.ResultsMSCs isolated from umbilical cord adhered with a spindle-shape, they parallel along their longitudinal axis or grew in whirl manner. After 5hours digestion, we got the biggest quantity with best growth status, and successfully built the method for MSCs culture and increasing. Detected by flow cytometry, all of adherent cells express CD73、CD105、HLA-ABC,none of them express CD34、CD45、HLA-DR.ConclusionCells isolated from umbilical cord by digestion have the biological characteristics of MSCs. And 5 hours is the best time for digestion to acquire the most and best MSCs.
Keywords:Collagenase; Umbilical cord; Mesenchymal Stem Cells; Isolate; Digestion time
间充质干细胞(mesenchymal stem cells,MSCs)是一种多潜能干细胞,具有自我更新、高度增殖和多向分化的潜能,在人体生长、发育过程中存在于多种组织中。目前,MSCs主要来源于人骨髓,但成人骨髓中MSCs容易被病毒感染,且强的免疫原性等因素限制了其临床应用[1]。此外骨髓来源的间充质干细胞还存在以下问题:随着年龄的老化,干细胞数目显著降低,增殖分化能力大幅度衰退;制备过程不容易质控;移植给异体可能引起免疫反应;取材时对患者有损伤,患者有骨髓疾病时不能采集,即使是健康供者,亦不能抽取太多的骨髓。这都限制了骨髓间充质干细胞临床应用,使得寻找骨髓以外其他可替代的间充质干细胞来源成为一个重要的问题[2]。
最近,在人的脐带中也发现了间充质干细胞,因其来源丰富、易于获得、不存在伦理问题,有望成为组织工程理想的种子细胞[3]。对UCMSC(脐带干细胞)进行的体内研究结果很令人鼓舞,将其移植到重度肌肉损伤的小鼠模型中,供体细胞的蛋白质表达谱具有骨骼肌分化的特征,并能增强肌肉再生[4]。将UCMSC移植入小鼠缺血的大脑中能改善受体的神经功能,有证据表明供体细胞分化为神经元、神经胶质细胞和血管内皮细胞。这同体外培养时所体现的多潜能相一致,并且移植能促进血管形成和增加缺血损伤部位的血流,该研究表明移植UCMSC可以发挥多种临床功效[5]。
目前,国际干细胞治疗学会提出了鉴定人来源间充质干细胞的3条最低标准[6]:①在标准培养条件下,间充质干细胞具备对塑料底壁的贴附性;②间充质干细胞群体表达CD105、CD73及CD90,而不表达造血细胞标志物CD45和CD34;③经体外诱导,间充质干细胞能向成骨细胞、脂肪细胞及软骨细胞等分化。这仅仅是间充质干细胞的体外鉴定标准,一些研究者一直寻求间充质干细胞的体内鉴定[7]标准。
间充质干细胞在组织中的比例极低,因此,如何获取高纯度的间充质干细胞相当重要。目前最常用的分离间充质干细胞的方法有贴壁培养法、胶原酶法、胰酶-胶原酶法,一些实验研究者通过组织块培养法收获的原代细胞产量比对应的酶消化法要多且成功率高,降低了培养的成本和难度,避免了培养中异种蛋白的混入,进而降低其临床排斥反应[8]。
本研究从足月胎儿脐带中分离出MSCs,通过比较不同消化时间对所收获间充质干细胞的影响,并观察和研究其形态学、生长特性、细胞周期及免疫表型。
1 材料和方法
1.1 主要仪器和试剂 离心机(Beckman Coulter X-15R),75T培养瓶(Corning Incorporated),倒置显微镜(OLYMPUS CKX41),孵箱(Thermo CO2孵箱3111),流式细胞仪(BD FACS Calibur),DMEM/F12、胶原酶Ⅱ、0.25%胰酶(GIBCO),PE标记的CD34、CD45、CD73、CD105、FITC标记的HLA-ABC、HLA-DR(BD Parmingen)。具体见表1。

表1 主要仪器与试剂
1.2 人脐带MSCs的分离、培养及扩增 无菌采集健康胎儿脐带15根,各取15cm随机分为15组,再将每组脐带平均分为3等份,用加有双抗的生理盐水充分清洗,去除脐静脉及动脉内的残留血液,将其剪碎成1mm3的组织块,移至质量体积分数为10%的胶原酶Ⅱ中,37℃分别消化3h、5h、7h,200目滤网过滤,收集含细胞的滤液,4℃、2000r/min离心5min,弃上清,保留沉淀,用DMEM/F12将细胞轻轻吹打成单细胞悬液,充分洗涤,4℃、300r/min离心5min,弃上清,保留细胞沉淀,用体积分数为12%FBS的DMEM/F12重悬,制成单细胞悬液,胎盼蓝计数法计活细胞数后,接种于25T培养瓶中,置于37℃、体积分数5% CO2的饱和湿度孵箱内培养。5~6d后首次全量换液,去除未贴壁细胞,以后每隔3~4d换液1次。倒置显微镜下观察细胞达85%以上融合后,用质量体积分数为0.25%的胰酶消化细胞,倒置显微镜下控制消化时间,按1∶3的比例传代,继续扩增培养。
1.3 细胞生长活性测定 取第三代间充质干细胞,用0.25%胰酶消化后,以2×104/ml,接种于24孔板内,每隔24h消化3个孔,收集细胞,并用台盼蓝计数法计数,绘制生长曲线。
1.4 人脐带MSCs的免疫表型鉴定 取第三代细胞,以0.25%胰酶消化后,用含12%FBS的DMEM/F12终止消化,4℃、250r/min离心5min,去上清,制成2ml悬液,分为每管10μl。阴性对照管分别加入IgG-FITC、IgG-PE,其他管分别加入CD73-PE、CD105-PE、HLA-ABC-FITC,CD34-PE、CD45-PE、HLA-DR-FITC,室温避光孵育30min,流式细胞仪检测。
1.5 主要观察指标 ①不同消化时间收获人脐带间充质干细胞数量。②人脐带间充质干细胞生物学特性。
1.6 设计、实施、评估者 设计、实施为第一作者,评估为第二作者,均经过系统培训,未使用盲法评估。
2 结果
2.1 不同消化时间胶原酶Ⅱ对人脐带间充质干细胞分离的影响 参考王娟等[9]在人脐带间充质干细胞体外分离、纯化及鉴定中的方法,通过比较脐带的不同消化时间发现,所有标本中消化时间为3h 时,未获得间充质干细胞;消化时长为7h时,仅有少量细胞贴壁,但培养后无细胞融合;消化时长为5h时,倒置显微镜下观察有大量活性细胞存在,且具有较强的增殖能力,见表2。

表2 各组不同消化时间收获细胞数
2.2 人脐带MSCs分离、扩增及形态观察 本实验通过对消化时长为5h的细胞培养观察发现,细胞多于24h内开始贴壁,培养7d后,大部分细胞贴壁,细胞呈梭形、多角形,14d后细胞生长较快,于14~21d即可达到85%融合。传代后细胞生长速度明显加快,4~5d可传代一次,传代后细胞纯度提高,形态为较为均一的梭形,以平行排列生长或旋涡状生长。(图1)
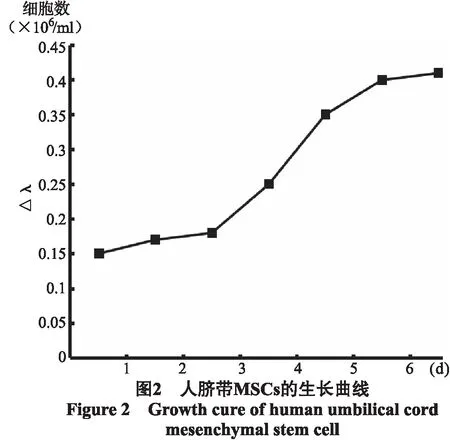
2.3 人脐带MSCs的生长活性测定 取第3代细胞绘制生长曲线,从曲线上可以看出传代后的细胞第1~2d处于滞留期,增殖不明显。第3~5d进入对数生长期,细胞增殖加速,第6~7d进入平台期(图2)。
2.4 人脐带MSCs的免疫表型分析 经流式细胞术检测,通过胶原酶消化法所获得的细胞均表达CD73、CD105、HLA-ABC,不表达CD34、CD45、HLA-DR,由此说明,从脐带分离出来的贴壁细胞即为间充质干细胞(图3)。
3 讨论
脐带内含两条动脉和一条静脉,血管的周围环绕着半透明的基质,称为华通胶。以往资料显示,可从脐带静脉内皮、内皮下层、华通胶以及血管周围组织等分离得到MSCs[10-14]。间充质干细胞(MSCs)具有自我复制、多向分化和免疫调控能力,在组织工程、基因工程和造血干细胞移植领域具有较好的应用前景。
骨髓是目前MSCs的主要来源[15],本实验结果显示脐带来源的MSC与骨髓MSC的形态特点相似,并有更强的增殖能力[16]。此外,研究还发现脐带来源的MSC与骨髓来源的MSC表面抗原表达相近,表明该细胞体系中富含MSC。然而由于其细胞数量和增殖分化能力随年龄增长而显著下降,移植物不便在体外预先定制,异体移植中的伦理争议以及病毒传染等问题也限制了其临床应用[17-18]。
有实验证明在不同的诱导条件下,MSCs不仅可分化为成骨细胞、脂肪细胞、软骨细胞和肌肉细胞等中胚层细胞,而且还可以跨胚层分化为外胚层的神经元、神经胶质细胞及内胚层的肝细胞等[19-23]。MSCs还对造血干细胞具有扩增作用,移植MSCs可以促进造血干细胞的植入[24-25]。
MSCs的分离方法有:①贴壁筛选法:依据MSCs易贴附在塑料培养物上生长的特性将其与非贴壁细胞分离;有学者直接使用贴壁筛选法,但标本中的大量红细胞占据了MSCs所需的贴壁空间,影响MSCs的获得率[26];②酶消化法:用胶原酶对脐带组织进行消化,所获得的细胞进行贴壁培养、扩增;③单细胞克隆的方法[27]分离MSCs:实验条件要求高,所需标本量大。目前已经有学者[28]采用了将密度梯度离心法与贴壁相结合的方式进行分离,并获得了很好的效果。本研究采用胶原酶Ⅱ消化法,通过比较不同的消化时间,从足月胎儿脐带中分离、扩增出MSCs,并发现5h为最佳消化时间。从形态学研究发现,体外培养MSCs,传3~4代后细胞形态均一,贴壁后呈平行排列生长或旋涡状生长。通过研究MSCs生长曲线图发现,贴壁培养3~5d细胞处于对数生长期,细胞增殖速度快。对细胞生长周期研究发现,80%以上的细胞处于G0/G1期,S期占4.3%,G2期占10.2%,这说明大部分细胞处于静止状态,但仍保留自我更新和增殖能力,这符合干细胞的特性。流式细胞仪检测发现,MSCs均表达CD73、CD105和HLA-ABC,不表达CD34、CD45和免疫相关表型HLA-DR,HLA-DR是引起免疫排斥反应的主要因素,说明脐带MSCs可能是免疫原性相对较弱的一类细胞,这和骨髓源的MSCs具有相似的形态和免疫表型[29],与国际定义的MSCs标准相一致[30]。有报道称,骨髓MSCs高表达CD106[31],推测低表达CD106有可能是外周来源MSCs与骨髓来源MSCs的鉴别点之一。

总之,本实验从人脐带中消化分离得到大量的MSCs,且最佳消化时间为5h,体外易于培养扩增,增殖能力强,脐带MSCs病毒感染机会小,对供者和患者无不良影响,因此有望成为组织工程研究的种子细胞和临床应用良好的间充质干细胞来源。
[1]Salamon A,Toldy E.The role of adult bone marrow derived mesenchymal stem cell,growth factors and carriers in the treatment of cartilage and bone defects[J].J Stem Cell,2009,4(1):71-80.
[2]李炳尧,武晓云,吴岩. 间充质干细胞的分离与培养:从实验室到临床[J].中国组织工程研究,2013,17(14):2649-2655.
[3]Fu S,Cheng YC,Lin MY,et a1.Conversion of human umbilical mesenchymal stem cells in Wharton,s jelly to dopa minergic neurons in vitro-potential therapeutic application for Parkinsonism.[J].Stem Cells,2006,24:l15-124.
[4]Laughlin MJ,Barker JN,Bambach B,et al.Hematopoietic engraftment and survival in adult recipients of umbilical-cord blood from unrelated donors.N Engl [J]. Med,2001,344(24):1815-1822.
[5]Rocha V,Cornish J,Sieners EL,et al.Comparison of outcomes of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia[J].Blood,2001,97,(10):2962-2971.
[6]Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy,2006,8(4):315-317.
[7]Da Silva Meirelles L, Caplan AI, Nardi NB. In search of the invivo identity of mesenchymal stem cells[J]. Stem Cells,2008,26(9):2287-2299.
[8]Liu L, Zhao X, Li P,et al. A novel way to isolate MSCs from umbilical cords[J]. Eur J Immunol,2012,42(8):2190-2193.
[9]王娟. 人脐带间充质干细胞体外分离、纯化及鉴定[J]. 暨南大学学报(医学版),2009,30(4):367-372.
[10]Covas DT, Siufi JL, Silva AR, et al. Isolation and culture of Umbilical vein mesenchymal stem cells[J] Braz J Med Biol Res,2003,36: 1179-1183.
[11]Saugaser R, Lickorish D, Baksh D, et al. Human umbilical cord perivascular cells: a sourse of mesenchymal progenitors[J]. Stem Cells,2005, 23(2): 220-229.
[12]Karahuseyinoglu S, Cinar O, Kilic E, et al. Biology of stem cells in human umbilical cord stroma: in situ and in vitro surveys[J]. Stem Cells,2007,25(2):319-331.
[13]陈宇,张宁坤,杨明,等.脐带华通胶间充质干细胞的分离培养及鉴定[J].中国现代医学杂志, 2010,20(16): 2412-2415.
[14]侯克东,卢世璧,张莉,等.人脐带Wharton胶中间充质干细胞的分离、培养与鉴定[J].解放军医学杂志,2008,33(4):375-378.
[15]王恒湘,郭子宽.间充质干细胞在组织再生应用中的诸多问题[J].组织工程与重建外科杂志,2008,4(5):241-245.
[16]Rahul S,David L,Dolores B,et a1.Human umbilical cord perivascular(HUCPV)cells:a source of mesenchymal progenitors[J].Stem Cells,2005,23(2):220-229.
[17]Lavik E,Langer R.Tissue engineering:current state and perspectives[J].Appl Microbiol Biotechnol,2004,65(1):1-8.
[18]蒋洁,谭灿,肖玲,等.脐带沃顿胶间充质干细胞的分离培养及其诱导分化[J]. 中国组织工程研究与临床康复,2010,14(10),1734-1738.
[19]FU Y S,CHENG Y C,LIN M Y,et a1.Conversion of human umbilical cord mesenchymal stem cells in Wharton,s jelly to dopaminergic neurons in vitro:potential therapeutic application for Parkinsonism[J].Stem Cells,2006,24(1):115-124.
[20]Mark L. Weiss,Deryl L. Troyer.Stem cells in the umbilical cord[J].Stem Cell Rev,2006,2(2):155-162.
[21]卢兆桐,李福泉.脐带间充质干细胞分离培养及其定向分化研究[J].中华实验外科杂志,2012,29(8):1630.
[22]哈承志,王大伟. 脐带间充质干细胞在骨组织工程中的应用进展[J]. 中国组织工程研究,2012,16(1):158-162.
[23]扈江伟,张颢,徐曼,等. 脐带全层源间充质干细胞分离培养及向成软骨细胞分化的实验研究[J].创伤外科杂志,2012,14(6):531-534.
[24]Wang HS,Hung SC,Peng ST,et al.Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord[J].Stem Cells,2004,22(7):1330-1337.
[25]SASAKI E,HANAZAWA K,KURITA R,et al.Establishment of novel embryonic stem cell lines derived from the common marmoset (Callithrixjacehus) [J].Stem Cells,2005,23(9):1304.
[26]Erices A,Conget P,Minguell J J.Mesenchymal progenitor cells in human umbilical cord blood[J].Br J Haematol,2000,109(1):235-242.
[27]Mohyeddin Bonab MA,Alimoghaddam K A,Goliaei Z A,et al.Which factors can affect cord blood variables[J].Transfusion,2004,44(5):690-693.
[28]XU Qian,ZHAO Lian-san,WANG Li-chun,et al.Exploration of Isolation and Culture of Human Umibilical Cord Blood Mesenchymal Stem Cells[J].West China Hospital,2005,20(2):285-287.
[29]In,t Ankera P S,Noortb W A,Kruisselbrinkb A B,et al.Nonexpanded Primary Lung and Bone Marrow-derived Mesenchymal Cells Promote the Engraftment of Umbilical Cord Bloodderived CD34+ Cells in NOD/SCID Mice[J].Experimental Hematology,2003,31:881-889.
[30]Dominici M,Le Blanc K,Mueller I,et,al.Minimal criteriafor defining multipotent mesenchymal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[31]吕璐璐,宋永平,魏旭东,等.人脐带和骨髓源间充质干细胞生物学特征的对比研究[J].中国实验血液学杂志,2008,16(1):140-146.
TheimpactofdifferentcollagenasedigestiontimeonUCMSCsseparation
HAO Shi-kai,SU Xiang-xiang,HONG Jing-xin
UNION STEMCELL&GENE ENGINEERING CO.LTD,Tianjin 300384,China
R329.2
A
1007-8517(2014)24-0036-05
2014.09.19)

