新型固体电解质Li3PO4-LiAlO2的合成及其电化学性能研究*
祝宝军,陶 颖,王 伟,李玉平,陈石林
(1.湖南大学 材料科学与工程学院,湖南 长沙 410082;2.中南大学 材料科学与工程学院,湖南 长沙 410083)
锂离子电池具有比能量大、工作电压高、放电电位平稳、寿命长等优点,广泛应用于移动电话、数码照相机、笔记本电脑、商务通等便携式电子设备中[1-3].目前传统的液态电解质锂离子二次电池已在商业上取得很大成功,但它存在着漏液、爆炸等安全性隐患,因而锂离子电池固态电解质应运而生.全固态聚合物锂离子二次电池相对于传统的二次锂离子电池在形状设计和安全性方面有了很大的提升,但它并没有真正解决有机电解质存在电化学不稳定性、热分解性、可燃性、电解质泄露等安全问题和有机电解质的化学降解等环境问题[4].无机固态电解质可以从根本上解决有机电解质存在的不足,并且可使锂离子电池应用范围从室温拓宽到高温[5,6].目前无机电解质主要有玻璃态无机电解质材料[7],LISICON[8,9],NASICON[10,11],钙钛矿结构材料[12,13],Li3N及其衍生物等[14].它们存在分解电压低或离子导电率低等不足.因此,探索新的固体电解质体系,研究新工艺改进无机固体电解质的综合性能具有重要的意义.
Li3PO4具有高的稳定性和原材料价格低廉等优势,但是其电导率仅为10-7左右,不适合直接用作固体电解质.通过掺杂可使γ型Li3PO4的离子电导率提高.本研究利用掺杂理论,探索把Al离子掺进Li3PO4中,用部分Al取代P,得到掺杂的Li3PO4固溶体,从而达到提高Li3PO4无机固体电解质离子电导率的目的.
1 实 验
原料为纯Al粉、分析纯水合氢氧化锂LiOH·H2O和分析纯磷酸二氢铵NH4H2PO4.
为了考察LiAlO2∶Li3PO4不同化学计量比对掺杂程度及电导率的影响,实验设计了LiAlO2∶Li3PO4为1∶1和1∶3两种化学计量比的样品,分别用1#和2#表示.
按照一定化学计量比,将适量Al粉加入配好的LiOH溶液中,加热并搅拌至反应完毕.然后加入配好的NH4H2PO4溶液,加热并搅拌,直至氨气释放完毕,蒸干后得到糊状混合物.用真空干燥器对糊状物进行干燥,干燥后的样品用电阻炉在不同温度下进行煅烧,得到最终试样.
采用NETZSCH STA449C热分析仪在Ar气氛中对样品进行DSC-TG分析;采用日本理学株式会社D/Max 2500VB+X射线衍射仪分析样品的相组成.采用荷兰PHILIPS公司生产的场发射扫描电子显微镜(SEM)分析样品的形貌特征.采用上海辰华仪器公司生产的电化学工作站以及CHI660C软件对粉末样品分别进行循环伏安及交流阻抗分析,测量频率范围为1~1×105Hz.
2 实验结果与分析
2.1 样品的DSC-TG 分析
将Li3PO4,LiAlO2摩尔比为1∶1的前驱体真空干燥后进行DSC-TG分析,图1是1#样品的DSC-TG曲线.由图可见,该样品的质量随着温度升高一直在下降,样品总的失重量达21.5%,并有6个吸热峰.该过程大致可分为4个阶段.第一阶段是从室温到450℃,失重约19.7%,伴随吸热,此阶段的失重与吸热反应是由于吸附水、结晶水蒸发及残余的一水合铵分解引起的;第二阶段是600~750 ℃,此阶段的失重不明显,有一个吸热峰,对应着α-LiAlO2向β-LiAlO2的转变;第三阶段是800~1 200 ℃,此阶段几乎没有失重发生,但有吸热反应,对应着β-LiAlO2向γ-LiAlO2晶型的转变.LiAlO2发生晶型转变的过程为:
γ-LiAlO2
ΔH=10 kJ/mol,第四阶段是1 220~1 400 ℃,几乎无失重发生,有吸热反应,但对应的峰的面积很小,是样品少量挥发造成.整个过程发生总反应为:

2.2 煅烧温度对物相的影响
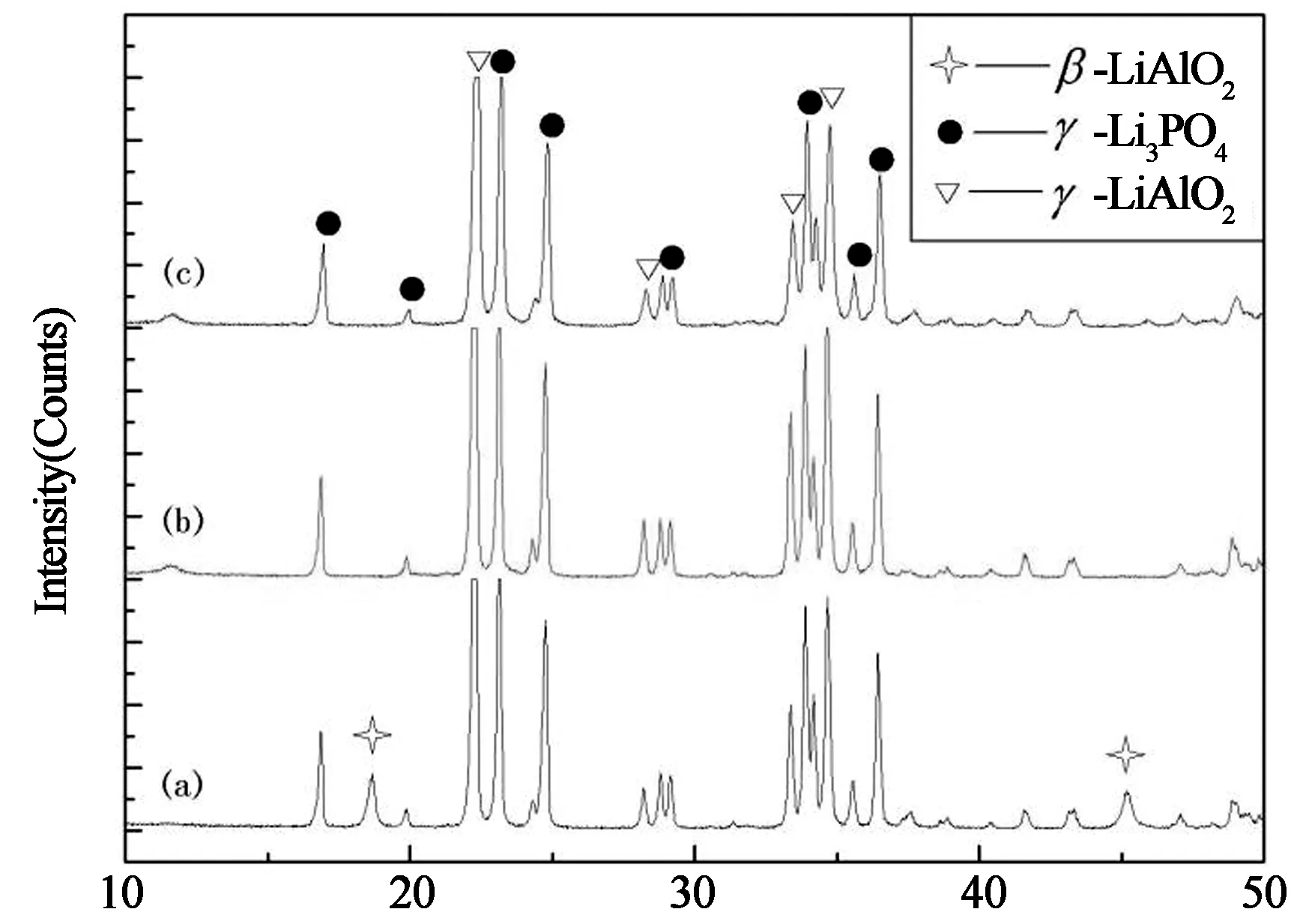
不同温度下煅烧1#样品,煅烧产物XRD图谱如图2所示.由图可见,800 ℃煅烧时,产物中存在β-LiAlO2,γ-LiAlO2和γ-Li3PO4三个相;煅烧温度为1 000 ℃和1 100 ℃时,样品中只有γ-LiAlO2和γ-Li3PO4两相.说明在800 ℃至1 000 ℃的升温和保温过程中,β-LiAlO2全部转化成γ-LiAlO2.1 000 ℃和1 100 ℃煅烧样品的相组成相同,其XRD图谱上没有杂质峰出现,说明煅烧温度为1 000 ℃和1 100 ℃时,γ-LiAlO2和γ-Li3PO4没有发生分解.XRD分析结果与DSC-TG分析结果基本一致.

图1 1#样品的DSC-TG分析曲线
2-Theta
图3是1 000 ℃煅烧1#和2#样品的XRD图,由图可见,γ-LiAlO2对应的物相峰出现在2θ为22.2,24.3和28.2附近,分别对应着(101),(110)和(111)面;γ-Li3PO4对应的物相峰出现在22.3,23.2,24.8,28.8和29.2附近,分别对应着(120),(101),(021),(121)和(200)面.22.2~22.3附近的峰是两种物质的混合峰.由图3可见,γ-LiAlO2的(110)峰没有出现在P/Al比等于3(2#)样品中,且(111)峰的强度比P/Al等于1的样品低.说明P/Al等于3的样品经过煅烧后,更多的Al元素以固溶原子掺杂进入γ-Li3PO4晶格位置,而不是单独形成LiAlO2晶体.
当P/Al比为3 时(2#样品),γ-Li3PO4各晶面衍射峰向小角度方向偏移,说明γ-Li3PO4晶格参数a,b和c变大.γ-Li3PO4是由LiO4和PO4四面体组成的,其中P在PO4四面体中的配位半径为17 pm,而Al在AlO4四面体中的配位半径为39 pm[15].因此当Al部分取代PO4四面体中的P形成固溶体时,会使γ-Li3PO4晶格参数增大,表现在XRD图谱中为衍射峰位置左移.由以上分析可说明当P/Al为1时,煅烧产物由LiAlO2和Li3PO4两相混合物组成;当P/Al等于3时,煅烧产物主要由掺杂Al元素的Li3PO4固溶体和极少量γ-LiAlO2组成.

2θ
2.3 形貌分析
图4是1#和2#样品在1 000 ℃煅烧后的SEM图.由图4(a)可见,1#样品由1 μm左右的球状颗粒和薄片状物质组成.根据前面XRD分析可知煅烧产物中存在着γ-Li3PO4和γ-LiAlO2两相,其中γ-LiAlO2相具有P41212空间群,样品形貌为四方片状,球状相则为γ-Li3PO4[16].片状的γ-LiAlO2的分布不均匀,呈团聚状态.
由图4(b)可见,2#试样片状的γ-LiAlO2很少,只在球状的γ-Li3PO4附近有少量的分布,粒径约为0.5~1 μm.没有团聚现象.SEM分析进一步验证了XRD结果.

图4 样品的SEM图 (a) 1# (b) 2#
2.4 电化学性能分析
交流阻抗分析:图5和图6是不同温度下煅烧1#和2#试样的Bode图.从图中可以得到溶液电阻和极化电阻的对数值,根据公式σ=d/(R·A)便可求出试样的电导率.式中:d为样品厚度;A是样品与电极接触的面积;R是样品的体电阻.实验时采用的铂丝玻璃管电极,A=3.14×10-4cm2,孔深d=1μm;R为样品相角随频率的变化达到最小时所对应的阻抗值,在此测试中,相角均在log(F)=0 Hz附近达到最小,故取log(F)=0时的阻抗值作为R值.1#试样的离子电导率计算过程如下:lgR=3.77,则电阻R=103.77=5 888.44 Ω,则Li+电导率为:
同理,得出不同温度煅烧1#和2#试样的Li+电导率如表1所示.由表1可见,样品的Li+电导率均在10-5S/cm数量级上,比文献[17]报道Li3PO4的离子电导率(10-7数量级)高.其中1 000 ℃煅烧后2#样品的Li+电导率最大,达到6.4×10-5S/cm,说明固溶到Li3PO4中的Al使得Li3PO4的晶格常数变大,扩展了锂离子扩散的通道,从而提高Li3PO4固体电解质锂离子电导率.随着煅烧温度的升高,样品的离子电导率有所下降.这是由于高温煅烧使试样晶粒长大,Li离子扩散距离增加,锂离子导电率降低.

log(Freq/Hz)

log(Freq/Hz)
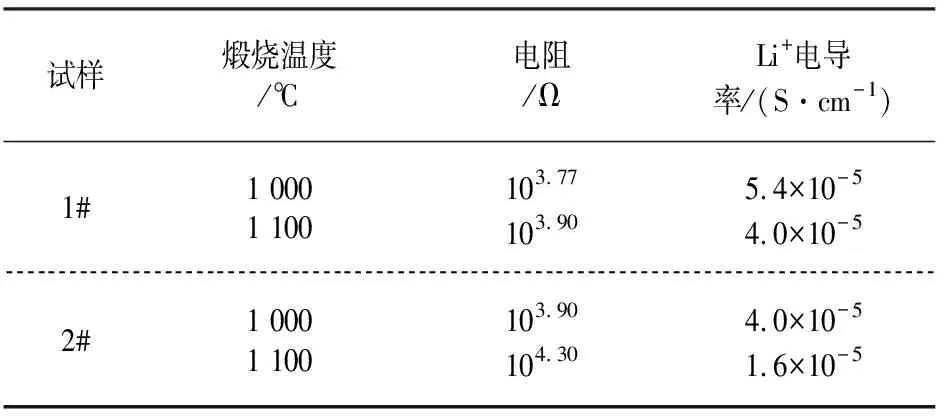
表1 不同温度煅烧1#和2#试样Li+电导率
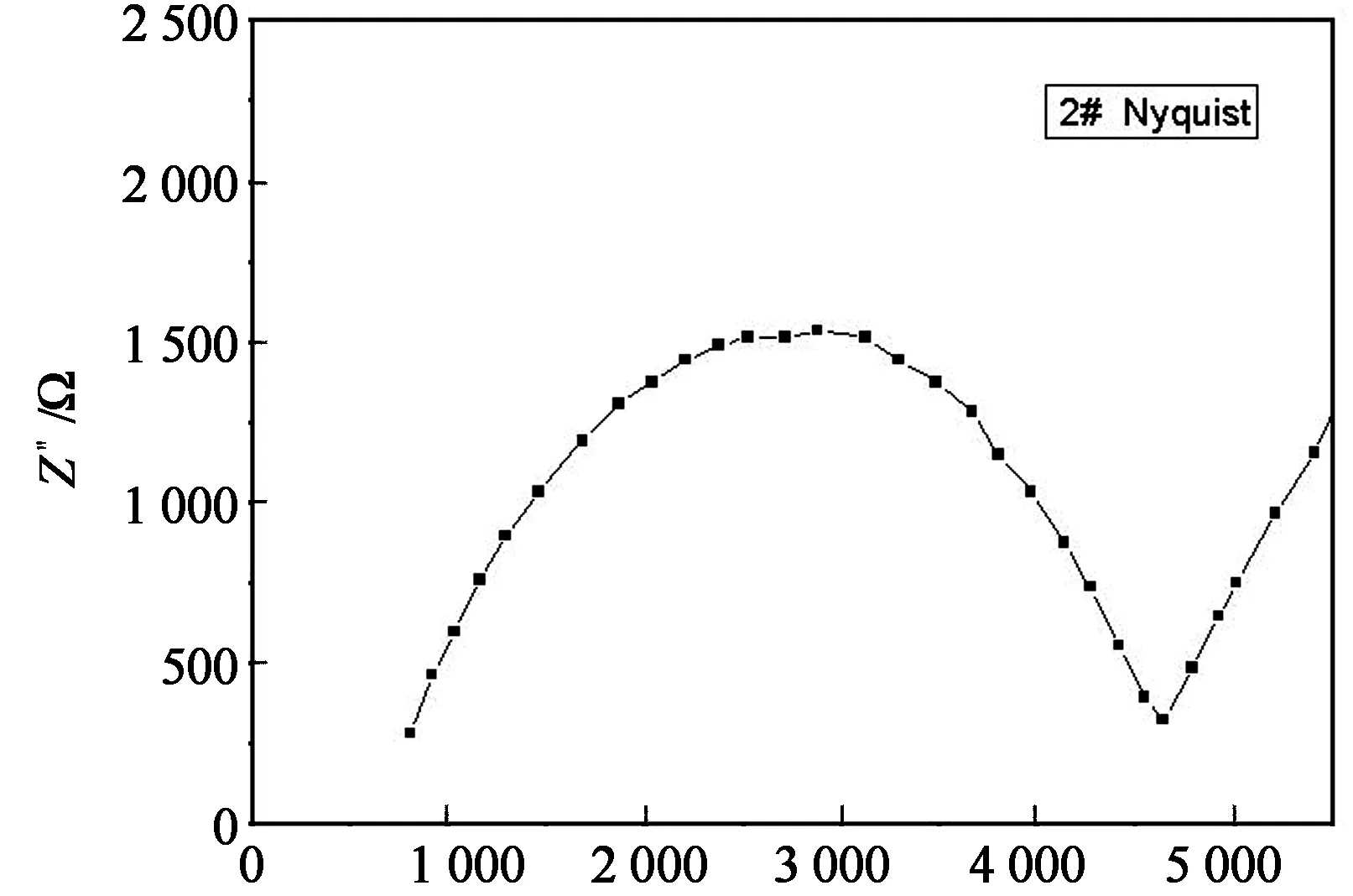
图7是1 000 ℃煅烧2#试样的Nyquist图.由图可见,交流阻抗谱是由一个压扁的半圆和一条斜线组成.其中,高频区的半圆表明电荷传质过程是控制步骤;而低频区实分量和虚分量呈线性相关,表明在此电势下电极过程是扩散控制.
Z′/Ω
循环伏安分析:图8为1 000 ℃煅烧2#试样的循环伏安曲线.由图可见,2#样品的循环伏安曲线的重复性较好,说明样品的循环性能较好,不可逆电容量很小;电流为0以上的曲线对应的是氧化过程,即随着电位变正发生Li+脱附;反之,电流为0以下的曲线对应的是还原过程,随着电位变负发生Li+嵌入.由于氧化区域的面积与还原区域的面积近似相等,所以在此过程中锂离子的脱出与嵌入过程是可逆的.对应的反应为:
Li3PO4(S)=PO4(S)+3Li++3e-
根据Zhao等人对循环伏安曲线的分析方法[18],循环伏安曲线在-0.75至+0.75的范围内没有观测到电解质的分解对应的阴极电流和阳极电流,说明该样品在饱和硝酸锂溶液中的电化学窗口为1.5 V,该材料在1.5 V的电压下是稳定的.

Potential/V
3 结 论
采用固相合成法制备了LiAlO2-Li3PO4新型固体电解质材料.LiAlO2∶Li3PO4为1∶3的试样经1 000 ℃煅烧后Al部分取代PO4四面体中的P形成固溶体,使γ-Li3PO4晶格参数增大,扩展了锂离子扩散的通道,提高了试样的锂离子电导率.说明Al掺杂能有效提高Li3PO4无机固体电解质离子电导率.Al掺杂试样的循环性能较好,不可逆电容量小,其电化学窗口达到1.5 V.
[1] TAO Y,ZHU B J,CHEN Z H.Studies on the morphologies of LiCoO2films prepared by soft solution processing[J].Journal of Crystal Growth,2006,293(2):382-386.
[2]TAO Y,ZHU B J,CHEN Z H.Synthesis mechanisms of lithium cobalt oxide prepared by hydrothermal-electrochemical method[J].Journal of Alloys and Compounds,2007,430 (1/2):222-224.
[3]TAO Y,CHEN Z H,ZHU B J.Synthesis of crystallized LiCo0.2Ni0.8O2films on nickel substrates by soft solution processing [J].Solid State Ionics,2005,176 (1/2):57-59.
[4]祝宝军,陶颖.水热电化学法制备LISICON薄膜热力学分析[J].湖南大学学报:自然科学版,2011,38(3):65-67.
ZHU B J,TAO Y.Thermodynamic analysis of Lisicon films prepared in hydrothermal electrochemical method[J].Journal of Hunan University:Natural Sciences,2011,38(3):65-67.(In Chinese)
[5]KNAUTH P.Inorganic solid Li ion conductors:An overview[J].Solid State Ionics,2009,180 (14/16):911-916.
[6]MINAMI T,HAYASHI A,TATSUMISAGO M.Recent progress of glass and glass-ceramics as solid electrolytes for lithium secondary batteries[J].Solid State Ionics,2006,177 (26/32):2715-2720.
[7]FERGUS J W.Ceramic and polymeric solid electrolytes for lithium-ion batteries[J].Journal of Power Sources,2010,195(15):4554-4569.
[8]KANNO R,HATA T,KAWAMOTO Y K,etal.Synthesis of a new lithium ionic conductor,thio-LISICON-lithium germanium sulfide system[J].Solid State Ionics,2000,130 (1/2):97-104.
[9]TAO Y,CHEN Z H,ZHU B J.Synthesis mechanism of lithium nickel oxide using hydrothermal electrochemical method:Thermodynamic modeling and experimental verification [J].Physica B:Physics of Condensed Matter,2005,362:76-81.
[10]TAO Y,YI D Q,LI J.Electrochemical formation of crystalline Li3VO4/Li4SiO4solid solutions film[J].Solid State Ionics,2008,179(40):2396-2398.
[11]陶颖,祝宝军.水热电化学法制备LiNiO2薄膜[J].粉末冶金材料科学与工程,2006,11(3):164-167.
TAO Y,ZHU B J.Fabrication of LiNiO2film by hydrothermal-electrochemical method[J].Materials Science and Ensnaring of Powder Metallurgy,2006,11(3):164-167.(In Chinese)
[12]BONANOS N,KNIGHT K S,ELLIS B.Perovskite solid electrolytes:Structure,transport properties and fuel cell applications [J].Solid State Ionics,1995,79:161-170.
[13]KAWAI H,KUWANO J.Lithium ion conductivity of A-site deficient Perovskite solid solution La0.67-xLi3xTiO3[J].J Electrochem Soc,1994,141(7):78-79.
[14]AONO H,SUGIMOTO E S,SADAOKA Y S.Ionic conductivity of solid electrolytes based on Lithium Titanium phosphate [J].J Electrochem Soc,1990,137(4):1023-1027.
[15]JOHN A.Dean Lange's handbook of chemistry [M].15th ed.New York:McGraw-Hill,1999.
[16]衣宝廉.燃料电池[M].北京:化学工业出版社,2006.
YI B L.Fuel cell[M].Beijing:Chemical Industry Press,2006.(In Chinese)
[17]YAO J A,DU N A,HOLZWARTH W.Li ion diffusion mechanisms in the crystalline electrolyte γ-Li3PO4[J]. Journal of the Electrochemical Society,2007,154 (11):A999-A1004.
[18]ZHAO S L,QI Z Q.Li-V-Si-O thin film electrolyte for all-solid-state Li-ion battery[J].Journal of Power Sources,2003,122(2):174-180.

