梅花鹿茸可溶性蛋白提取工艺及免疫活性
张梦莹 赵玉娟 李倩竹 沈明浩
(吉林农业大学,长春,130118)
鹿茸为鹿科动物梅花鹿(Cervus nippon Temminck)或马鹿(Cervus elaphus Temminck)的雄鹿未骨化密生茸毛的幼角[1]。作为一种名贵中药材,鹿茸已有2000多年入药历史[2],具有保护心血管系统、增强机体免疫力、抗氧化、强壮中枢神经系统、抗肿瘤、改善高脂血症等多种作用功效。众多试验研究表明,多肽、蛋白质是鹿茸中的主要有效成分,目前在该成分的提取工艺研究方面,多以水[3]、乙醇[4]、醋酸盐缓冲溶液[5]、磷酸盐缓冲溶液[6]和 Tris-HCl缓冲溶液[7]为提取溶剂,偏重酸性及中性环境;提取方式虽已由常见的静置提取[4-5,7-8]、磁力搅拌提取[9-10]发展到超声波辅助提取[11-13]、高压[12]及高压脉冲电场提取[13],但大多仍采用较为简单的静置和搅拌方式。Haines[9]和 Coates 等[10]虽采用了碳酸盐缓冲溶液,但未与超声波技术相结合;张大成[11]虽以碱性缓冲溶液辅助超声波技术提取,但未探讨各因素的影响显著性;且他们均未具体研究提取物的免疫活性。故在此基础上,本研究先将碱性碳酸盐缓冲溶液与超声波技术相结合提取冻干梅花鹿茸中可溶性蛋白,寻找出较优提取工艺参数,再进一步研究该蛋白提取物的非特异性免疫活性,为更加深入全面地开发与利用鹿茸这一宝贵资源提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜梅花鹿鹿茸购于双阳区鹿乡镇双圣养殖场,碳酸钠(AR),碳酸氢钠(AR),牛血清白蛋白组份五(北京鼎国生物技术有限责任公司),磷酸(AR),考马斯亮蓝G-250(中国惠世生化试剂有限公司),D25mm透析带(北京鼎国生物技术有限责任公司),注射用环磷酰胺(通化茂祥制药有限公司),印度墨水(上海Kayon生物科技有限公司),溶菌酶(LZM)测试盒和酸性磷酸酶(ACP)测试盒(南京建成生物工程研究所)。
1.2 仪器与设备
SP-722E型可见分光光度计(上海光谱仪器有限公司);SHIMADZU AUY220电子天平(岛津国际贸易(上海)有限公司);大容量Xiang Yi H-2050R离心机(长沙湘仪离心机仪器有限公司);LGJ-12冷冻干燥机(北京松源华兴科技发展有限公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司);FW100高速万能粉碎机(天津市泰斯特仪器有限公司);FDV原泰奇气引式粉碎机(佑奇有限公司);Delta 320酸度计(梅特勒-托利仪器上海有限公司);WP-UPS-20实验室专用超纯水机(四川沃特尔水处理设备有限公司);WD-2102型自动酶标仪(北京市六一仪器厂)。
1.3 研究方法
1.3.1 鹿茸粉的制备
将-80℃冻存鲜鹿茸于4℃下解冻,锯成薄片,切成小块,4℃预冷蒸馏水冲去血污后冷冻干燥,去毛,粉碎,采用索式提取法[14]脱去冻干鹿茸粉中脂肪,冷冻干燥,-80℃保存。
1.3.2 鹿茸可溶性蛋白的提取
称取 0.5 g 鹿茸粉,精确至 0.0001 g,加入一定体积的4℃预冷浸提溶剂混合均匀,4℃条件下超声波浸提一定时间,4000 r·min-1、4 ℃离心15 min,取上清液,超纯水4℃透析48 h后冷冻干燥,超纯水定容至50 mL,即为鹿茸蛋白提取液,4℃保存以备蛋白质量分数测定。
1.3.3 鹿茸可溶性蛋白得率的测定
参考 Bradford 法[15],分别移取 0.1 g·L-1标准蛋白溶液 0、0.2、0.4、0.6、0.8、1.0 mL,超纯水补足至1.0 mL,加入 5.0 mL Bradford 工作液[16],立即混匀,静置5 min,在595 nm处测定吸光度(A)。以标准蛋白质量为横坐标X,吸光度(A)值为纵坐标(Y),绘制标准曲线,得线性回归方程:Y=5.9429 X+0.0229,R2=0.9948。准确移取0.2 mL鹿茸蛋白提取液,超纯水补足至1.0 mL,按照上述操作测定595 nm处的吸光度值,根据线性回归方程计算鹿茸可溶性蛋白得率,公式如下:M=(x×V0)/(m×V)。式中:M为鹿茸可溶性蛋白得率;x为由线性回归方程所求鹿茸蛋白提取液中蛋白质量;V0为吸光度测定时取用鹿茸蛋白提取液体积;m为鹿茸粉质量;V为鹿茸蛋白提取液总体积。
1.3.4 鹿茸可溶性蛋白提取单因素及正交试验设计
提取时间的选择:固定超声温度为4℃,提取溶剂为 0.05 mol·L-1、pH=10.0 的碳酸盐缓冲溶液,液料比为20∶1,超声功率为250 W,考察超声提取时间为 5、10、15、20、25、30 min 时鹿茸可溶性蛋白得率的变化。
提取功率的选择:固定超声温度为4℃,提取溶剂为 0.05 mol·L-1、pH=10.00 的碳酸盐缓冲溶液,液料比为20∶1,超声时间为5 min,考察超声功率为 100、150、200、250、300 W 时鹿茸可溶性蛋白得率的变化。
液料比的选择:固定超声温度为4℃,提取溶剂为 0.05 mol·L-1、pH=10.00 碳酸盐缓冲溶液,超声功率为250 W,超声时间为5 min,考察液料比为5∶1、10∶1、15 ∶1、20 ∶1、25 ∶1时鹿茸可溶性蛋白得率的变化。
提取溶剂浓度的选择:固定超声温度为4℃,提取溶剂为pH=10.00碳酸盐缓冲溶液,液料比为20∶1,超声功率为250 W,超声时间为5 min,考察缓冲溶液浓度为 0.01、0.02、0.05、0.10、0.20 mol·L-1时鹿茸可溶性蛋白得率的变化。
以鹿茸可溶性蛋白得率为评价指标,在单因素试验基础上进行L9(34)正交试验(表1),每个试验处理重复3次,优化鹿茸可溶性蛋白提取工艺条件。

表1 梅花鹿茸可溶性蛋白提取工艺的正交试验因素与水平
1.3.5 鹿茸蛋白提取物的免疫活性试验
选取健康昆明小鼠40只,每组8只,雌雄各半,随机分为鹿茸蛋白提取物低剂量组(低剂量组)、鹿茸蛋白提取物中剂量组(中剂量组)、鹿茸蛋白提取物高剂量组(高剂量组)、模型对照组和空白对照组。将鹿茸以1.3.4中所得最优工艺连续提取3次后的提取液冻干,制得鹿茸蛋白提取物,溶于生理盐水,分别以 200、400、800 mg·kg-1剂量对低、中、高剂量组小鼠进行灌胃;模型对照组和空白对照组则给予10 mL·kg-1生理盐水;每天1次,连续7 d。灌胃第2天和第3天时以100 mg·kg-1的剂量对除空白对照组之外的各组小鼠腹腔注射环磷酰胺水溶液,致小鼠免疫功能低下。第8天摘眼球取血后,3500 r·min-1离心 10 min,取血清,颈椎脱臼法处死后取肝脏、脾脏。参照汪艳群[17]的方法进行碳廓清试验,测定单核巨噬细胞吞噬指数;按照测试盒说明书操作,测定血清溶菌酶含量、血清酸性磷酸酶和肝组织酸性磷酸酶活力。采用IBM SPSS 20.0统计软件对数据进行统计分析,结果用平均值±标准差表示。
2 结果与分析
2.1 单因素试验
提取时间的选择:超声提取时间为 5、10、15、20、25、30 min时,鹿茸可溶性蛋白得率分别为29.891、30.451、31.051、31.672、31.471、31.227 mg·g-1。可见,在5~20 min内,随着超声提取时间的延长,鹿茸可溶性蛋白得率逐渐增加,继续延长提取时间,蛋白得率开始缓慢下降。这是因为在定量溶剂中,超声破碎过程中蛋白的溶出[18]需要一定时间,当蛋白溶出趋于稳定后,即使再超声处理其质量分数也不再增加,相反由于长时间的超声波剪切作用可能导致部分蛋白变性,溶解性变差[19]因而得率下降。
提取功率的选择:超声提取功率分别为100、150、200、250、300 W 时,鹿茸可溶性蛋白得率分别为 34.282、36.505、36.786、35.271、34.984 mg·g-1。可知,鹿茸可溶性蛋白得率随着超声功率的增大而增加,当超声功率增大至200 W时蛋白得率达到最高,继续增大超声功率,蛋白得率反而呈现下降趋势。这可能是因为一开始超声功率较小,逐渐增大超声功率会增强对物料的破碎程度,使蛋白更容易溶出,但当超声功率增大到一定程度时,过大的破碎力度使已经浸出的部分蛋白结构破坏以至变性[18,20],从而导致蛋白得率下降。
液料比的选择:液料比分别为5∶1、10∶1、15∶1、20∶1、25 ∶1时,鹿茸可溶性蛋白得率分别为 22.398、33.640、33.276、34.603、35.649 mg·g-1。可见,鹿茸可溶性蛋白得率随溶剂用量增加而显著升高,液料比达到10∶1后蛋白得率趋于平稳。因为溶剂用量较少时,整个溶液体系的浓度较高,黏度较大[20],对蛋白的传质过程起到一定阻碍作用;适当增加溶剂用量后,减小了溶液的浓度和黏度,有利于蛋白的溶出;继续加大液料比,蛋白得率增加趋于平缓,说明此时蛋白溶出趋于稳定,在溶剂中的扩散达到平衡状态。
提取溶剂浓度的选择:提取溶剂浓度分别为0.01、0.02、0.05、0.10、0.20 mol·L-1时,鹿茸可溶性蛋白得率分别为 21.006、22.500、23.807、23.548、24.151 mg·g-1。可知,鹿茸可溶性蛋白得率随着提取溶剂浓度的增大呈逐渐增加趋势,当提取溶剂浓度为0.05 mol·L-1时达到一个峰值,继续提高浓度,蛋白得率逐渐趋于平稳。大部分蛋白质均溶于水、稀盐、稀碱或稀酸溶液中,缓冲溶液对蛋白质稳定性好、溶度大,是提取蛋白质的常用溶剂。不同浓度的缓冲溶液离子强度不同,对蛋白质的溶解和吸附能力不同。
2.2 正交试验
按照正交试验设计进行试验,不同组合条件下鹿茸可溶性蛋白得率依次为 33.609、35.169、34.142、35.918、35.441、36.807、35.450、34.587、34.226 mg·g-1。由表2和表3可知,各因素对鹿茸可溶性蛋白得率的影响主次顺序依次为A、D、C、B,其中A和D影响极显著,C和B影响不显著。根据试验结果得到超声法提取鹿茸可溶性蛋白的最优水平组合为A2B2C2D2。由于这一水平组合未在正交试验设计中,故对其进行3次平行验证试验,所得鹿茸可溶性蛋白得率为36.849 mg·g-1,高于正交试验中第6号处理的结果,故最终确定提取溶剂浓度0.05 mol·L-1,液料比10 ∶1,超声提取功率 200 W,超声提取时间20 min为最优工艺条件。
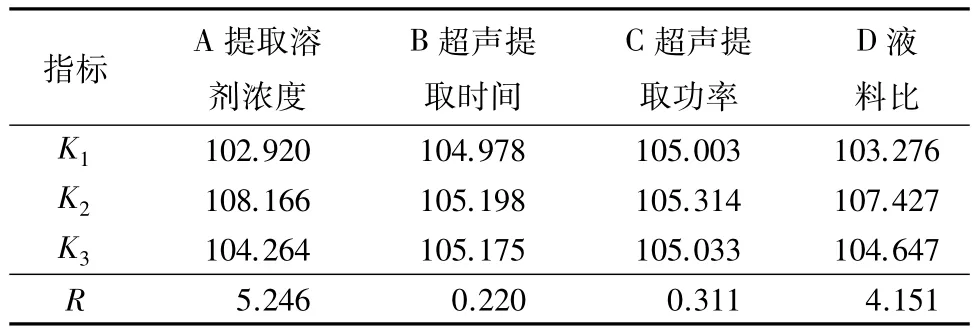
表2 梅花鹿茸可溶性蛋白提取工艺正交试验的直观分析结果 mg·g-1
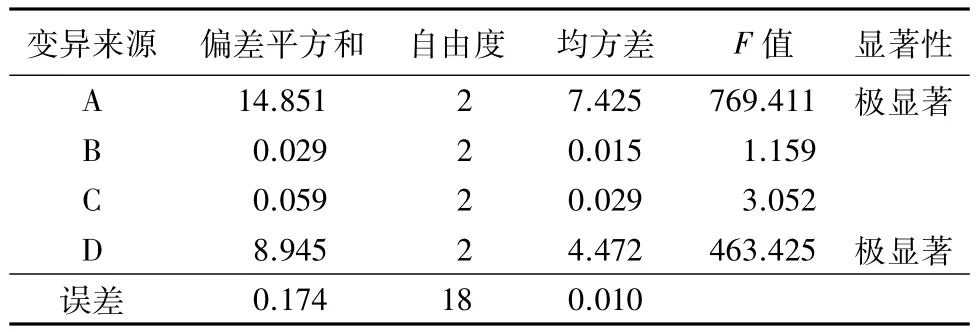
表3 梅花鹿茸可溶性蛋白提取工艺正交试验方差分析结果
2.3 鹿茸蛋白提取物的免疫活性
由表4可知,与模型对照组比较,鹿茸蛋白提取物中、高剂量组的单核巨噬细胞吞噬指数显著增加,低剂量组虽也增加但差异不显著;各剂量组均高于空白对照组,但差异不显著。各剂量组的血清溶菌酶质量浓度均高于模型对照组和空白对照组,除低剂量组与空白对照组差异不显著外,其余均有显著差异。各剂量组的血清酸性磷酸酶和肝组织酸性磷酸酶活力均显著高于模型对照组和空白对照组。据此可知,鹿茸蛋白提取物能够增强小鼠巨噬细胞活性,对其非特异性免疫功能具有积极调节作用,表现出良好的免疫活性。
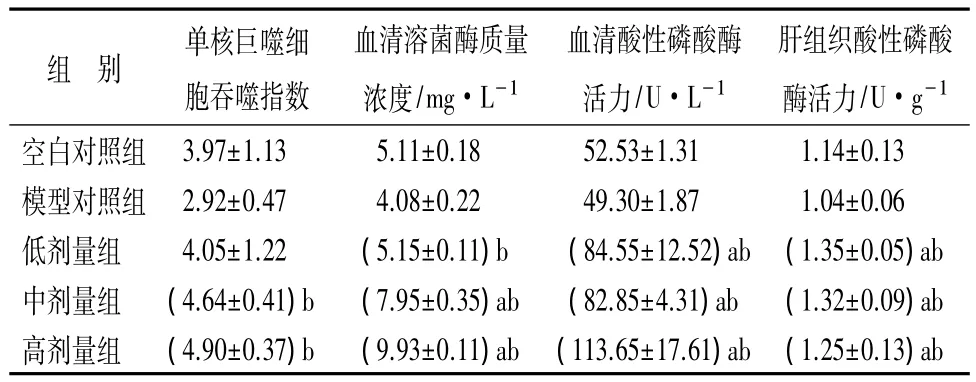
表4 鹿茸蛋白提取物对小鼠非特异性免疫功能的影响
3 结论
采用超声波辅助法提取梅花鹿茸可溶性蛋白,以鹿茸可溶性蛋白得率为评价指标,通过单因素和正交试验结果得知,提取溶剂pH=10.00的碳酸盐缓冲溶液浓度和液料比对鹿茸可溶性蛋白的提取影响极显著,超声提取功率和超声提取时间影响不显著。在pH=10.00的碳酸盐缓冲溶液浓度为0.05 mol·L-1,液料比 10 ∶1,超声提取功率 200 W,超声提取时间20 min的条件下,鹿茸可溶性蛋白得率最高,为 36.849 mg·g-1。通过免疫活性试验发现,鹿茸蛋白提取物能够提高免疫功能低下小鼠的单核巨噬细胞吞噬指数、血清溶菌酶质量浓度、血清及肝组织中酸性磷酸酶活力,积极调节小鼠非特异性免疫功能,具有良好的免疫活性。
[1]国家药典委员会.中华人民共和国药典2010年版:1部[M].北京:中国医药科技出版社,2010:303.
[2]Kawtikwar P S,Bhagwat D A,Sakarkar D M.Deer antlers-traditional use and future perspectives[J].Indian Journal of Traditonal Knowledge,2010,9(2):245-251.
[3]谢云.鹿茸中活性组分的分离纯化与表征[D].福州:福州大学,2006.
[4]岳喜庆,徐明,王澜儒.响应曲面法优化鹿茸蛋白提取条件[J].食品研究与开发,2011,32(9):59-62.
[5]李继海.梅花鹿茸活性成分提取分离、功能评价及功能食品研究[D].北京:中国农业大学,2005.
[6]吴荻,魏征人,陈智嘉,等.吉林省双阳梅花鹿鹿茸蛋白组分的细胞毒性实验研究[J].中国实验诊断学,2012,16(5):795-798.
[7]潘思羽.冻鲜马鹿茸蛋白成分的分离与活性初探[D].北京:北京中医药大学,2010.
[8]赵大玮,李丹,陈智嘉,等.吉林省双阳梅花鹿鹿茸水溶性蛋白组分的提取及对小鼠主要脏器病理形态学的影响[J].吉林大学学报:医学版,2011,37(3):448-451.
[9]Haines S R.Low molecular weight extraction process:US,7547761B2[P].2009-06-16.
[10]Coates D E,Haines S R,Suttie J M.Deer antler extract for promoting angiogenesis:US,2007/0026084A1[P].2007-01-01.
[11]张大成.鹿茸中胰岛素样生长因子-1的提取及纯化研究[D].天津:天津大学,2008.
[12]郭文晶,从福仲,张守勤.鹿茸蛋白的高压提取及生物活性测试[C].武汉:智能信息技术应用学会,2010:459-463.
[13]刘唯佳.鹿茸中水溶性蛋白质的提取及鹿茸综合利用的研究[D].长春:吉林大学,2013.
[14]张水华.食品分析[M].北京:中国轻工业出版社,2009:97.
[15]Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of proteins utilizing the principle of protein binding[J].Analytical Biochemistry,1976,72:248-254.
[16]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:43.
[17]汪艳群.五味子多糖的分离、结构鉴定及免疫活性研究[D].沈阳:沈阳农业大学,2012.
[18]王艳萍,李双喜,程巧玲.超声提取蚕豆蛋白的研究[J].食品研究与开发,2008,29(5):70-72.
[19]袁道强,王丹丹.超声波法提取小麦胚芽蛋白的研究[J].食品研究与开发,2007,28(3):1-4.
[20]胡爱军,田方园,卢秀丽,等.亚麻饼粕蛋白的超声辅助提取工艺研究[J].食品与发酵科技,2013,49(3):30-32,100.

