非小细胞肺癌组织血管内皮生长因子的表达及微血管密度的变化
王 雷 王国范 王秀美 李笑颜 张玉革
(1山东省肿瘤医院,山东 济南 250117;2济南大学山东省医学科学院医学与生命科学学院,山东 济南 250001;3济宁医学院附属医院,山东 济宁 272029)
肿瘤的发生、发展、浸润及转移等过程均与肿瘤血管生成有关,因此目前对肿瘤血管研究越来越引起大家的重视[1]。血管内皮生长因子(vascular endothelial grouth factor,VEGF)表达于血管内皮细胞,研究表明,VEGF是目前肿瘤新生微血管最强的促血管生成因子之一[2],是研究肿瘤的重要受体。微血管密度( microvascular density,MVD)的测定已成为目前评价肿瘤血管生成的金标准。近年来,大家对肿瘤血管生成研究主要集中在肾癌、脑肿瘤、乳腺癌、胃癌等,这些组织中均查到有VEGF高度表达[3]。CD34是广泛存在于血管内皮细胞的一种抗原,是一类不同于Ⅷ因子相关抗原的蛋白质[4]。研究发现,利用CD34进行免疫组化染色来显示并计量血管内皮细胞比Ⅷ因子相关抗原更具有特异性,敏感性也更强[5]。目前,其在非小细胞肺癌(non small cell lung cancer,NSCLC)的研究报道不多[6]。本文观察了NSCLC组织中VEGF和MVD的表达,探讨其在NSCLC发生发展中的作用。
1 资料与方法
1.1 临床资料
收集本院自2010年1月1日至2012年7月30日NSCLC手术标本36例,术后病理证实为NSCLC,且无癌组织坏死。其中鳞癌15例;腺癌17例(普通腺癌14例、细支气管-肺泡癌3例);腺鳞癌4例。排除术前有放疗、化疗及其他抗肿瘤治疗史。对照组17例取自同期接受手术治疗的肺部良性肿瘤患者病变周围5cm 以外正常组织,其中结核球6例,错构瘤3例,肺平滑肌瘤1例,炎性假瘤7例。所有标本由2名病理医师会诊后确诊。
1.2 主要试剂
VEGF 鼠抗人单克隆抗体,鼠抗人CD34单克隆抗体,DAB显色试剂盒(福州迈新生物技术开发有限公司)。
1.3 方法
1.3.1病理学检查 每例标本均分为10~15块组织不等,均经10%福尔马林固定,常规石蜡切片,经过免疫组化染色,普通光学显微镜观察。
1.3.2免疫组化染色 采用免疫组织化学SP法。VEGF和CD34染色判定均以细胞膜及胞浆内出现棕黄色颗粒为阳性。
1.4 判定标准
1.4.1VEGF阳性率的判定 先在低倍视野下(100×)找到观察部位,然后在高倍视野下(400×)每张切片选取5个视野,每个视野下观察1000个细胞,染色阳性细胞数<20%为(-),20%~50%为(+),50%~70%为(++),>70%为(+++)。
1.4.2MVD计数方法 以CD34作为血管内皮标记物,首先在显微镜低倍视野(100×)扫视整张石蜡切片,在每张切片找出3个微血管密集区,然后在高倍视野(400×)下计数,视野面积为0.443mm2。每张切片均计数3个视野,取平均值即为MVD计数[3]。
1.5 统计学方法
采用SPSS 12.0软件包进行统计学分析。
2 结果
2.1 NSCLC组织VEGF的表达及MVD值的变化
见表1。
2.2 不同临床及病理学特征的NSCLC患者VEGF、MVD表达情况比较
结果显示,VEGF的表达阳性率与患者性别、年龄、吸烟之间的差异均无统计学意义(P>0.05);而在不同组织类型及有无淋巴结转移之间,VEGF的阳性分布和MVD计数均有统计学意义(P<0.05),且VEGF在腺癌中表达率最高。不同肿瘤的病理分级及TNM分期中VEGF阳性分布差异有统计学意义(P<0.05);病理分级及TNM 分期越高,VEGF表达分布越多。见表2。

表1 VEGF在肺组织中的表达及MVD变化
注:*采用Fisher概率法
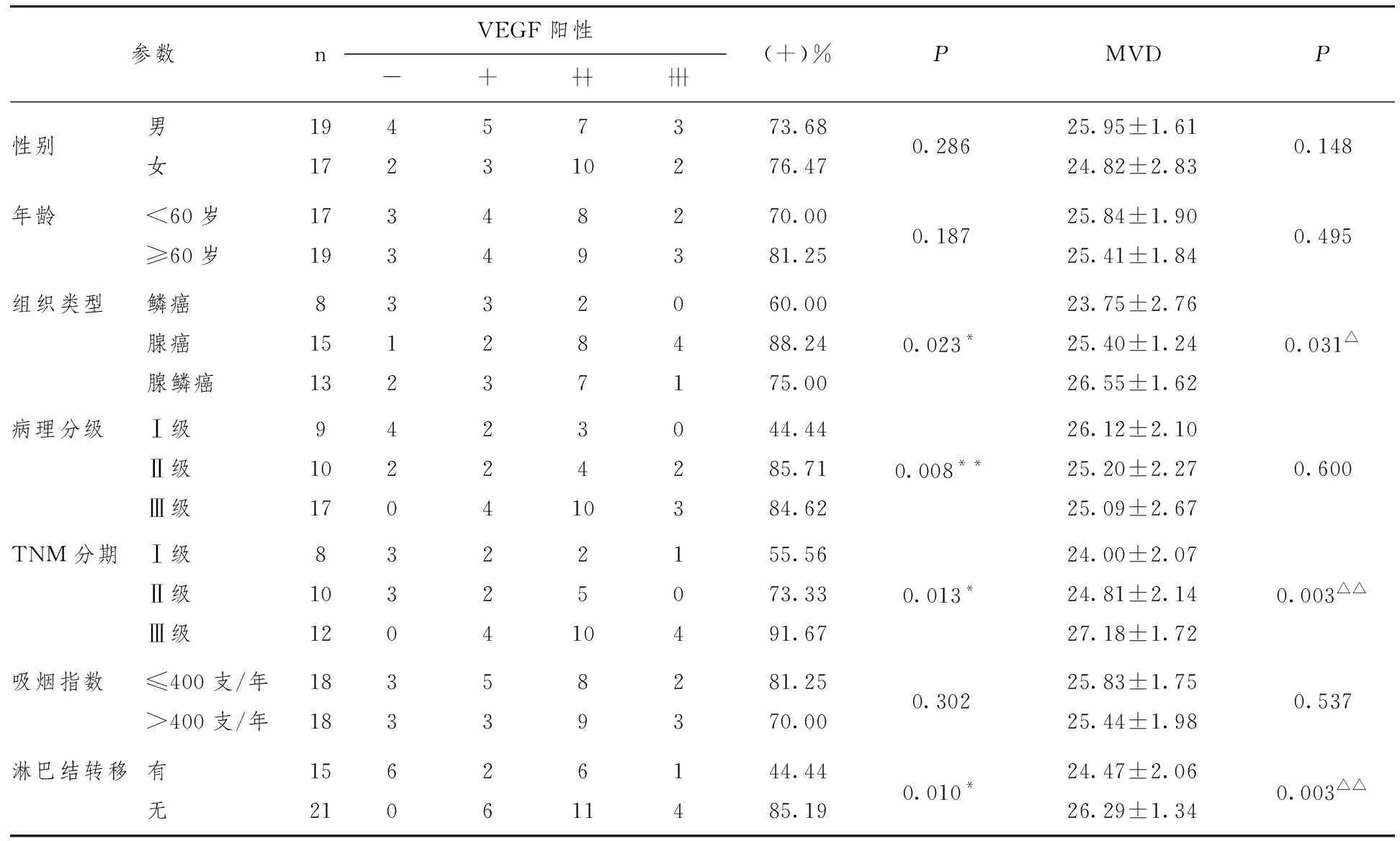
表2 VEGF及MVD表达与临床病理特征关系
注:*P<0.05;**P<0.01;△P<0.05;△△P<0.01。
2.3 VEGF阳性表达与阴性表达组MVD计数的比较
结果显示,36例NSCLC患者中,VEGF阳性者(27例)MVD值明显高于VEGF阴性者(9例),差异有显著性(P<0.01)。表明MVD 与VEGF的表达有一定的关系。见表3。
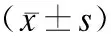
表3 VEGF阳性表达和阴性表达组MVD值的比较
3 讨论
实体肿瘤的生长过程可分为有血管期和无血管期,肿瘤在无血管期获取所需的营养的过程主要靠周围组织的弥散,并通过此途径排泄代谢产物。当肿瘤增长到一定体积时便开始启动血管生成,使肿瘤生长进入血管期;但肿瘤的新生血管并不完整,比正常成熟血管更容易遭受到肿瘤细胞的破坏,而肿瘤细胞可沿着新生的血管开启所谓胶原裂隙发生侵袭[7]。研究发现实体肿瘤的血管生成是普遍存在的特征,血管生成与肿瘤组织的侵袭、转移密切相关,VEGF作为血管内皮细胞标记物之一,目前已成为国内外研究的热点[8]。
VEGF是一种高度特异的血管内皮细胞有丝分裂原,能够与血管内皮细胞上的相应受体结合,促进血管内皮细胞分裂、趋化,从而促进血管生成,但对血管内皮细胞以外的其他细胞无促进分裂作用。VEGF通过增加血管内皮细胞的内囊泡小体功能使血管通透性增加[9],不但可导致间质水肿和癌性胸腹水,并且可使血管内血浆蛋白外渗,而且能够为肿瘤细胞的生长提供良好的基质。由于肿瘤细胞在生长时自身不能产生纤维蛋白原,VEGF引起的肿瘤血管通透性的提高,对肿瘤的新生血管形成就显得尤为重要 ;VEGF还可通过改变内皮细胞基因的活化形式,抑制内皮细胞的调亡[10]。研究发现VEGF及其家族成员在众多生理和病理过程中的新生血管生成中都是必不可少的诱导因子之一,尤其在肿瘤新生血管形成的过程中[11]。人们发现VEGF虽然可以在很多正常组织中表达,但表达水平一般偏低,而在一些血供丰富、代谢旺盛的正常组织VEGF的表达常均高于其他组织。VEGF在多数实体瘤细胞中,无论是mRNA水平还是蛋白质水平均有过量表达[12]。
本文运用VEGF在血管内皮表达的特性,探讨肿瘤新生血管的形成。通过MVD数值的测定,探讨肺癌发生、发展与转移的关系。本文结果显示,VEGF在NSCLC组织中呈高表达,其MVD值也高于正常肺组织(P<0.05)。VEGF表达和MVD 值与肿瘤组织学分化程度有关,在低、中、高分化癌中存在显著差异 (P<0..01或P<0.05);肺癌组织中淋巴结转移阳性组VEGF表达和MVD 值显著高于阴性组(P<0.01 或P<0.05)。因此推测肺癌组织标本中VEGF的MVD计数越多,发生淋巴结转移的机会越多,新生血管增生越活跃,肿瘤生长越快,生存期越短,VEGF可能会成为肺癌患者判断预后的参考指标之一。同时发现VEGF在肺癌不同病理类型和正常肺组织中均有不同程度的表达,VEGF在腺癌中的表达最强,为88.24%;在鳞癌及腺鳞癌中的表达较弱,分别为60.0%、75.0%;在正常肺组织中的表达最弱,阳性率为23.5%。通过比较肺癌组织与正常组织、比较不同的肺癌组织类型、发生淋巴结转移和无淋巴结转移组,说明肺癌肿瘤的生长是一种依赖于新生血管形成的过程,组织局部的VEGF表达水平高时,血管生长越快,组织生长迅速是肺癌生长的特征。关于MVD值与肿瘤远处及淋巴结转移的关系,目前尚无统一定论。本文显示肺癌MVD与淋巴结转移有一定的关系。目前尚没有对MVD定量方法进行标准化,结果的差异除可能与肿瘤本身的异质性有关外,同时也与研究者所选取的血管内皮细胞的标志物及采用的处理、分析方法异同有一定关系。
本文结果提示,VEGF在肿瘤血管发生、发展、浸润和转移中起重要作用,有可能成为肿瘤预后判断的参考指标。抗血管生成治疗策略是针对恶性肿瘤血管生成的关键步骤进行干预治疗,对肿瘤血管生成的阻断有可能抑制肿瘤的生长,故对肿瘤血管生成的深入研究,有望为肺癌的早期诊断和治疗提供帮助。
[1] Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicatorin early-stage hreast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1887.
[2] Gospodarowicz D,Abraham JA,Schilling J.Isolation and charactere-zation of a vascular endothelial cell mitogen p roduced by pituitary derived folliculo stellate cells[J].Proc Natl Acad Sci USA,1989,86(19):7311-7315.
[3] Johnson JP,RothbacherU,SersC.The progression associatedantigenMUC18:A uniquemember of the immunoglobulin super gene fanily[J].Melanoma Res,1993,3(5):337-340.
[4] Beierle EA,Strande LF,Chen MK.VEGF up regulates BCL-exp ression and is associated with decreased apop tosis in neuroblastoma cells[J].Pediatr Surg,2002,37(3):467-471.
[5] Huang CY,Shen ZY.Vascular endothelial growth factor fundamental research and experimental study in p lastic surgery[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2002,16(1):64-69.
[6] Baker EA,Bergin FG,Leaper DJ.Plasminogen activator system vascular endothelial growthfactor and colorectal cancer p rogression[J].Mol Pathol,2000,53(6):307 - 312.
[7] Harris SR,Schoeffuer DJ,Yohiji H,et al.Tumor growth enhancing effects of vascular endothelial growth factor are associated with in-creased nitric oxide synthase activity and inhibition of apoptosis in human breast carcinoma xenografts[J].Cancer Lett,2002,179(1):95-101.
[8] Koul D,Shen R,Garyali A,et al.MMAC / PTEN tumor suppressor gene regulates vascular endothelial growth factor-mediated angiogenesis in prostate cancer[J].Oncol,2002,21(3):469-475.
[9] 韩永,徐燕杰,石炳毅,等.MSI和VEGF在NSCLC组织中的表达及临床病理相关性研究[J].实用诊断与治疗杂志,2007,21(1):8-11.
[10] Agami R,Blandino G,Oren M,et al.Interaction of c-Abl and p73 alpha and their collaboration to induce apoptosis[J].Nature,1999,399(6738):809-813.
[11] Yuan ZM,Shioya H,Ishiko T,et al.P73 is regulated by tyrosine ki-nase c2Abl in the apop totic response to DNA damage[J].Nature,1999,399(6738):814 - 8171.
[12] 徐勇飞,朱婵,渠利利,等.内皮抑素治疗肿瘤的研究进展[J].医学研究生学报,2010,23(4):430-434.

