多层螺旋CT灌注成像下肝癌结节血流动力学的改变
黄大庆 曾 波 牟忠亮 周 石
多层螺旋CT(MSCT,Multi-slice CT)采用多排探测器及锥形X线束,旋转速度增加,扫描时间大大缩短,目前已广泛用于各类临床疾病的辅助诊断[1]。本研究分析98例MSCT灌注成像下肝癌结节血流动力学的改变,现报告如下。
1 资料与方法
1.1 临床资料
选取2008年1月-2013年1月我院收诊的98例肝癌患者。诊断标准[2]:①排除妊娠、生殖腺胚胎源性肿瘤、活动性肝病后,肿瘤指标AFP>400 mg/ml且持续4周以上;②CT检查发现肿瘤直径在1.0 cm以上,B超检查发现肿瘤直径在2 cm以上,放射性核素扫描提示肿瘤直径在3~5 cm以上;③影像学检查发现占位性病变且呈典型的肝癌表现,排除转移性肿瘤及肝血管瘤,肿瘤指标AFP>20 mg/ml,血性腹腔积液且腹腔积液中发现肿瘤细胞。④穿刺活检确诊。纳入标准:符合诊断标准,患者病情较为稳定,可进行MSCT等相关辅助检查。排除标准:①继发性肝脏肿瘤,由其他部位肿瘤转移至肝脏形成;②先天性肝脏血管畸形;③依从性差,无法正常进行MSCT等检查。
在所选取的98例肝癌患者中,男性57例,女性41例,年龄49~83岁,平均(67.57±11.25)岁,病程1~23个月,平均(4.45±1.38)个月,临床表现为不明原因发热、消瘦47例,腹痛、腹胀、纳差73例,肝肿大36例,脾肿大21例,腹腔积液20例。肝癌结节最大为8 cm×8 cm×9 cm,最小为1 cm×1.5 cm×2 cm,单发结节73例,多发结节25例。
1.2 方法
1.2.1 MSCT灌注扫描方案 采用美国GE16排螺旋CT(国食药监械(进)字2010第3300342号),检查前10 min所有患者进行必要的胃肠道准备及屏气训练。取仰卧位腹带固定,先对全肝进行常规平扫,找到肿瘤结节相对较大且包括肝门区的层面。每次扫描范围设定为20 mm厚,分4层。造影剂欧乃派克(300 mg/ml)加热至37℃后由肘正中静脉以5.0 ml/s的速度注射,8 s后嘱患者吸气后屏气,扫描时采用电影模式收集图像,连续扫描50 s,共获取200幅重建图像。扫描时,层距5 mm,矩阵512×512,电压为120 kV,电流80 mA。
1.2.2 MSCT灌注扫描后处理 将重建图片中病变处扫描清晰、涉及到门静脉面积大的挑选出来,传送至Brilliance TM Workspace Release 2.0工作站,应用Perfusion 3肝脏灌注软件进行数据处理,将腹主动脉及门静脉作为输入动静脉,分别选取肝脏结节病灶中心、肝癌结节与正常组织交界处、正常组织三个感兴趣点测量各项灌注参数值(每个点测量3次取平均值),建立时间密度曲线的数学模型后采用卷积云算法计算[3],分别获取肝血流量(hepatic blood flow,HBF),肝动脉灌注指数(hepatic arterial perfusion index,HPI),门静脉灌注量(portal venous perfusion,HPP),肝动脉灌注量(hepatic arterial perfusion,HAP),肝血容量(hepatic blood volume,HBV),峰值到达时间(time to peak,TTP),强化峰值(peak enhancement,PEI)。各个兴趣点的选择要避开钙化或者液化坏死严重的区域,尽量减少对数据准确性的影响。再选取肝癌结节较大(>5 cm×6 cm×6 cm)的26例患者,采集其病灶中心、交界内1 cm、交界处、交界外1 cm及正常组织五个兴趣点处上述参考值。
1.3 观察项目
分别比较正常组织、肝癌结节、交界处的HBF、HPI、HPP、HAP、HBV;比较上述三个兴趣点TTP及PEI;比较大结节患者病灶中心、交界内1 cm、交界处、交界外1 cm及正常组织的HBF、HPI、HPP、HAP、HBV、TTP、PEI。
1.4 统计学分析
2 结果
正常组织、肝癌结节、交界处HBF、HPI、HPP、HAP、HBV值比较,均有明显差异(P<0.05),见表1。
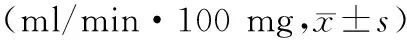
表1 正常组织、肝癌结节、交界处HBF、HPI、HPP、HAP、HBV值比较
正常组织、肝癌结节、交界处TTP及PEI值比较,具有明显差异(P<0.05),见表2。

表2 正常组织、肝癌结节、交界处TTP及PEI值比较
大结节患者病灶中心、交界内1 cm、交界处、交界外1 cm及正常组织的HBF、HPI、HPP、HAP、HBV、TTP、PEI值比较,有显著差异(P<0.05),见表3。
3 讨论
多层螺旋CT采用多排探测器,扫描速度和效率大大增加,图像数量和质量都明显改善。扫描后可任意进行三维重建,帮助医生多方位、系统分析病情[4]。利用造影剂及数学模型,可以对灌注血管血流量进行评估。患者检查过程中需要屏气,可以避免呼吸过程引起的伪影,进一步保证了图像重建的准确性[5]。
正常肝脏血供发达,门静脉占75%左右,肝动脉占25%左右。肝脏发生异常增生的结节或肿瘤性占位时,往往出现血供从以门静脉为主向以肝动脉为主转变,因为当肿瘤结节增大后对门静脉压迫,肝脏灌流量下降后会通过肝动脉代偿[6]。但肝动脉代偿量无法完全弥补门静脉减少量,最终导致肝脏总灌注量的下降。当肝动脉受压血流变化时,肝静脉受内脏静脉调节,不能代偿性增加入肝血量,同样表现为血灌流量的下降。而在肿瘤结节附近,由于癌栓堵塞动静脉血管或组织增生过快[7],容易造成癌灶局部及其与正常组织交界处血液灌流不足,表现为HBF、HPP、HBV、HBV HPI、HAP、TTP、PEI等指标的降低或增高。常规CT及增强CT可发现相关病灶的血流动力学改变,但难以精确验证,而MSCT通过各个兴趣点的定量测量,对相关问题的研究更加科学,更具有说服性[8]。大量研究显示,肝脏边缘的血供情况还可以反应肿瘤浸润程度、生长情况,从而可以判断其良恶性。HAI、HAP、HPP均可描述肿瘤结节附近血流动力学情况,与恶性程度密切相关。部分血流动力学指标显示癌结节与正常肝脏差异不明显,可能是因为血供的代偿机制使肝脏整体处于较为平衡之中[9]。MSCT灌注成像需要改进的地方有很多,时间和空间分辨率不足会错过很多小肝癌的发现及研究。进行三维重建时最好根据个人血管差异采取更符合其实际情况的数学模型分析问题,灌注成像还可以与形态学、功能性影像技术综合运用,更加彻底、全面的评估病灶情况[10]。
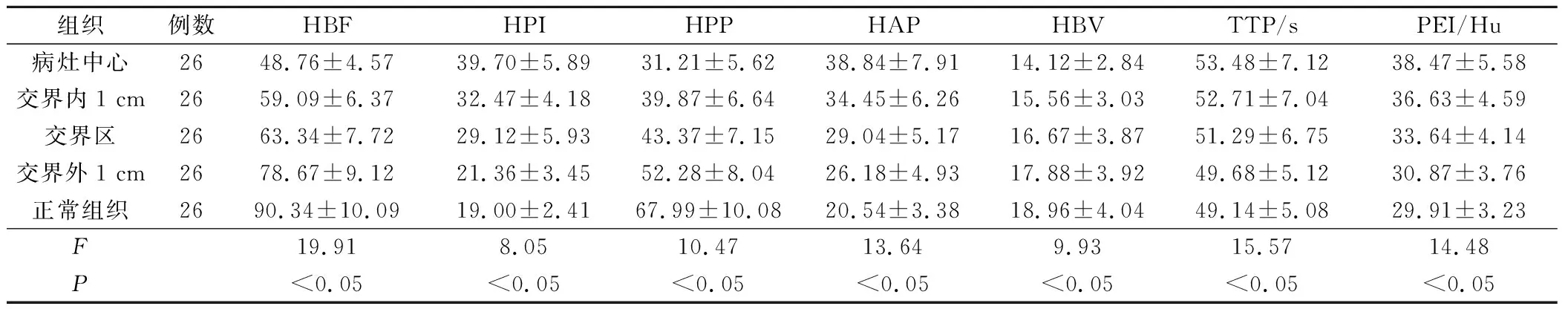
表3 五个兴趣点处HBF、HPI、HPP、HAP、HBV、TTP、PEI值比较(ml/min·100 mg)
本次研究结果中,正常组织、肝癌结节、交界处HBF、HPI、HPP、HAP、HBV具有明显差异;三者TTP及PEI值具有明显差异说明肝癌结节附近血流动力学改变明显。选取结节较大的肿瘤作为测量的兴趣点,病灶中心、交界内1 cm、交界处、交界外1 cm及正常组织的HBF、HPI、HPP、HAP、HBV、TTP、PEI呈现明显差异,说明从肿瘤病灶处向正常组织过渡时,血流动力学发生明显改变,肿瘤的生长及浸润情况可通过交界内1 cm、交界处、交界外1 cm变化情况判断,为手术等治疗方案制定提供科学依据。
综上所述,我们认为MSCT灌注成像可以很好的反应肝癌结节附近血流动力学改变情况,对疾病的诊断与治疗具有积极意义,值得临床推广。
[1] Zhang J,Wang R,Wang M,et al.Experimental Study of Multi-slice Spiral CT Perfusion Imaging in VX_2 Soft-tissue Tumor of Rabbits〔J〕.J Huazhong Univ Sci Technolog Med Sci,2006,26(3):341-343.
[2] Stierstorfer K,Flohr T,Bruder H,et al.Segmented multiple plane reconstruction:a novel approximate reconstruction scheme for multi-slice spiral CT〔J〕.Phys Med Biol,2002,47(15):2571-2581.
[3] 刘 桢,张 涛,苏晓妹,等.肝动脉化疗栓塞联合微波消融治疗大肝癌的临床研究〔J〕.实用癌症杂志,2013,28(1):64-67.
[4] 高军喜,王颖鑫,杨 磊,等.超声造影与增强CT对肝癌射频消融效果的一致性评价〔J〕.中国肿瘤临床,2013,(19):1179-1183.
[5] Miao N,Pingpank JF,Alexander HR,et al.Percutaneous h-epatic perfusion in patients with metastatic liver cancer:anesthetic,hemodynamic,and metabolic considerations〔J〕.Ann Surg Oncol,2008,15(3):815-823.
[6] 洪淑英.三维适形放疗联合肝动脉化疗栓塞治疗原发性肝癌的疗效〔J〕.实用癌症杂志,2011,26(4):411-412.
[7] Hohmann J,Müller C,Oldenburg A,et al.Hepatic transit time analysis using contrast-enhanced ultrasound with BR1:A prospective study comparing patients with liver metastases from colorectal cancer with healthy volunteers〔J〕.Ultrasound Med Biol,2009,35(9):1427-1435.
[8] Hohmann J,Müller C,Oldenburg A,et al.Hepatic transit time analysis using contrast enhanced MRI with Gd-BOPTA:A prospective study comparing patients with liver metastases from colorectal cancer and healthy volunteers〔J〕.J Magn Reson Imaging,2012,36(6):1389-1394.
[9] Fasol U,Frost A,Büchert M,et al.Vascular and pharmacokinetic effects of EndoTAG-1 in patients with advanced cancer and liver metastasis〔J〕.Ann Oncol,2012,23(4):1030-1036.
[10] Koh TS,Thng CH,Hartono S,et al.Deconvolution assessment of splenic and splanchnic contributions to portal venous blood flow in liver cirrhosis〔J〕.Med Phys,2011,38(5):2768-2782.

