用壳聚糖纳米磁性微球纯化血红细胞超氧化物歧化酶
王保全1,平娟1,李峰1,张永州1,刘翠2,庞晓斌3
用壳聚糖纳米磁性微球纯化血红细胞超氧化物歧化酶
王保全,平娟,李峰,张永州,刘翠,庞晓斌
1 河南大学淮河临床学院,河南开封 475001 2 中国科学院生物物理研究所,北京 100101 3 河南大学药学院,河南开封 475001

王保全, 平娟, 李峰, 等. 用壳聚糖纳米磁性微球纯化血红细胞超氧化物歧化酶. 生物工程学报, 2014, 30(6): 990−994.Wang BQ, Ping J, Li F, et al. Purification of superoxide dismutase from blood erythrocyte by nano magnetic chitosan microspheres. Chin J Biotech, 2014, 30(6): 990−994.
本研究旨在用壳聚糖-聚丙烯酸纳米磁性微球纯化血红细胞超氧化物歧化酶。采用了接枝共聚法,以KSO为引发剂,使壳聚糖 (CTS) 与聚丙烯酸 (PAA) 进行自由接枝共聚合成含有两性基团 (-NH3,-COOH) 的壳聚糖-聚丙烯酸纳米微球。化学共沉淀法制备FeO磁流体,以戊二醛为交联剂,制备壳聚糖-聚丙烯酸纳米磁性微球。用傅里叶变换红外光谱仪对磁性微球结构进行检测。JEM-4000EX电镜技术对微球粒径,形貌进行表征。SOD试剂盒测定各步骤Cu-ZnSOD酶活性。结果表明,壳聚糖-聚丙烯酸纳米磁性微球有较好的粒径分布、磁响应性及蛋白吸附特性。纯化后酶比活性达6 727 U/mg,产品得率21.1%,活性回收85.7%。壳聚糖-聚丙烯酸纳米磁性微球经血液纯化血红细胞SOD具有可再生性、易操作性,其纯化效果取决于金属Cu的螯合程度。
聚丙烯酸,纳米磁性微球,超氧化物歧化酶,纯化
壳聚糖是甲壳素脱乙酰化而制得的一种高分子氨基多糖,无毒无味,广泛存在于虾、蟹及贝壳中,是地球上丰富的化合物之一。由于其分子链上具有丰富的羟基和氨基使其极易发生化学反应而具备多种功能,因而广泛应用于生物、医学、药学、食品、化工、环境等领域,但天然壳聚糖具有水不溶性,主侧链难以反应等特点,天然壳聚糖具有水不溶性,从而限制了其应用,随着人们对壳聚糖作为一种生物大分子聚合物和医药缓控释材料等方面的应用越来越感兴趣,对壳聚糖的化学改性也进行了越来越多的研究。特别着重建立壳聚糖主侧链各种优越官能团的成熟分子结构以及壳聚糖的接枝共聚,改性后的壳聚糖作为吸附剂的研究已见大量报道,如Chang等制备了用于去除Cu的壳聚糖结合FeO磁性纳米微粒,Sararikova通过改性壳聚糖粒子一步操作部分纯化了马铃薯块茎中的凝集素。
壳聚糖纳米微球用于酶固定化是指物理吸附或者化学方法将酶固定到特定的载体上,以提高酶操作稳定性和反复利用酶的技术。常用的固定化方法很多:如吸附法、包埋法、共价结合法等,用于固定化酶的高分子载体有活性炭、多糖及多聚酰胺 等,磁性高分子微球是指内部含有磁性的金属或其氧化物 (如铁、钴、镍) 的超细粉末,与非磁性材料相比,磁性高分子微球作为固定化酶的载体研究具有以下优点:有利于酶从反应体系中分离回收,操作简单,对于双酶反应体系,当一种酶失活较快时,可以用磁性材料来固定另一种酶,回收和反复使用,降低生产成本。其次,将固定化酶放入磁场稳定的流动床反应器中,可以减少持续反应体系中的操作,适合大规模化操作。另外可利用外部磁场控制固定化酶的运动方式和方向,替代传统的搅拌方式,提高了固定化酶催化效率。本文以聚丙烯酸和壳聚糖为原料,制备磁性壳聚糖-聚丙烯酸微球,并首次将磁分离技术应用于血液SOD的纯化,达到了很好的纯化效果。
1 材料与方法
1.1 材料
聚丙烯酸 (上海阿拉丁试剂总厂,分子量5 000),聚丙烯酸钠 (PAAS) (北京顺义希涛化学试剂厂,固含量3.45%),壳聚糖 (脱乙酰度>90%),低分子量Maker (华美生物技术公司),SOD测总活性试剂盒 (南京建成生物),JEM-4000EX透射电子显微镜,紫外分光光度仪器 (日本岛津公司),FTS-3000红外光谱仪 (美国戴尔公司),FD-IC-50冷冻干燥机 (北京博益康仪器公司),其他试剂均为分析纯。
1.2 方法
1.2.1 FeO磁流体的制备
采用化学共沉淀法制备FeO磁流体。
1.2.2 聚丙烯酸-壳聚糖的接枝共聚
准确称取0.2 g的壳聚糖粉,以100 mL的1%醋酸溶解,磁力搅拌30 min,使之与20 mL 20%的聚丙烯酸溶液,4 mL的0.1 g/L的过硫酸钾溶液在烧杯中混合均匀,70 ℃条件回流反应45 min去除未反应完全的聚丙烯酸,冷冻干燥得壳聚糖-聚丙烯酸微球。
1.2.3 磁性纳米微球的制备及对Cu的螯合
称取一定量壳聚糖-聚丙烯酸纳米微球粉末,配置成5%的壳聚糖乙酸溶液,加入一定量的冷冻干燥后的FeO纳米粒子,超声分散15 min,缓慢加入由液体石蜡、Span-80、吐温-60、正丁醇等组成的油相液体中,混合均匀,加入一定量的25%的戊二醛为交联剂,交联一定时间,7 000 r/min离心15 min,分别用蒸馏水和丙酮多次洗涤,冷冻干燥即得壳聚糖-聚丙烯酸纳米磁性微球,准确称取0.2 g的壳聚糖-聚丙烯酸磁性微球4等份,分别置于100 mL的锥形瓶中,配制0.01 mol/L Cu离子溶液,按文献[9]方法螯合Cu,并绘制Cu吸附动力学曲线。
1.2.4 血液SOD的初步分离
新鲜血液4 000 r/min离心45 min,取100 mL血球,等体积0.6% Tritonx-100蒸馏水溶血,再加溶血体积20%聚丙烯酸钠溶液,水浴加热到70 ℃时加10%溶血体积的氯化铜(浓度10%) 作为激活剂,恒温10 min,细纱过滤,收集得到浅绿色粗酶液,加上述酶液体积2倍滤液体积预冷–4 ℃丙酮,离心收集沉淀,用pH为7.6的磷酸盐缓冲液溶解沉淀,将上述酶液装入超滤杯中,以分子量为10 000 Da的超滤膜截留,收集膜上酶液即为粗酶液。
1.2.5 蛋白含量和活性测定
按考马斯亮蓝法测蛋白含量,线性回归方程为:= 0.092 5–0.012,= 0.997 3,SOD活性测定按南京建成生物试剂盒说明进行。
2 结果与分析
2.1 纳米亲和微球的磁响应性检测
准确称取0.4 g纳米磁性微球2等份,置于 100 mL烧杯中,制备成混悬液,一份加强磁场,一份在自然重力场中,于480 nm处测定上清液中的透光率,结果显示:在外加磁场作用下,聚丙烯酸-壳聚糖纳米磁性微球在5 min时,上清液透光率达81.2%,经过10 min后上清液透光率由30.5%上升到94.1%,在自然重力场中,45 min内其透光率从29.1%上升到56%,说明聚丙烯酸-壳聚糖纳米磁性微球有较好的磁响应性和悬浮稳定性。
2.2 壳聚糖-聚丙烯酸纳米磁性微球红外光谱分析
图1是壳聚糖、聚丙烯酸接枝共聚后产物的红外光谱图,与标准红外图谱库中的壳聚糖、聚丙烯酸谱图对照得知:接枝共聚后谱图出现了几个新特征峰:3 400–3 500 cm处为O-H 伸缩振动与N-H伸缩振动重叠而成的多重吸收峰,630 cm处为典型的是Fe-O键特征峰,在1 100 cm附近出现了C-O和C=O键的特征吸收峰,1 524 cm附近是由-CONH-的N-H面内弯曲振动和C-N键伸缩振动引起,同时1 644 cm附近可能是由NH的N-N面内弯曲振动引起的,和纯壳聚糖相比,峰位置移向了较高的波数,另1 100 cm处出现的特征吸收峰,是-CH=CH和C-H的面外摇摆振动峰或者C-O和C=O键的特征吸收峰,或者二者的重叠峰,说明其分子结构中存在C=C双键。表明戊二醛与壳聚糖接枝共聚后的进行了交联,生成了目标物。
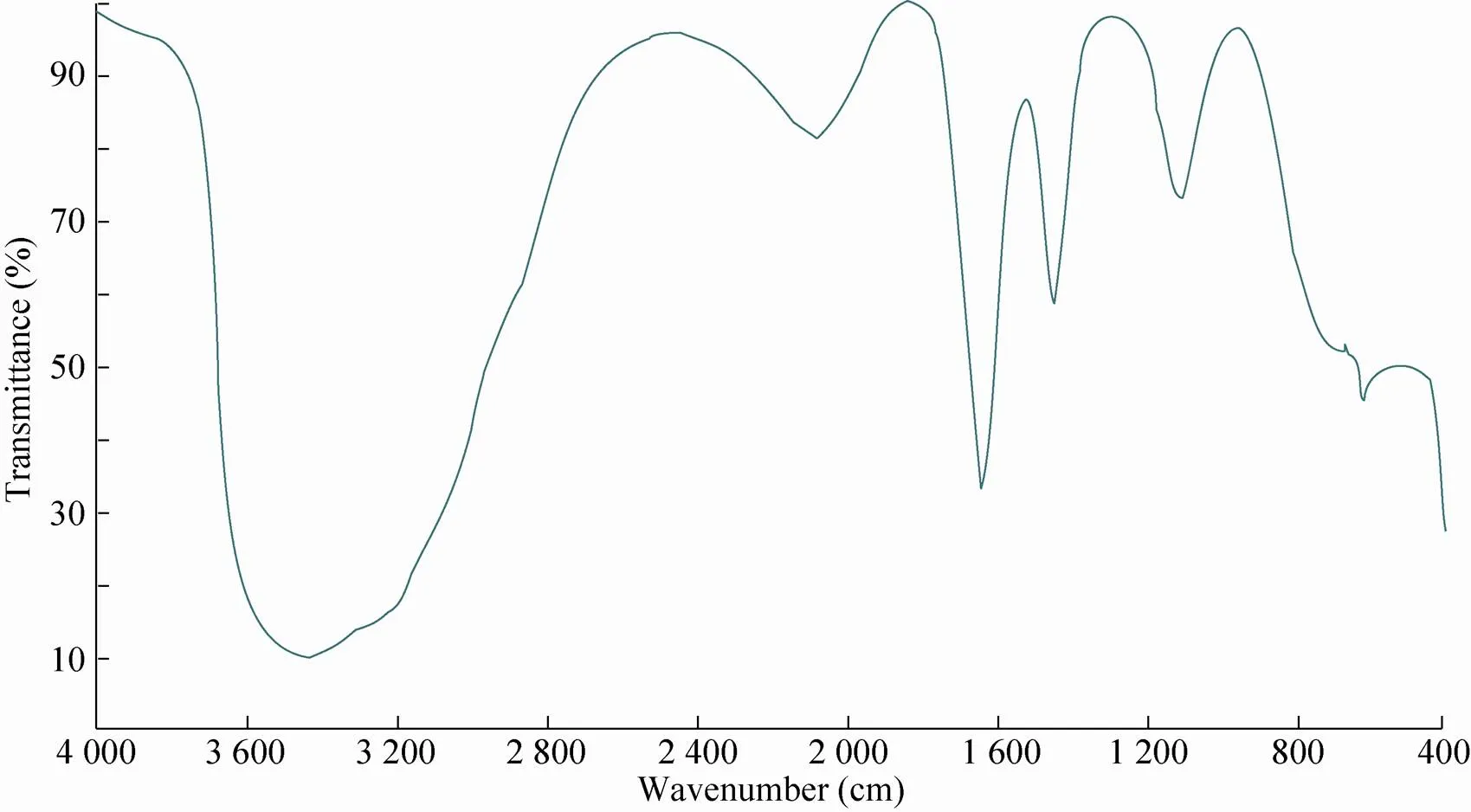
图1 壳聚糖-聚丙烯酸纳米磁性微球红外图谱
2.3 壳聚糖-聚丙烯酸纳米磁性微球的电镜形态观察
图2是FeO纳米粒子在EM-4000EX下放大100万倍的电镜图,图3是磁性壳聚糖纳米微球放大50万倍的电镜图,FeO纳米粒子被完整的包裹在壳聚糖中,经计算其粒径大小在150 nm左右。
2.4 磁性纳米磁性微球对Cu的螯合作用
纳米磁性微球螯合Cu后对血液SOD可以起到很好的吸附作用,这与Cu-ZnSOD的结构有很大关系,见图4。
2.5 壳聚糖-聚丙烯酸纳米磁性微球对SOD的特异性吸附作用
准确称取6等份的螯合Cu的纳米磁性微球溶解于适量的0.05 mol/L Tris-HCl缓冲液pH 7.6中,分别加入已知酶活性的SOD粗酶液2、4、6、8、10、12 mL,以缓冲液补充至相同体积,室温搅拌吸附30 min,磁分离收集并测定上清液中的酶活力,总活力减去上清液酶活即为磁性微球对SOD的吸附活性量,由图5可以看出,螯合Cu的磁性微球对血液SOD的最大活性吸附量为6 727 U/mg。

图2 Fe3O4纳米微球电镜图 (×100万倍)
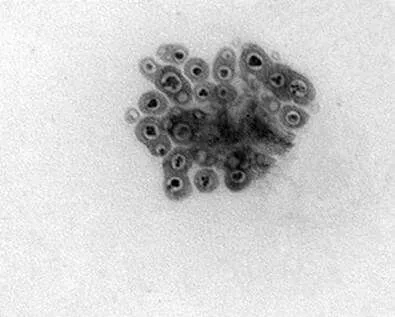
图3 壳聚糖-聚丙烯酸纳米磁性微球(×50万倍)

图4 纳米磁性微球对金属铜离子的吸附作用
2.6 纳米磁性微球纯化血液SOD各步结果
以丙酮沉淀后的粗品为活性对照,由表1各步可以看出,制备的壳聚糖-聚丙烯酸纳米磁性微球纯化血液超氧化物歧化酶得到了较高的酶活性,达 6 727 U/mg,活性回收达85.7%,产品得率达21.1%。

图5 壳聚糖-聚丙烯酸纳米磁性微球对SOD的特异性吸附作用
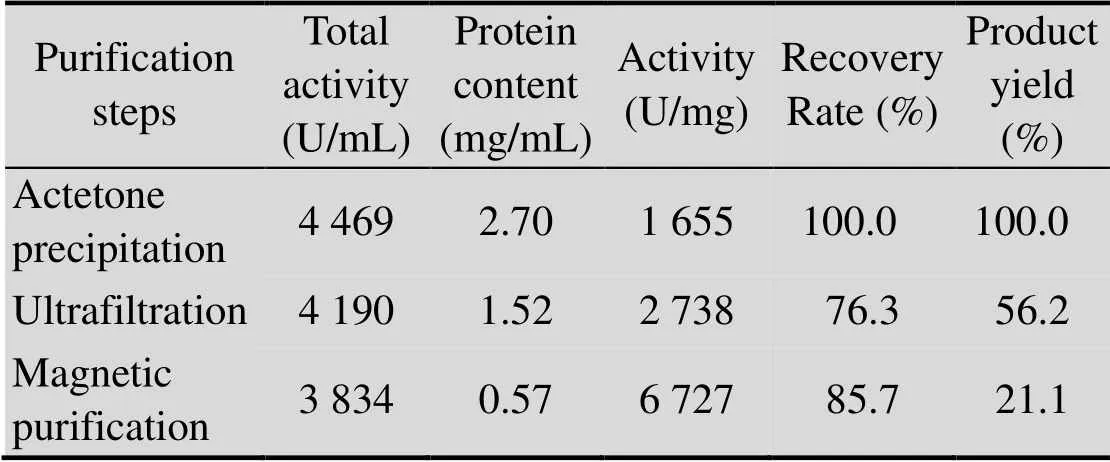
表1 磁性纳米微球纯化SOD结果表
3 讨论
近年来,结合功能性磁性吸附离子技术的应用得到广泛关注,磁分离技术具有快速、温和、规模化、制动化等特点,已在许多领域都得到可靠的证实,如分子诊断、肿瘤和细胞筛选,环境领域等。实验将磁分离技术应用于血液Cu-ZnSOD的吸附纯化,取得了很好的效果,另值得注意的是用壳聚糖包裹的磁流体即使没有偶联配基,也对模拟药物 (如蛋白质) 有一定的固载和吸附作用,这是因为微球中存在的醛基和蛋白药物中的氨基相互作用的结果。
REFERENCES
[1] Bozkir A, Saka OM. chitosan nanoparticles for plasmid DNA delivery: effect of chitosan molecular structure on formulation and release characteristics. Advanced Drug Deliv, 2004, 11(2): 107–112.
[2] Chew JL, Wolfowicz CB, Mao HQ, et al. Chitosan nanoparticles containing plasmid DNA encoding house dust mite allergen. Derp 1 for oral vaccination in mice. Vaccine, 2003, 21(22): 2720–2729.
[3] Chen XG, Lee CM, Park HJ, et al. O/W emulsification for the self-aggregation and nano particle formation of linoleic acid-modified chitosan in the aqueous system. Agric Food Chem, 2003, 51(10): 3135–3139.
[4] Chang YC, Chen DH. Preparation and adsorption properties of monodisperse chitosan- bound FeOmagnetic nanoparticles for removal of Cu (Ⅱ) ions. J Coll Inter Sci, 2005, 283(2): 446–451.
[5] Sararikova M. One-step partial purification of solanum tuberosum tuber lectin using magnetic chitosan partcles. Biotech Lett, 2000, 22(11): 941–945.
[6] Ren GZ, Li ZH, He BL. The immobilization of urease on magnetic chitosan microspheres. Ion Exchan Adsorp, 2001, 17(2): 152–158 (in Chinese).任广智, 李振华, 何炳林. 磁性壳聚糖微球用于脲激酶的固定化研究Ⅱ. 离子交换与吸附, 2001, 17(2): 152–158.
[7] Piter BR, Bardeletti G. Enzyme immobilization on immobilized and coimmobolized glucose oxidase and glucoamylase. Enzyme Microb Technol, 1992, 14(5): 361–370.
[8] Gou ML, Xie Z, Wang H, et al. Preparation of a magnetic fluid by chemical co-deposition method. West China Med J, 2007, 25(2): 37–39 (in Chinese). 苟马玲, 谢震, 王辉, 等. 采用化学共沉淀法制备纳米磁流体. 华西医学杂志, 2007, 25(2): 37–39.
[9] Zhou LM, Wang YP, Huang QW, et al. Adsorption proption properties of Cu, Cd, and Niby modified magnetic chitosan microspheres. Acta Phys Chem Sin, 2007, 23(12): 1979–1984 (in Chinese). 周利民, 王一平, 黄群武, 等. 改性壳聚糖微球对Cu, Cd, 和Ni的吸附性能. 物理化学学报, 2007, 23(12): 1979–1984.
[10] Sun XZ, Su ZX. Modification of chitosan and its adsorption for metal ions. Chem Res, 2005, 16(1): 29–33 (in Chinese). 孙新枝, 苏中兴. 改性壳聚糖的制备及其对金属离子的吸附性能. 化学研究, 2005, 16 (1): 29–23.
[11] Paul W, Sharma CP. Chitosan, a drug carrier for the 21st century a review. Stp Pharma Sci, 2000, 10(1): 5–22.
[12] Franzreb M, Siemann-Herzberg M, Timothy J, et al. Thomas protein purification using magnetic adsorption particles. Appl Microbiol Biotechnol, 2006, 70(5): 505–516.
[13] Muzzarelli RAA, Muzzarelli C. Chitosan chemistry: relevance to the biomedical sciences. Adv Polym Sci, 2005, 186(10): 151–209.
[14] Pillai CKS, Paul W, Chandra P. Chitin and chitosan polymers: chemistry, solubility and fiber formation. Prog Poly Sci, 2009, 23(7): 641–648.
[15] Tartaj P, Morales MP, Gonzalez-Garreno T, et al. Advances in magnetic nanoparticles for biotechnology applications. J Magne Mater, 2005, 290-291(1): 28–34.
(本文责编 陈宏宇)
Purification of superoxide dismutase from blood erythrocyte by nano magnetic chitosan microspheres
Baoquan Wang, Juan Ping, Feng Li, Yongzhou Zhang, Cui Liu, and Xiaobin Pang
1 Huaihe Hospital of Henan University, Kaifeng 475001, Henan, China 2 Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China 3 Pharmaceutical College of Henan University, Kaifeng 475001, Henan, China
Nano magnetic microspheres prepared by chitosan and poly acylic acid were applied to purifying superoxide dismutase from blood erythrocyte. Chitosan-polyacyilc acid graft copolymer was synthesized by free radical graft copolymerization with potassium persulfate as inititator. To prepare FeOmagnetic fluids with chemical coprecipitation, chitosan-polyacylic nano magnetic microspheres were prepared with glutaraldehyde as crosslinking agent. Structure of nano magnetic microspheres was detected by FT-IR spectrometer. Particle size and morphology were characterized by JEM-4000EX technology. Chitosan-polyacylic nanometer microspheres have good paticle cize distribution, magnetic responsiveness and protein adsoption. Activity, product yield and activity recovery of SOD after purification reached 6 727 U/mg, 21.1%, and 85.7% respectively. Purification of blood superoxide dismutase by chistosan-polyacylic acid microspheres has its renewable and feasible nature.
poly acrlic acid, nano magnetic microspheres, superoxide dismutase, purification
September 7, 2013; Accepted: March 20, 2014
Kaifeng Municipal Science and Technology Bureau Program (No. 1403018), National Natural Science Foundation of China (No. 81273652).
Xiaobin Pang. Tel: +86-378-3906303; E-mail: pxb0411@163.com
开封市科技局项目(No. 1403018),国家自然科学基金(No. 81273652) 资助。
网络出版时间:2014-04-15
http://www.cnki.net/kcms/doi/10.13345/j.cjb.130467.html

