猪肾细胞脂质磁转染系统的构建与表征
陈文杰,崔海信,赵翔,崔金辉,王琰,孙长娇
猪肾细胞脂质磁转染系统的构建与表征
陈文杰,崔海信,赵翔,崔金辉,王琰,孙长娇
中国农业科学院农业环境与可持续发展研究所纳米农业研究中心,北京 100081

陈文杰, 崔海信, 赵翔, 等. 猪肾细胞脂质磁转染系统的构建与表征. 生物工程学报, 2014, 30(6): 972−981.Chen WJ, Cui HX, Zhao X, et al.Construction and characterization of liposomal magnetofection system in pig kidney cells. Chin J Biotech, 2014, 30(6): 972−981.
磁性纳米基因载体是一种非病毒基因载体,经过功能性基团修饰后能够连接阳离子转染剂构建细胞转染系统。本文将磁转染技术结合常用的脂质体转染,形成了一种新型动物体细胞转染方法,即称脂质磁转染(Liposomal magnetofection, LMF)。这将为体细胞克隆培育转基因动物提供稳定遗传的细胞系。为构建脂质磁性纳米基因载体复合物系统,本研究利用一种磁性纳米基因载体通过分子自组装与脂质阳离子转染剂结合,用于携带外源基因转染动物体细胞。通过原子力显微镜 (AFM) 观测、ζ电位-粒度等分析表征手段,研究磁性纳米基因载体的形貌、粒径分布、负载及浓缩DNA的方式。结果表明,通过猪肾 (PK) 细胞的LMF实验,与脂质体 (Lipofectamine2000) 介导的转染比较,具有较高的转染率,更重要的是克服了脂质体转染瞬时表达的缺陷。MTT细胞毒性试验结果也显示该方法具有较低的细胞毒性。因此LMF是一种切实可行的高效低毒性的细胞转染方法。
脂质磁性纳米基因载体,磁转染,脂质磁转染
应用磁性纳米粒子与脂质体或阳离子脂质聚合物通过分子自组装、偶联聚合等物理化学作用过程,构建磁性脂质体复合物,在磁场的驱动下,有利于基因载体复合物吸附到细胞膜上,通过内吞作用增加基因被转运至细胞内的概率,并进入细胞核整合到基因组上、获得稳定表达,这个过程被称为脂质磁转染(Liposomal magnetofection, LMF)。
磁转染 (Magnetofection) 是指通过磁场作用将磁性纳米载体运转的基因输入和转化的过程。Chan于1996年发表的专利文献首次报道了基因的磁靶向传输,此项技术首先在分子治疗领域得到应用。Scherer等创造使用了磁转染这一术语,并开始给了其明确的定义,从此磁转染一词被广泛使用。此后,磁转染在应用于体内外核酸转运方面的研究日益增多,包括用于体内外反义寡核苷酸的输送,转化初生内皮细胞等。
由含有磁性或可以被磁化的金属或金属氧化物等材料制备而成的纳米粒子,具有磁响应特性,可通过共价结合、表面改性等化学反应赋予其表面多种功能基团,以物理吸附、静电作用、化学交联等方式偶联DNA等遗传物质,在外加磁场作用下进行移动和运转。氧化铁包括三氧化二铁(γ-FeO)和四氧化三铁(FeO),由于具有顺磁性,在外加磁场下可产生磁性,因此可实现靶向驱动性。为了改善其生物相容性以及富集核酸分子的能力,在FeO表面修饰壳聚糖、多聚赖氨酸、PEI (聚乙烯亚胺)、PEG (聚乙二醇)等,Petri-Fink等 将PEG、PEI、壳聚糖一起用于修饰纳米氧化铁颗粒,制备安全性较高的磁性纳米基因载 体,一种修饰有壳聚糖 (Chitosan, CP) 和PEI的超顺磁性氧化铁纳米颗粒 (Super paramagnetic iron oxide nanoparticles,SPIONP):CP-PEI-SPIONP,具高转染效率和非常低的细胞毒性,由转染小鼠C6神经胶质瘤细胞实验显示,转染效率达到50%,且细胞的生存率近100%。磁场介导条件下SPIONP磁转染技术用于动物或人体细胞的基因传输与转化已经有了很多研究。
脂质体 (Liposome) 特别是阳离子脂质体 (Cationic liposome) 作为一种基因转运工具得到了广泛的应用,与其他非病毒基因转运系统一样,它具有制备简单、转染效率高、无感染危险等优点。但阳离子脂质体存在瞬时转染、靶向性不高等缺点。为了弥补这些缺陷,有必要改善脂质体/DNA复合物的结构性质或与先进的靶向传输技术联用,发展出新型的靶向性与稳定转染的脂质体。而磁转染具有靶向性以及转化稳定性,磁性纳米基因载体能够克服脂质体基因载体存在的缺陷。
本研究使用一种能够与阳离子脂质体结合的顺磁性纳米颗粒,从而弥补阳离子脂质体作为基因载体存在的不足。两者结合形成的纳米基因载体复合物,综合了各自作为基因载体的优势,将改善外源基因的传输效率、转化效果以及目的基因的稳定表达,对获得体细胞克隆培育转基因动物提供稳定遗传的细胞供体材料具有重要意义。
1 材料与方法
1.1 材料
1.1.1 实验材料与主要试剂
pEGFP-N1大肠杆菌DH5α、PK细胞均由本室保存。细胞培养基DMEM购自Fisher公司。无钙镁PBS溶液、胎牛血清、细胞培养级DMSO购自Gibco公司。卡那霉素、链霉素、青霉素、G418、MTT购自Sigma公司。无内毒素质粒大提试剂盒购自Tiangen公司。表面未修饰的云母片购自中镜科仪公司。磁性纳米颗粒combiMAG100购自德国Chemicell公司。脂质体Lipofectamine2000购自Invitrogen公司。DAPI细胞核染色液购自碧云天生物公司。其他试剂均为国产分析纯。
1.1.2 主要仪器
紫外可见分光光度计 (UNICO UV-2100,上海);酶标仪 (Molecular Device SpectraMax 190,美国);血细胞计数板 (上海求精生化试剂仪器有限公司,上海);倒置荧光显微镜 (Olympus Ⅸ70,日本);原子力显微镜 (Bruker Multimode Ⅷ,美国);激光粒度分析仪 (Malvern Zetasizer Nano ZS,英国)。
1.2 PK细胞的培养
用含10%胎牛血清的DMEM培养基在37 ℃、5% CO、一定湿度的条件下常规培养PK细胞,每48 h更换一次培养基,72 h后传代培养。
1.3 质粒的制备
在超净工作台中挑取分散良好含pEGFP-N1质粒的单菌落,接种于含30 µg/µL卡那霉素的LB液体培养基中,37 ℃、180 r/min摇床中振荡培养至菌体形成絮状。用Tiangen公司无内毒素质粒提取试剂盒提取质粒,通过琼脂糖凝胶电泳鉴定提取的质粒,用紫外分光光度计测定质粒的纯度和浓度,取/≈1.8的质粒置于–20 ℃储存备用。
1.4 纳米基因载体及其复合物的表征
1.4.1 AFM观测
稀释pEGFP-N1质粒至1.5 ng/μL备用,稀释combiMAG至10 ng/μL,稀释均使用超纯水作为溶剂,振荡混匀1 min。分别吸取稀释后的质粒DNA、combiMAG各5 μL,各加5 μL乙醇 (50%),吹打混匀,静置10 min。两两混匀后,涡旋振荡1 min,37 ℃温育30 min,制成combiMAG/DNA基因载体复合物。分别吸取稀释后的质粒DNA、combiMAG和制备好的combiMAG/DNA基因载体复合物各10 μL,均匀滴加到新解理的云母片表面,置于干净培养皿中自然干燥。
AFM观测:Multimode 型扫描探针显微镜,ScanAsyst模式,谐振频率为0.977 Hz。
1.4.2 粒度分布及ζ电位分析
将combiMAG和脂质体溶液用超纯水稀释至1 ng/µL,以此稀释浓度按质量比2∶2∶1制备的combiMAG/liposome/DNA复合物,各取稀释样品1.2 mL置入样品皿中,用激光粒度分析仪测试粒径分布及ζ电位。
1.4.3 脂质磁性纳米基因载体对DNA的凝胶阻滞电泳实验
取combiMAG与质粒DNA (pEGFP-N1) 按照combiMAG/DNA为1∶1、2∶1、4∶1、8∶1、10∶1,combiMAG/liposome/DNA为1∶1∶1、2∶1∶1、2∶2∶1质量比例振荡混匀,37 ℃温育30 min,连接制备复合物,取各个比例的连接复合物样品5 µL,使用TE缓冲液稀释至 1∶1 000的SYBR Green I染色液预染10 min,并上样于1%琼脂糖凝胶,90 V电压条件下电泳40 min,用凝胶成像系统拍照成像。
1.5 脂质磁性纳米基因载体复合物介导细胞转基因
以含绿色荧光蛋白GFP基因的pEGFP-N1质粒为外源DNA,通过制备脂质磁性纳米基因载体复合物,转化PK细胞。实验操作步骤如下:
1)吸取脂质体2 µL,DMEM溶液稀释至50 µL,吸取pEGFP-N1质粒1 µg,用DMEM稀释后与脂质体按照质量比为1∶2充分混匀,37 ℃温育5 min后,加入含2 μg的combiMAG的DMEM溶液,振荡混匀,37 ℃温育30 min用于转染细胞。对照转染组,质量比脂质体/DNA为2∶1。
2) 转化前1天以每孔约1×10个细胞接种于24孔细胞培养板,37 ℃、5% CO培养至 细胞增殖到汇合率为70%左右,弃除旧培养液,PBS漂洗3–4次,加入上述配置好的基因载体复合物,每个处理3个重复,补足DMEM 至500 µL。
3)将基因载体复合物加入到培养板各孔后,24孔细胞培养板置于0.3 T的磁场下驱动,放入37 ℃、5% CO培养箱继续孵育。
4)磁场条件下孵育转化3 h后,更换含10%胎牛血清的DMEM培养液继续培养,分别在24、36、48、60、72 h后用倒置荧光显微镜观察绿色荧光蛋白的表达情况,每48 h换液一次,血细胞计数板计数并计算其转化效率。在转染后72 h时加入抗生素G418 (400 µg/mL),观察细胞转染后抗性筛选情况。
1.6 纳米基因载体复合物的细胞毒性实验
0.25%胰酶消化培养的单层细胞,含10%胎牛血清的DMEM培养基将其吹打制成细胞悬液,以每孔约1×10个细胞接种于96孔板,加入200 μL培养基。在37 ℃、5% CO条件下培养24 h后,按照1.5制备基因载体复合物的方法,载体和DNA的用量均为转染用量的1/10,质量比为combiMAG/DNA,1∶1,2∶1,5∶1;liposome/DNA,1∶1,2∶1;combiMAG/ liposome/DNA,1∶1∶1,2∶2∶1。在每孔内分别加入,每个处理设3个复孔,对照组为等体积的含血清培养基。加入基因载体复合物后,置于磁场下驱动,37 ℃、5% CO条件下温育3 h后,更换新鲜培养基,继续培养24 h后,每孔加入20 μL的MTT(5 mg/mL),37 ℃培养3 h。终止培养,吸去孔内上清液,加入150 μL DMSO,振荡10 min,使结晶充分溶解。在酶标仪上测定各孔490 nm吸收值,只加培养液的空白细胞设为对照调孔,以加入等体积的培养基、MTT、DMSO设为调零孔。细胞存活率 (Cell viability) =(样品)/(对照)。
2 结果
2.1 质粒与纳米基因载体复合物的表征
2.1.1 原子力显微镜观测
质粒DNA显示出各种的形态,有环状,有无规则的卷曲状,还有堆积在一起形成的团状,如图1A和1B所示。磁颗粒combiMAG粒径分散较为平均,粒径大小在80 nm左右,为表面光滑的球形结构,分散性良好 (图1C和1D)。DNA在连接combiMAG之后,被压缩富集,吸附在combiMAG的周围,可以看到每个磁颗粒可以连接多个DNA分子 (图1E和1F)。

图1 质粒DNA、磁性纳米颗粒combiMAG、combiMAG/DNA复合物的原子力显微镜图像
2.1.2 粒径分布与ζ电位测定
ζ电位反应纳米颗粒表面所带电荷,其绝对值越大,颗粒之间的排斥力越大,则分散体系越稳定,绝对值越趋于零,容易发生凝聚现象。ζ电位是体现纳米颗粒性能的一个重要参数,是决定纳米颗粒稳定性或在分散体中聚集性的重要因素。同时正的ζ电位更有利于富集更多带负电的核酸分子形成纳米基因载体复合物趋向带负电的细胞膜表面,增加基因输送入细胞内的概率,对转染效率的提高具有重要意义。应用激光粒度-zeta电位分析仪测得为纳米粒子的疏水粒径,combiMAG的平均粒径为 (161.7±1.2) nm (图2A,2C)。如图2C所示,combiMAG/DNA、combiMAG/lipo/DNA的平均粒径依次增加,分别为 (170.5±0.8) nm、 (189.9±2.3) nm,说明基因载体复合物已经初步形成。如图2D所示,combiMAG的ζ电位为 (13.8±0.7) mV (图2B,2D),脂质体liposome、liposome/DNA、combiMAG/lipo/DNA/的ζ电位依次为(49.4±1.3) mV、(24.3±1.6) mV、 (33.9±1.5) mV。由此可以看出,负载基因的纳米基因载体复合物带较强的正电性,有利于基因载体复合物通过静电作用吸附到细胞膜表面通过细胞吞噬作用被转运至细胞内。
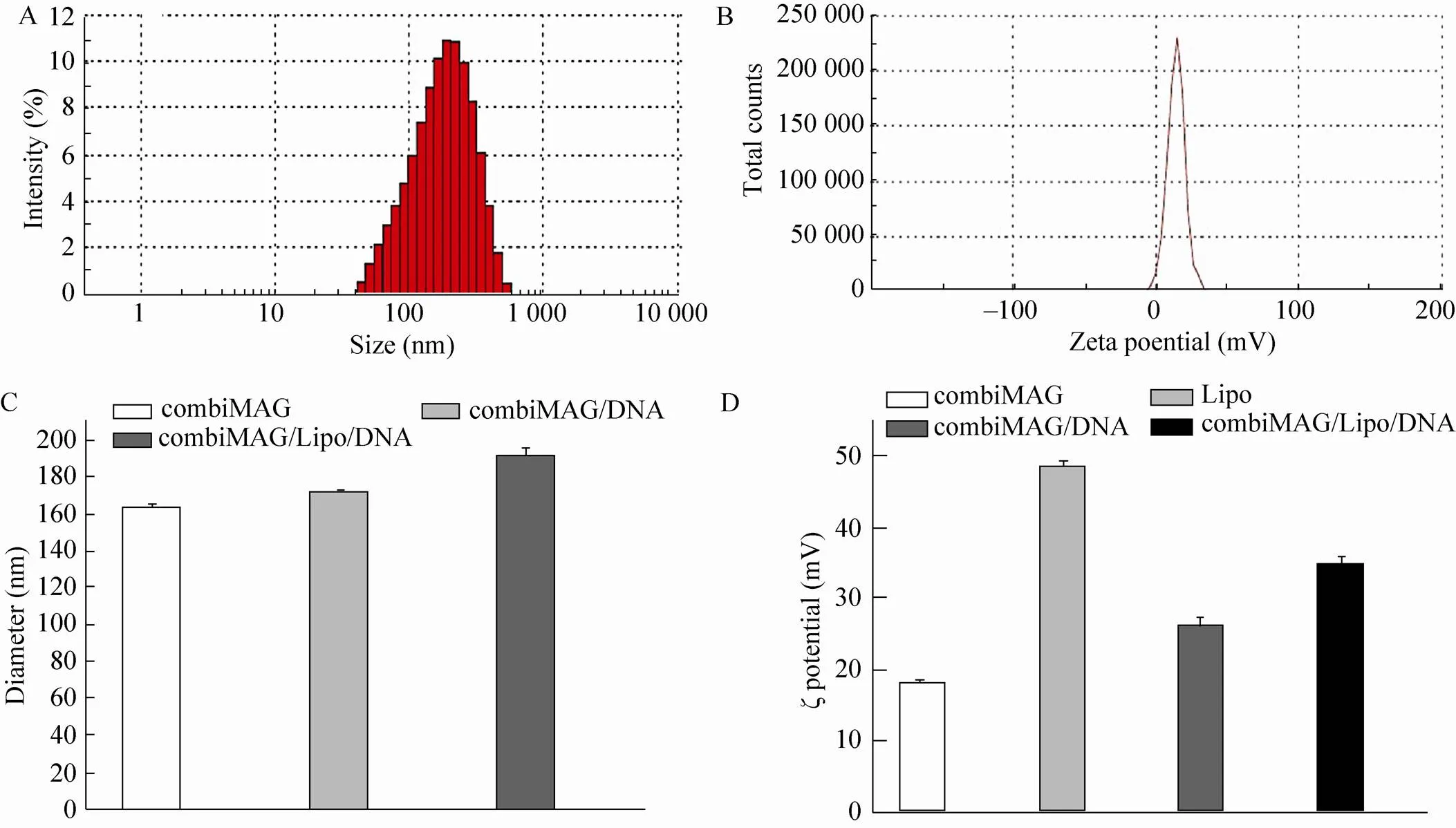
图2 基因载体与载体DNA复合物的粒径分布与ζ电位分析
2.1.3 脂质磁性纳米基因载体对DNA的凝胶阻滞电泳分析
脂质磁性纳米基因载体对DNA的凝胶阻滞电泳图结果见图3,泳道1–5为对DNA的结合能力分析,combiMAG/DNA质量比依次为1∶1、2∶1、4∶1、8∶1、10∶1,泳道6为单独的combiMAG。可见逸出点样孔的DNA条带亮度越来越低,呈梯度减弱,combiMAG结合能力与其质量成正比。泳道7–9为脂质磁性载体复合物对DNA的富集与结合能力分析,可见大部分DNA分子被结合形成基因载体复合物滞留在点样孔中,脂质磁性载体结合DNA能力较强。脂质磁性载体结合DNA后,能够减少细胞内核酸酶对外源基因的水解,起到保护作用。
2.2 脂质磁转染PK细胞
图4为报告基因绿色荧光蛋白在24 h (A,C,E) 和72 h (B,D,F) 时表达情况的显微镜图像,A和B为脂质体对照组,E和F为 combiMAG转染组,C和D为LMF组。随着转染后时间的延长,对比脂质体转染组出现表达减弱的现象,LMF组则显现出比较稳定的表达,并有增强的趋势,细胞增殖也是一方面原因。转染后24 h开始进行转染效率的记录,变化趋势如图5所示,脂质体转染组从36 h开始出现表达减弱的趋势,体现其瞬时表达的特征;LMF组,绿色荧光在48 h表达最强,且稳定表达,比脂质体转染与磁转染效果都好。
72 h后加入G418,对转染细胞进行初步筛选鉴定,在之后24 h起LMF组便开始获得较多成功转染的阳性细胞,而脂质体转染组由于瞬时转化的缺陷,未稳定表达GFP的大部分PK细胞被G418杀死,阳性细胞的得率很低。
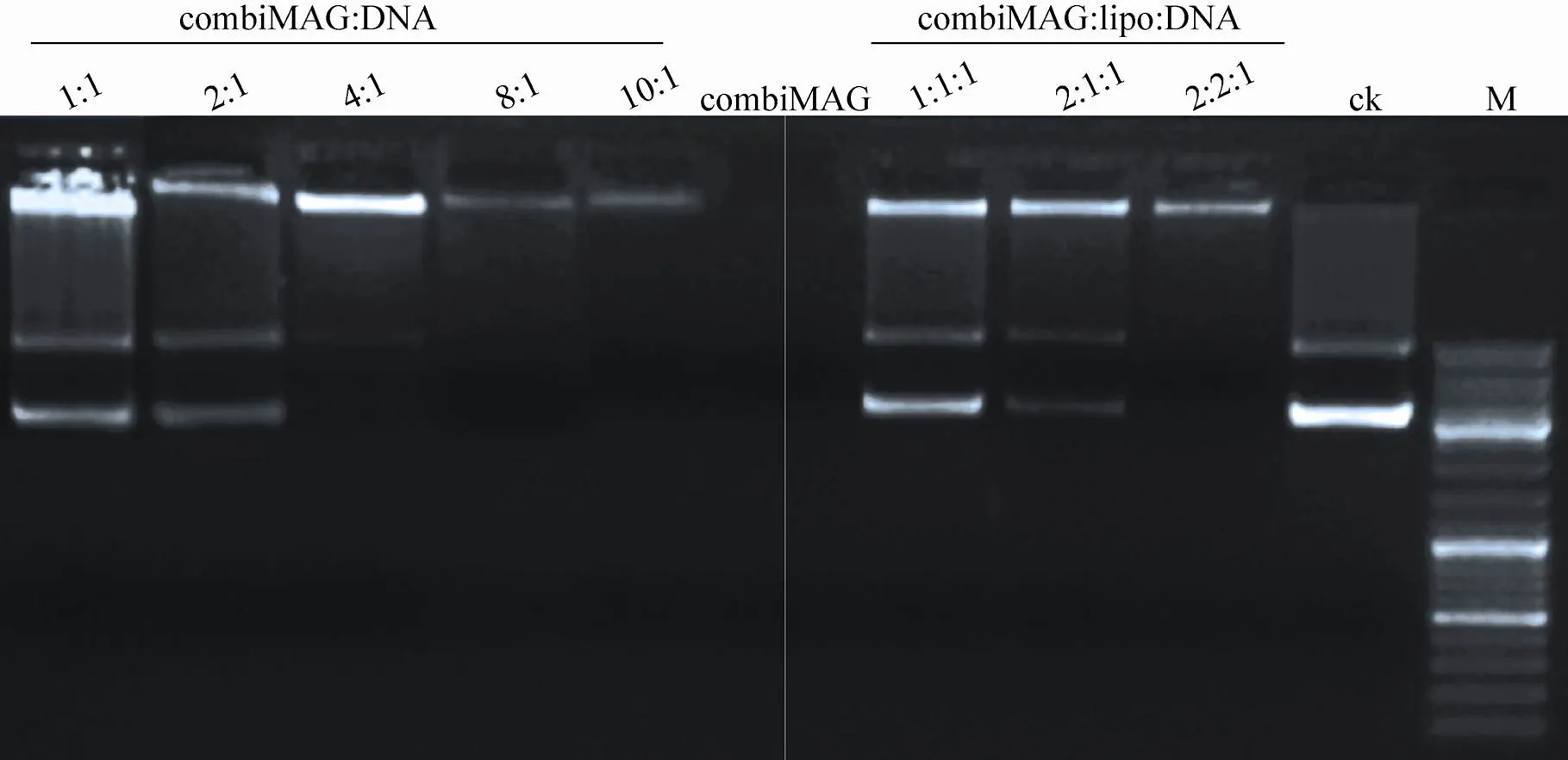
图3 脂质磁性纳米基因载体对DNA的凝胶阻滞电泳分析
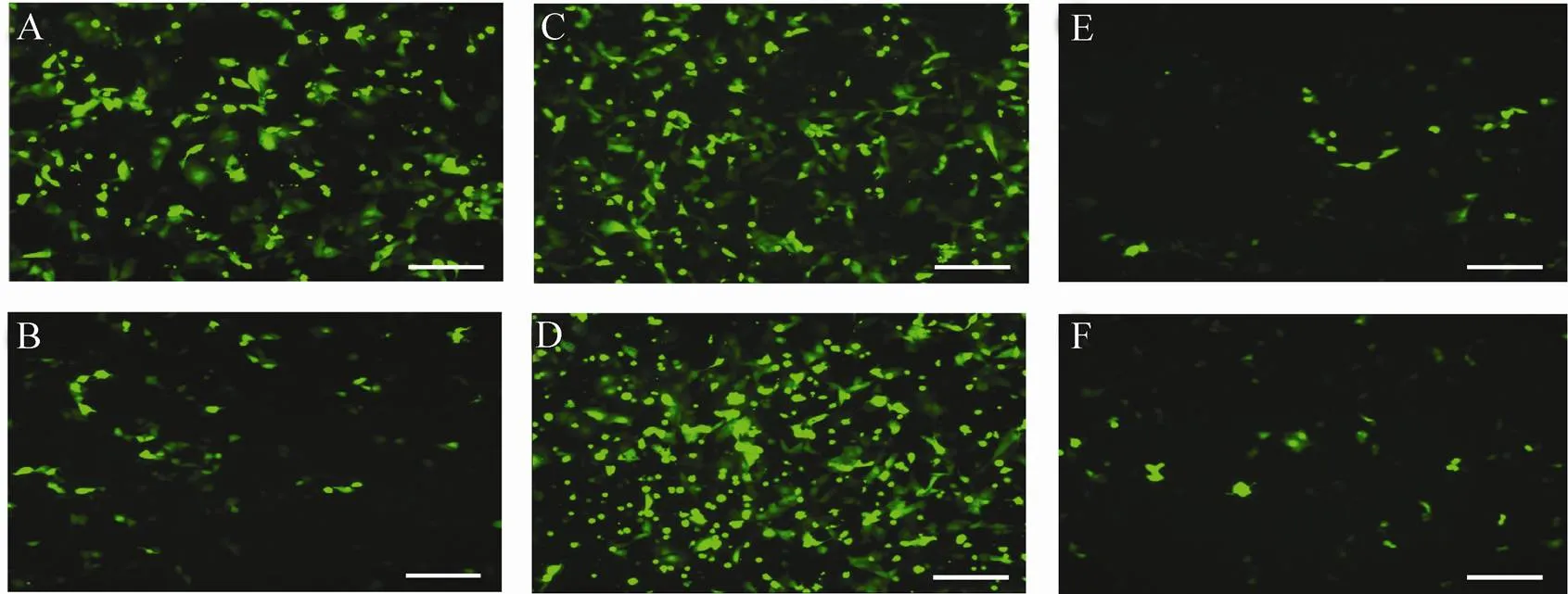
图4 转染PK细胞的绿色荧光蛋白表达效果图
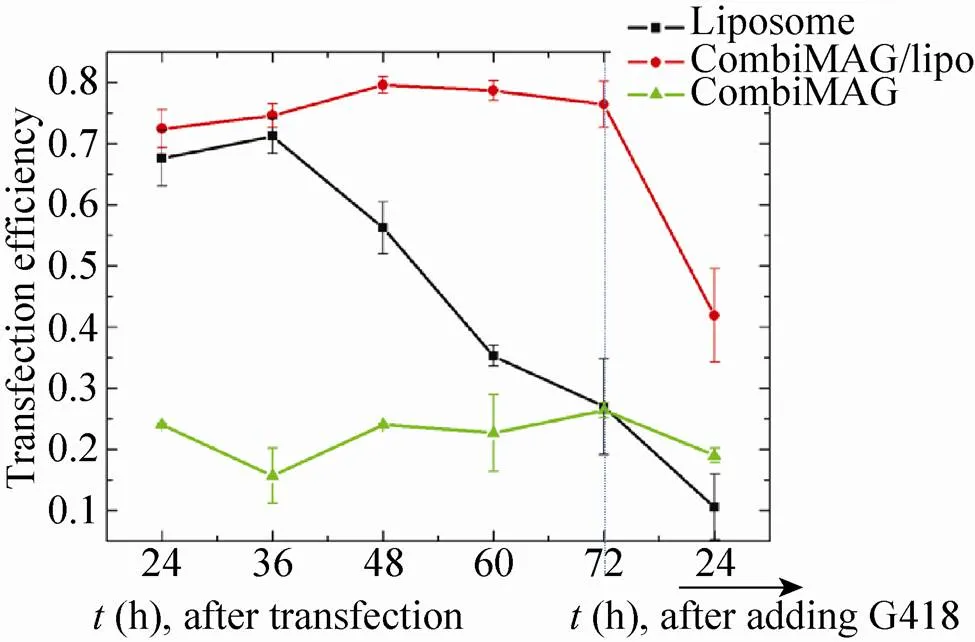
图5 转染荧光表达效率趋势图
2.3 细胞毒性试验
如图6所示,横坐标表示每个孔的加入量 (200 μL培养基),纵坐标表示细胞的存活率。磁性纳米载体combiMAG的细胞毒性随着加入量的增加而增大,但细胞存活率都在0.9以上,比相同浓度下的脂质体、阳离子基因载体PEI、常用转染剂polyfect都要低,显示出较好的生物相容性。值得注意的是,combiMAG与脂质体形成的基因载体复合物的细胞毒性要比单独的相同浓度的脂质体细胞毒性还低,有可能是两者之间的偶联聚合作用降低了载体复合物的细胞毒性(经SPSS统计分析,各组数据间具有显著差异性,<0.01)。

图6 各转染剂对细胞的毒性
3 讨论
理想的应用于细胞转染的非病毒基因载体应具有较低的细胞毒性,较强的核酸结合保护能力以及较高的转染效率等特性,磁性纳米基因载体具有纳米载体材料小尺寸、比表面积大、表面易修饰性等优点,经过功能化修饰,富集DNA能力显著增强,同时在磁场驱动下具有磁靶向性。本实验室在以往的工作中已经开展了动植物细胞磁转染技术的相关实验,分别进行了聚乙烯亚胺、氨基硅烷和壳聚糖修饰的3种磁性纳米颗粒作为基因工程载体的研究,并验证了磁性纳米载体作为293T细胞的基因转染载体的可行性与优越性,本研究在以往工作基础上进行了拓展:将磁性纳米基因载体与脂质体结合,形成一种新型的LMF方法用于细胞转基因,兼具磁转染与脂质体转染方法的优点,不仅克服了脂质体转染的瞬时性缺陷,还体现出低细胞毒性、高转染效率等优点;同时,从纳米尺度使用AFM直观地观测到单个纳米基因载体负载连接质粒DNA的作用方式;此外,对于转染同一类型的猪体细胞,在细胞转染后不到24 h即观测到高效率的基因表达,比单纯的磁转染表达更为迅速,还呈现高出多倍的表达效率和持续稳定的表达效果。这对于优化细胞的基因转染进程具有重要的意义。传统的转基因载体往往运载单个目的基因片段,主要是由于运输载体和表达载体的基因装载量有限,不能够高效地实现多基因协同并转。而LMF方法由于具备纳米材料载体的优良特性,表面可修饰特异性基团,如含有核定位序列的鱼精蛋 白,有望实现基因高效转运至细胞核的几率,增加转染效率。同时还可能装载大片段基因以及多个外源基因共转,实现多基因并转,Park等使用二次LMF的方法,将4个转录因子基因导入小鼠胚胎成纤维细胞中,快速高效生成了无病毒的诱导多能性干细胞 (Induced pluripotent stem cells, IPSC),细胞重编程效率高达0.032%–0.04%,这比一般的磁转染方法诱导生成IPSC的效率 (0.001%–0.003%) 要高得多,而一般的非病毒载体诱导IPSC的效率只有 0.000 1%–0.001 2%。同时,使用LMF方法转染动物体细胞或生殖细胞,对发展核移植技术、培育转基因动物新品种、改善动物优良性状具有重要意义。
磁场条件介导的 (脂质) 磁转染过程中磁性纳米基因载体传输 (Delivery) 基因进入细胞的动态机制是磁转染研究的难点,包括入胞后其所负载DNA的释放机制,是否进入细胞核,以及完成基因转运后是否排出 (Release) 至胞外等过程机制问题,均有待于进一步研究。
REFERENCES
[1] Mykhaylyk O, Sánchez-Antequera Y, Vlaskou D, et al. Liposomal Magnetofection. New York: Humana Press, 2010: 487–525.
[2] Mykhaylyk O, Sánchez-Antequera Y, Vlaskou D, et al. Generation of magnetic nonviral gene transfer agents and magnetofection. Nat Protoc, 2007, 2(10): 2391–2411.
[3] Chan DCF. Magneto-biolistic methods: US, 5753477. 1998-05-19.
[4] Mah C, Zolotukhin I, Fraites TJ, et al. Microsphere mediated delivery of recombinant AAV vectorsand. Mol Ther, 2000, 1: S239.
[5] Scherer F, Anton M, Schillinger U, et al. Magnetofection: enhancement and localization of gene delivery with magnetic particles under the influence of a magnetic field. J Gene Med, 2000, 2: S24.
[6] Krötz F, De Wit C, Sohn HY, et al. Magnetofection-a highly efficient tool for antisense oligonucleotide deliveryand. Mol Ther, 2003, 7(5 Pt 1): 700–710.
[7] Krötz F, Sohn HY, Gloe T, et al. Magnetofection potentiates gene delivery to cultured endothelial cells. J Vas Res, 2003, 40(5): 425–434.
[8] Yoon TJ, Kim JS, Kim BG, et al. Multifunctional nanoparticles possessing a “magnetic motor effect” for drug or gene delivery. Angew Chem Int Edit, 2005, 117(7): 1092–1095.
[9] Xiang JJ, Tang JQ, Zhu SG, et al. IONP‐PLL: a novel non‐viral vector for efficient gene delivery. J Gene Med, 2003, 5(9): 803–817.
[10] Steitz B, Hofmann H, Kamau SW, et al. Characterization of PEI-coated superparamagnetic iron oxide nanoparticles for transfection: size distribution, colloidal properties and DNA interaction. J Magn Magn Mater, 2007, 311(1): 300–305.
[11] Wang H, Zhang S, Liao Z, et al. PEGlated magnetic polymeric liposome anchored with TAT for delivery of drugs across the blood-spinal cord barrier. Biomaterials, 2010, 31(25): 6589–6596.
[12] Kievit FM, Veiseh O, Bhattarai N, et al. PEI-PEG-chitosan-copolymer-coated iron oxide nanoparticles for safe gene delivery: synthesis, complexation, and transfection. Adv Funct Mater, 2009, 19(14): 2244–2251.
[13] Petri-Fink A, Steitz B, Finka A, et al. Effect of cell media on polymer coated superparamagnetic iron oxide nanoparticles (SPIONs): colloidal stability, cytotoxicity, and cellular uptake studies. Eur J Pharm Biopharm, 2008, 68(1): 129–137.
[14] Song HP, Yang JY, Lo SL, et al. Gene transfer using self-assembled ternary complexes of cationic magnetic nanoparticles, plasmid DNA and cell-penetrating Tat peptide. Biomaterials, 2010, 31(4): 769–778.
[15] Cheong SJ, Lee CM, Kim SL, et al. Superparamagnetic iron oxide nanoparticles-loaded chitosan-linoleic acid nanoparticles as an effective hepatocyte-targeted gene delivery system. Int J Pharmaceut, 2009, 372(1): 169–176.
[16] Kami D, Takeda S, Itakura Y, et al. Application of magnetic nanoparticles to gene delivery. Int J Mol Sci, 2011, 12(6): 3705–3722.
[17] Aronsohn AI, Hughes JA. Nuclear localization signal peptides enhance cationic liposome-mediated gene therapy. J Drug Target, 1998, 5(3): 163–169.
[18] Wang C, Ding C, Kong M, et al. Tumor-targeting magnetic lipoplex delivery of short hairpin RNA suppresses IGF-1R overexpression of lung adenocarcinoma A549 cellsand. Biochem Biophys Res Commun, 2011, 410(3): 537–542.
[19] Zheng J, Li Z, Wu A, et al. AFM studies of DNA structures on mica in the presence of alkaline earth metal ions. Biophys Chem, 2003, 104(1): 37–43.
[20] Zhang Y, Yang M, Portney NG, et al. Interaction of nanoparticles with normal and cancer human breast epithelial cells. Biomed Microdev, 2008, 10(2): 321–328.
[21] Li Y. Method study on magnetic nanoparticles as gene engineering carriers in cell transformation[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010(in Chinese).李瑶. 磁性纳米基因工程载体细胞转化方法研究[D]. 北京: 中国农业科学院, 2010.
[22] Lu YM, Cui HX, Cui JH, et al. Study on magnetic nanoparticles as carriers for gene transfection. Biotech Bull, 2012, 8: 199–204(in Chinese).卢艳敏, 崔海信, 崔金辉, 等. 磁性纳米颗粒作为基因转染载体的研究. 生物技术通报, 2012, 8: 199–204.
[23] Qi L, Wu L, Zheng S, et al. Cell-penetrating magnetic nanoparticles for highly efficient delivery and intracellular imaging of siRNA. Biomacromolecules, 2012, 13(9): 2723–2730.
[24] Park HY, Noh EH, Chung HM, et al. Efficient generation of virus-free iPS cells using liposomal magnetofection. PLoS ONE, 2012, 7(9): e45812.
[25] Lee CH, Kim JH, Lee HJ, et al. The generation of iPS cells using non-viral magnetic nanoparticlebased transfection. Biomaterials, 2011, 32(28): 6683–6691.
[26] Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors. Science, 2008, 322(5903): 949–953.
(本文责编 郝丽芳)
Construction and characterization of liposomal magnetofection system in pig kidney cells
Wenjie Chen, Haixin Cui, Xiang Zhao, Jinhui Cui, Yan Wang, and Changjiao Sun
Research Center for Nanoscale Science in Agriculture, Institute of Environment and Sustainable Development on Agriculture, Chinese Academy of Agricultural Sciences (CAAS), Beijing 100081, China
Magnetic nano gene vector is one of the non-viral gene vectors, modified by functional group to bind cationic transfect reagents. Coupling magnetofection with the universal lipofection we developed a novel somatic cell transfection method as the so-called liposomal magnetofection (LMF). This approach is potential to provide somatic cell cloning with stable genetic cell lines to cultivate transgenic animals. In order to construct such liposomal magnetic gene vectors complexes system, we used nano magnetic gene vector to combine with liposomal cationic transfect reagents by molecular self-assembly. This vectors system successfully carried exogenous gene and then transfected animal somatic cells. Here, we conducted atomic force microscopy (AFM), zeta potential-diameter analysis and other characterization experiments to investegate the size distribution and morphology of magnetic nanoparticles, the way of the vectors to load and concentrate DNA molecules. Our data reveal that, the LMF of Pig Kidney cells exhibited higher transfection efficiency comparing with the transfection mediated by the commercial lipofectamine2000. Moreover, LMF method overcomes the constraint of transient expression mediated by lipofection. Meanwhile, MTT assay showed low cytotoxicity of LMF. Hence, LMF is a feasible, low cytotoxic and effective method of cell transfection.
liposomal magnetic nano gene vector, magnetofection, liposomal magnetofection (LMF)
September 13, 2013; Accepted: December 13, 2013
Genetically Modified Organisms Breeding Major Projects (No. 2009ZX08010-006B), Basic Scientific Research Fund of National Nonprofit Institutes (No. BSRF 201108).
Haixin Cui. Tel/ Fax: +86-10-82105997; E-mail: haixincui@ieda.org.cn
转基因生物新品种培育科技重大专项 (No. 2009ZX08010-006B),中央级公益性科研院所基本科研业务费专项资金(No. BSRF 201108) 资助。
网络出版时间:2013-12-19
http://www.cnki.net/kcms/detail/11.1998.Q.20131219.1535.001.html

