miR373和miR542-5p调控肠道病毒71型在人横纹肌肉瘤细胞中的复制
杨倬1,田波2
miR373和miR542-5p调控肠道病毒71型在人横纹肌肉瘤细胞中的复制
杨倬,田波
1 中国疾病预防控制中心营养与食品安全所,北京 100050 2 中国科学院微生物研究所病原微生物与免疫学重点实验室,北京 100101

杨倬, 田波. miR373和miR542-5p调控肠道病毒71型在人横纹肌肉瘤细胞中的复制. 生物工程学报, 2014, 30(6): 943−953.Yang Z, Tien P. miR373 and miR542-5p regulate the replication of Enterovirus 71 in rhabdomyosarcoma cells. Chin J Biotech, 2014, 30(6): 943−953.
研究发现microRNAs (miRNAs) 可以参与调控病毒在宿主细胞内感染和复制的过程。为了揭示miRNAs是否参与肠道病毒71型 (Enterovirus 71, EV71) 的感染与复制,研究了miRNAs 对EV71病毒在宿主细胞内复制的影响。构建miRNAs靶基因筛选系统,在双荧光素酶报告体系的pMIR载体插入病毒基因,如果插入的基因序列能被细胞内的miRNAs靶向调控,报告基因的表达将发生变化。实验发现EV71病毒5′-UTR基因可能是miRNAs的作用靶标。随后利用miRNAs在线分析软件预测并验证可能作用于5′-UTR基因片段的miRNAs。为了研究miRNAs分子对5′-UTR基因的调控作用是否可以体现在EV71病毒的复制过程中,在人横纹肌肉瘤(Rhabdomyosarcoma, RD)细胞中转染miRNAs mimics,利用Western blotting和real-time PCR实验检验EV71病毒的复制和表达情况。实验结果表明,miR373和miR542-5p可以通过作用于EV71病毒5′-UTR基因从而抑制病毒在RD细胞中的复制和表达。细胞内miR373和miR542-5p可以调控EV71在宿主细胞中的复制过程。研究EV71病毒与宿主miRNAs的相互作用机制为进一步阐明EV71病毒感染与复制机理奠定了基础。
miRNAs,肠道病毒71型,人横纹肌肉瘤细胞,病毒复制
miRNAs是近几年分子生物学研究方面的热点,它是一类长度大约为19−25个核苷酸的单链非编码小分子RNA,通过抑制靶基因mRNA的翻译过程或者降解靶基因的mRNA分子,介导转录后基因表达的调控过程。miRNAs首先是由基因组转录出初始产物,称为pri-miRNA,pri-miRNA 在Drosha核酸内切酶的作用下剪切成长度约为60−70个核苷酸,具有茎环结构的miRNAs前体,称为premiRNA。pre-miRNA 在转运蛋白的作用下从细胞核运输到细胞质中,被核酸内切酶Dicer剪切成19−25个核苷酸长的双链RNA,随即双链解旋,形成成熟的miRNAs。成熟的miRNAs与相关蛋白形成RNA诱导的沉默复合(RISC),结合到有互补序列的mRNA 上,抑制该mRNA的翻译或者使其降解,从而实现对基因表达的转录后调控作用。
研究表明,miRNAs不但可以参与调控细胞中如细胞增殖、凋亡、分化等一系列的生理过程,还可以参与调控病毒在宿主细胞内复制的过程。2005年,Charles-Henri Lecellier 等报道在哺乳动物细胞中,miR32可以通过与病毒mRNA结合有效地抑制Ⅰ型灵长类泡沫病毒(PFV-I) 在细胞中的积累;2008年,Henke和Chang等同时报道在肝组织特异性表达的miR122能通过与丙型肝炎病毒(HCV) 基因组5¢非编码区的相互作用,使病毒RNA在细胞中富集,诱导病毒基因转录,从而促进丙型肝炎病毒在肝癌细胞系(Huh-7细胞) 中的复制,在非肝细胞(如HEK-293 和HeLa) 中过表达miR122也同样可以观察到这种作用。
手足口病(Hand,foot and mouth disease,HFMD) 是由多种肠道病毒引起的,以婴幼儿发病为主的常见传染病。肠道病毒是引发食源性疾病的主要病因,主要经食物、水和环境进行传播。肠道病毒71型 (Enterovirus 71) 属于小RNA病毒科 (Picrornaviridae) 肠道病毒属 (Enterovirus, EV) 是一类常见的经呼吸道和消化道感染人体的病毒, 是手足口病的主要病原体。RD细胞支持HFMD的主要病原体EV71和CVA16等多种肠道病毒的复制,均能在RD细胞培养中引起特殊的肠道病毒致细胞病变效应 (CPE)。本实验针对宿主细胞内miRNAs是否参与EV71病毒在细胞内的复制,构建了miRNAs靶基因筛选系统,利用双荧光素酶报告体系来研究EV71病毒基因表达是否受到miRNAs的调控。根据报告基因表达的变化,发现作用在EV71病毒的5¢-UTR基因上的miR373和miR542-5p可能会对EV71病毒的复制有影响。本文首次报道了miR373和miR542-5p对EV71病毒在RD细胞内复制的调控作用,为miRNAs参与调节EV71病毒复制的相关研究提供了有价值的参考。
1 材料与方法
1.1 材料
1.1.1 病毒、质粒和细胞株
EV71 Hubei-09 (C4亚型,GenBank Accession No. GU434678) 株由武汉大学病毒学国家重点实验室提供;人横纹肌肉瘤细胞(Rhabdomyosarcoma, RD) 为本实验室保存;pMIR和pRL-CMV荧光素酶报告载体由本实验室保存。
1.1.2 miRNAs的合成
miR373和miR542-5p mimics,miR-RiboTM mimics Negative control由广州锐博生物有限公司进行合成。
1.1.3 试剂和仪器
核酸限制性内切酶Ⅰ、d Ⅲ,T4 DNA连接酶及Pyrobest高保真性DNA聚合酶购自TaKaRa公司。鼠源EV71单克隆抗体 (MAB979)购自Millipore公司。-actin及辣根酶标记的山羊抗小鼠IgG购自北京中山金桥公司。RNA提取Trizol试剂购自上海Invitrogen公司。反转录、Real time PCR、双荧光检测试剂盒购自Promega 公司。转染试剂Lipofectamine 2000 购于美国Invitrogen公司。Dulbecco's modified eagle medium (DMEM) 培养基和胎牛血清 (FBS) 购自Gibco BRL公司。蛋白电泳仪、PCR仪及酶标仪为美国Bio-Rad公司产品。Real time PCR 仪为美国ABI公司产品。
1.2 miRNAs靶基因筛选系统的建立
1.2.1 重组载体的构建
用于miRNAs作用靶标筛选的3′-UTR分析系统包含两个荧光素酶报告基因载体,一个为pMIR载体,另一个为pRL-CMV载体。pMIR载体可以表达萤火虫荧光素酶,在萤火虫荧光素酶的3′-UTR区含有多克隆位点插入目的基因。pRL-CMV载体能高效表达海肾荧光素酶,作为内参。根据EV71 Hubei-09株的基因序列(GenBank Accession No. GU434678.1),以EV71全长cDNA为模板,克隆得到EV71的13个基因片段5′UTR、VP4、VP2、VP3、VP1、2A、2B、2C、3A、3BC、3D1、3D2、3′UTR,以及5′-UTR的3个亚片段5′-UTR-1、2、3。然后将以上的基因片段插入pMIR载体3′-UTR区的多克隆位点中的Ⅰ/dⅢ限制性酶切位点处。构建成重组载体pMIR-EV71-(5′UTR、VP4、VP2、VP3、VP1、2A、2B、2C、3A、3BC、3D1、3D2、3′UTR、5′UTR-1、5′UTR-2、5′UTR-3)。实验中所用引物均由北京奥科生物公司合成,序列见表1。
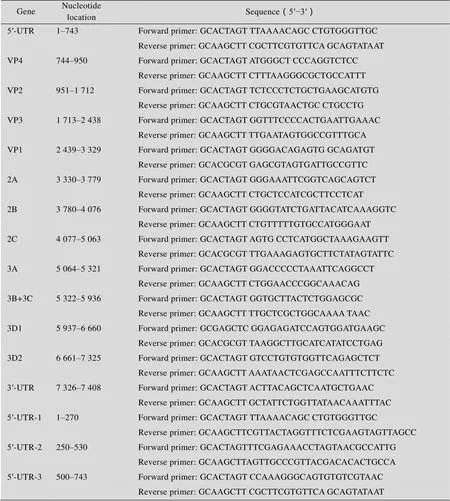
表1 EV71病毒基因片段的PCR扩增引物
1.2.2 miRNAs结合靶点预测
ViTa数据库包括了已知病毒的miRNAs以及相应的由miRanda和TargetScan预测的宿主miRNAs靶基因。MicroInspector在线分析软件可以预测特定miRNAs的作用靶基因,也可以预测在已知序列上具有潜在作用靶点的miRNAs。而rna22和RNA Hybrid在线分析软件则主要针对两条已知的RNA序列的相互作用进行验证,通过二级结构和结合自由能来评价。我们利用MicroInspector和ViTa预测病毒基因片段上潜在结合位点的miRNAs,用rna22和RNA Hybird验证预测结果。
1.2.3 双荧光素酶检测
RD细胞接种于24孔板中,将构建好的重组pMIR载体和pRL-CMV载体利用转染试剂Lipofectamine 2000共转染RD细胞,转染30 h后收集细胞,用PBS洗一遍细胞,稀释5×裂解液,24孔板每孔加入100 μL,冰上放置10 min,12 000 r/min离心2 min,取上清采用Promega公司的双荧光检测试剂盒检测荧光素酶的表达。如果构建在pMIR载体上的病毒基因序列受到宿主细胞内的miRNAs的调控,将影响载体上荧光素酶的表达,通常以海肾荧光素酶活性作为内参,用测定的萤火虫荧光素酶的表达值比海肾荧光素酶的表达值,考察萤火虫荧光素酶活性的变化。
1.3 Western blotting检测
RD细胞用含10%胎牛血清、100 μg/mL氨苄青霉素、100 μg/mL链霉素的DMEM培养基于37 ℃、5% CO的培养箱,饱和湿度条件下培养。当细胞融合达到80%−90%时,用2.5% 胰蛋白酶消化单层培养的RD细胞,用DMEM终止消化,4 ℃、500 r/min离心5 min,用DMEM 培养基调整细胞数为2´10/mL的单细胞悬液,以1 mL/孔接种于12孔板中,培养24 h细胞贴壁后,合成的miRNAs mimics及阴性对照miR-RiboTM mimics Negative control分别转染RD细胞,6 h后接种10 μL的TCID为1´10的EV71病毒。48 h后收集细胞,用细胞裂解液冰上裂解细胞20 min,12 000 r/min离心10 min 收集上清液,15%分离胶进行SDS-PAGE电泳后,利用湿转法将蛋白转移至PVDF膜上。10% 脱脂奶粉封闭过夜。孵育特异性抗体,鼠源EV71单克隆抗体浓度为1∶2 000,-actin抗体为1∶2 000,二抗为辣根酶标记的山羊抗小鼠IgG浓度为1∶2 000,加ECL发光液,显影。
1.4 Real-time PCR 检测
取2.5%胰蛋白酶消化单层培养的RD细胞,用DMEM培养基调整细胞数为2´10/mL的单细胞悬液,以1 mL/孔接种于12孔板中,培养24 h细胞贴壁后,合成的miRNAs mimics及阴性对照miR-RiboTM mimics Negative control分别转染RD细胞,6 h后,每孔接种10 μL的TCID为1´10的EV71病毒,48 h后按照Trizol说明书提取细胞总RNA,取RNA 150 ng进行逆转录合成cDNA。采用引物设计软件Primer 5.0,设计EV71病毒和基因的引物,Real-time PCR引物由北京奥科生物公司合成 (表2)。按照Promega Real-Time PCR 试剂盒说明书进行Real-time PCR检测,扩增条件为:95 ℃ 10 min,94 ℃ 10 s,60 ℃ 1 min,40个循环。PCR扩增后按照2法计算相对表达值,分析实验组与对照组的差异。
1.5 数据分析
2 结果
2.1 双荧光素酶报告系统的构建
双荧光素酶报告系统包含两个荧光素酶报告基因载体,pMIR载体可以表达萤火虫荧光素酶,在萤火虫荧光素酶的3′-UTR区含有多克隆位点插入病毒基因。pRL-CMV载体能高效表达海肾荧光素酶,作为内参。如图1所示,将EV71的13个基因片段5′UTR、VP4、VP2、VP3、VP1、2A、2B、2C、3A、3BC、3D1、3D2、3′UTR插入pMIR载体3′-UTR区的多克隆位点中的Ⅰ/d Ⅲ限制性酶切位点处。构建成重组载体pMIR-EV71-(5′UTR、VP4、VP2、VP3、VP1、2A、2B、2C、3A、3BC、3D1、3D2、3′UTR)。将构建好的重组双荧光素酶报告载体转染宿主细胞筛选miRNAs调控病毒基因的靶位点。

表2 Real-time PCR反应中用于扩增EV 71 vp1和β-actin的引物

图1 双荧光素酶报告系统构建
2.2 EV71病毒的5′-UTR基因片段是宿主细胞miRNAs的作用靶点
将构建的重组pMIR载体和pRL-CMV载体共转染24孔板培养的RD细胞,30 h后进行Luciferase双荧光检测。如图2所示,实验对照组为转染pMIR空载体的细胞,结果发现与对照组相比,转染pMIR-5′UTR重组载体的细胞的相对荧光素酶活性抑制最为显著。由此推测报告基因表达的下调可能是宿主miRNAs介导的抑制作用,病毒5′-UTR基因可能是miRNAs的作用靶点。为了更加明确作用位点,将EV71病毒5′-UTR基因片段分为3个亚片段连接到pMIR载体中,构建重组载体pMIR-EV71-(5′UTR-1、5′UTR-2、5′UTR-3)。图3结果显示,与对照组相比,转染pMIR-5′UTR-1重组载体的细胞的相对荧光素酶活性最低。以上结果说明5′UTR-1基因片段很有可能是宿主miRNAs的潜在的作用靶点从而能够抑制报告基因荧光素酶的表达。
2.3 靶向5′UTR-1基因片段的miRNAs的预测
为了确定宿主细胞miRNAs是否能够功能性抑制pMIR-5′UTR-1重组载体的荧光素酶活性,我们利用MicroInspector和ViTa预测5′-UTR-1基因片段上潜在结合位点的miRNAs,用rna22和RNA杂交在线程序 (Hybrid online program) 验证预测结果,初步选定miR373和miR542-5p可能是潜在的能够靶向EV71病毒基因5′-UTR-1的miRNAs,其序列及与5′-UTR-1基因片段的互补配对模式见表3。序列分析显示miR373和miR542-5p5′端的种子序列与5′-UTR-1基因上的靶点序列完全匹配。
2.4 miR373和miR542-5p对pMIR-5′UTR-1载体荧光素酶活性的影响
将合成的miR373和miR542-5p mimics,miR-RiboTM mimics Negative control为阴性对照,分别同pMIR-5′UTR-1和pRL-CMV质粒共转染RD细胞,30 h后进行Luciferase双荧光检测。结果发现miR373和miR542-5p能在一定程度上下调荧光素酶的活性 (图4)。这进一步验证了miR373和miR542-5p能够通过靶向EV71病毒基因5′-UTR-1发挥作用。

图2 EV71病毒13个基因片段重组pMIR载体的相对荧光素酶活性比较

图3 EV71病毒5′-UTR 3个亚基因片段重组pMIR载体的相对荧光素酶活性比较

表3 miR373和miR542-5p序列及与5′-UTR-1基因片段的互补配对模式

图4 miR373和miR542-5p对pMIR-5′UTR-1载体荧光素酶活性的影响
2.5 miR373和miR542-5p调控EV71在RD细胞中病毒蛋白的表达
为了验证miR373和miR542-5p靶向病毒5′-UTR-1的调控作用能否影响EV71病毒在宿主细胞中的复制,将合成的miR373和miR542-5p mimics,miR-RiboTM mimics Negative control为阴性对照,分别转染12孔板培养的RD细胞,感染病毒48 h后提取细胞蛋白,通过Western blotting检测EV71病毒蛋白表达水平,以β-actin为内参,对比各实验组和对照组EV71病毒蛋白的表达量,结果见图5。结果表明与对照相比,miR373和miR542-5p能够抑制EV71病毒蛋白在RD细胞中的表达。
2.6 miR373和miR542-5p调控EV71在RD细胞中病毒mRNA的表达
为了进一步验证miR373和miR542-5p能够调控EV71病毒在宿主细胞中的复制,将合成的miR373、miR542-5p mimics和miR-RiboTM mimics Negative control为阴性对照,分别转染12孔板培养的RD细胞,感染病毒48 h后用Trizol法提取总RNA,反转录成cDNA后,使用Real-time PCR分析miR373和miR542-5p对EV71病毒mRNA表达的影响,结果见图6。结果表明与对照相比,转染miR373和miR542-5p的细胞中EV71病毒mRNA表达分别下调了47.59%±4.89%和61.41%±2.69%,说明miR373和miR542-5p能够促抑制EV71病毒mRNA在RD细胞中的表达。这一结果与Western blotting实验结果一致。

图5 Western blotting检测miR373和miR542-5p对EV71在RD细胞中病毒蛋白表达的影响

图6 Real-time PCR检测miR373和miR542-5p对EV71在RD细胞中病毒mRNA表达的影响
3 讨论
病毒感染细胞后,与宿主细胞发生复杂的相互作用,二者相互影响。病毒进入宿主细胞后,促使宿主细胞发生有利于病毒自身复制增殖的改变,包括miRNAs表达水平的变化。如在Epstein-Barr病毒感染细胞后能诱导宿主细胞产生miR155,miR155参与了Epstein-Barr病毒调控宿主基因表达的过程。而EB病毒的LMP1 蛋白通过NF-κB途径能诱导宿主细胞中miR146a的表达,miR146a通过调节宿主细胞的天然免疫反应,在诱导和维持EB病毒的潜伏中起重要作用。病毒能影响细胞miRNAs的表达水平,而miRNAs也能对病毒蛋白的表达进行调控,影响病毒在宿主细胞中的复制。在宿主细胞受到病毒感染后,免疫系统也会针对病毒产生抗病毒反应,其中某些就是通过miRNAs的作用来实现的。如HIV感染后,宿主细胞编码的一系列靶向HIV蛋白的miRNAs能抑制病毒的复制,其中miR29a和miR29b可以靶向基因,miR149可以靶向基因,miR378可以靶向基因,而miR324-5p则可以靶向基因。哺乳动物的miR32则能抑制Ⅰ型泡沫病毒(PFV-I) 在宿主细胞中的积累。
病毒对于宿主细胞这种利用miRNAs 分子抗病毒感染作用也有相应的拮抗方式,如HCV 的核心蛋白能直接作用于miRNAs 成熟的关键核酸酶Dicer,而HIV-1病毒编码的Tat蛋白也能与Dicer酶相互作用抑制其功能,这些蛋白起到了RNA沉默抑制剂的作用。另外Haasnoot等在Vero细胞中也检测到NS1能抑制siRNA对Luciferase蛋白表达的下调,表现出RNA沉默抑制剂的作用。
另外大多病毒基因组编码的miRNAs 不仅可以靶向自身蛋白,还可以调控宿主抗病毒通路,如人巨细胞病毒HCMV编码的miRUL112-1能靶向病毒基因组的3′非编码区,调控包括即早期蛋白IE72在内的多个病毒蛋白的表达;而HIV-1则能通过编码参与调控CD4、CD28、IL-2、IL-12等细胞因子的miRNAs,来抑制宿主的抗病毒作用。一般认为miRNAs是通过增强病毒蛋白表达、抑制宿主细胞抗病毒功能或抑制宿主细胞凋亡等几个途径来促进病毒复制的。Jopling等的研究表明miR122通过与HCV基因组的5′非编码区相互作用使病毒RNA 在细胞中富集,促进病毒基因的转录,从而促进病毒的复制。Cui等对感染EV71病毒后的Hep2细胞进行深度测序,发现感染EV71病毒后miRNAs表达的变化,其中发现有64种miRNA的表达量增加超过了2倍,并通过基因本体(Gene ontology) 分析,发现这其中大部分基因参与EV71感染相关的神经活动、免疫应答和细胞凋亡。其首次验证了miRNA与EV71感染的关系,但是其中具体的作用机制还有待于深入研究。为本课题miRNAs的研究提供了有力的参考依据。Ho等还发现肠道病毒诱导的miR-141能够通过靶向elF4E进而抑制宿主蛋白的表达。RD细胞感染EV71后,通过定量PCR检测miRNAs的表达变化,发现miR-141和miR-146a的表达增高,其他还有14种miRNAs表达下调。这一发现是研究miRNA在调节病毒与宿主的间的相互作用关系方面取得的又一进展。Zheng等发现EV71感染的细胞中miR-296-5p表达水平显著上调,并且miR-296-5p通过靶向病毒基因组抑制病毒的复制,证明细胞miRNAs能够抑制病毒感染。根据研究报道病毒感染的细胞中miR-23b表达水平显著下调,Wen等运用生物学软件预测miR-23b在EV71基因组上的靶位点,并验证了miR-23b能够通过靶向EV71 3′UTR区下调VP1蛋白表达而抑制EV71的复制。Li等研究表明miRNA-548靶向IFN-λ1 3′UTR并下调IFN-λ1的表达。miRNA-548促进EV71的感染,而且病毒感染可抑制miRNA-548,总之miRNA-548能够通过作用于IFN-λ1而调节宿主抗病毒应答,研究为抗病毒治疗提供了新的潜在治疗靶点。在本实验中筛选出的miR373和miR542-5p,经过初步验证其能通过靶向EV71基因组的5′UTR区发挥作用,从而抑制EV71病毒的复制。但其具体的调控EV71病毒复制的作用机制还需要进一步的 研究。
REFERENCES
[1] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 2004, 116(2): 281–297.
[2] Lynam-Lennon N, Maher SG, Reynolds JV. The roles of microRNA in cancer and apoptosis. Biol Rev Camb Philos Soc, 2009, 84(1): 55–71.
[3] Schickel R, Boyerinas B, Park SM, et al. MicroRNAs: key players in the immune system, differentiation, tumorigenesis and cell death. Oncogene, 2008, 27(45): 5959–5974.
[4] Lecellier CH, Dunoyer P, Arar K, et al. A cellular microRNA mediates antiviral defense in human cells. Science, 2005, 308(5721): 557–560.
[5] Henke JI, Goergen D, Zheng J, et al. MicroRNA-122 stimulates translation of hepatitis C virus RNA. EMBO J, 2008, 27(24): 3300–3310.
[6] Yin Q, McBride J, Fewell C, et al. MicroRNA-155 is an Epstein-Barr virus-induced gene that modulates Epstein-Barr virus-regulated gene expression pathways. J Virol, 2008, 82(11): 5295–5306.
[7] Chang J, Guo JT, Jiang D, et al. Block TM. Liver-specific microRNA miR-122 enhances the replication of hepatitis C virus in nonhepatic cells. J Virol, 2008, 82(16): 8215–8223.
[8] Motsch N, Pfuhl T, Mrazek J, et al. Epstein-Barr virus-encoded latent membrane protein 1(LMP1) induces the expression of the cellular microRNA miR-146a. RNA Biol, 2007, 4(3): 131–137.
[9] Hariharan M, Scaria V, Pillai B, et al. Targets for human encoded microRNAs in HIV genes. Biochem Biophys Res Commun, 2005, 337(4): 1214–1218.
[10] Chen W, Zhang Z, Chen J, et al. HCV core protein interacts with Dicer to antagonize RNA silencing. Virus Res, 2008, 133(2): 250–258.
[11] Bennasser Y, Jeang KT. HIV-1 Tat interaction with Dicer: requirement for RNA. Retrovirology, 2006, 3: 95–100.
[12] Haasnoot J, de Vries W, Geutjes EJ, et al. The Ebola virus VP35 protein is a suppressor of RNA silencing. PLoS Pathog, 2007, 3(6): 794–803.
[13] Grey F, Meyers H, White EA, et al. A human cytomegalovirus-encoded microRNA regulates expression of multiple viral genes involved in replication. PLoS Pathog, 2007, 3(11): 1593–1602.
[14] Bennasser Y, Le SY, Yeung ML, et al. HIV-1 encoded candidate micro-RNAs and their cellular targets. Retrovirology, 2004, 1: 43–47.
[15] Couturier JP, Root-Bernstein RS. HIV may produce inhibitory microRNAs (miRNAs) that block production of CD28, CD4 and some interleukins. J Theor Biol, 2005, 235(2): 169–184.
[16] Jopling CL, Yi M, Lancaster AM, et al. Modulation of hepatitis C virus RNA abundance by a liver-specific MicroRNA. Science, 2005, 309(5740): 1577−1581.
[17] Cui LB, Guo XL, Qi YH, et al. Identification of microRNAs involved in the host response to entervirus 71 infection by deep sequencing approach. J Biomed Biotechnol, 2010, 2010: 425939.
[18] Ho BC, Yu SL, Chen JJ, et al. Enterovirus-induced miR-141 contributes to shutoff of host protein translation by targeting the translation initiation factore IF4E. Cell Host Microbe, 2011, 9(1): 58−69.
[19] Zheng Z, Ke X, Wang M, et al. Human microRNA hsa-miR-296-5p suppresses enterovirus 71 replication by targeting the viral genome. J Virol, 2013, 87(10): 5645–5656.
[20] Wen BP, Dai HJ, Yang YH, et al. MicroRNA-23b inhibits enterovirus 71 replication through downregulation of EV71 VPl protein. Intervirology, 2013, 56(3): 195–200.
[21] Li Y, Xie J, Xu X, et al. MicroRNA-548 down-regulates host antiviral response via direct targeting of IFN-λ1. Protein Cell, 2013, 4(2): 130–141.
(本文责编 陈宏宇)
miR373 and miR542-5pregulate the replication of Enterovirus 71 in rhabdomyosarcoma cells
Zhuo Yang, and Po Tien
1,,100050,Key Laboratory of Pathogenic Microbiology and ImmunologyInstitute of MicrobiologyChinese Academy of SciencesBeijingChina
MicroRNAs (miRNAs) play an important role in infection and replication of virus in host cells. To identify cellular miRNAs involved in the host response to enterovirus 71(EV71) infection,we examined miRNAs effects on the replication of EV71 in rhabdomyosarcoma cells. We constructed target gene of miRNAs screening system. 3′untranslated region (UTR) dual luciferase reporter analysis was used to identify putative miRNA targets in the EV71 virus genome.First, 13 segments of EV71 virus genomes were inserted to the pMIR vector and the luciferase expression were assayed to identify the target gene of putative miRNA. The reporter gene expression of the cells transfected with the vector containing 5′-UTR was significantly downregulated. Then we screened the miRNAs that may target to 5′-UTR using online analysis programs.Furthermore, Western blotting and real-time PCR test were performed to investigate the effect of miRNAs on viral replication. The study showed that miR373 and miR542-5p could suppress the replication of EV71 virus through binding to the 5′-UTR gene. Cellular miRNAs could regulate the replication of EV71 virus in host cells, and our paper should report the role of miR373 and miR542-5p in this regulation for the first time. Our findings supported the notion that the cellular miRNAs might be essential in the host-pathogen interactions.
miRNAs, Enterovirus 71,rhabdomyosarcoma cells, virus replication
November 1, 2013; Accepted: January 8, 2014
National Natural Science Foundation of China (No. 31370201).
Zhuo Yang. Tel: +86-10-83157181; E-mail: zhuoer8623@163.com
国家自然科学基金 (No. 31370201) 资助。

