25羟维生素D3与2型糖尿病患者颈动脉内膜中层厚度的相关性研究
赖杰
药物与临床
25羟维生素D3与2型糖尿病患者颈动脉内膜中层厚度的相关性研究
赖杰
作者单位:100028 北京市,煤炭总医院干部医疗科
目的 探讨2型糖尿病患者颈动脉内膜中层厚度(IMT)与25羟维生素D3浓度的关系。方法 选取2型糖尿病患者295例,均符合1999年WHO制定的2型糖尿病诊断标准,根据眼底照相结果分为无颈动脉斑块组(96例)、颈动脉增厚组(110例)和颈动脉斑块组(89例)。比较三组患者25羟维生素D3浓度的差异。两个连续随机变量的相关性研究采用Pearson相关分析,应用多因素非条件Logistic逐步回归分析法对动脉硬化的危险因素进行分析。结果 25羟维生素D3浓度颈动脉无异常组为(9.80±4.12)ng/ml,颈动脉增厚组为(8.80±3.00)ng/ml,颈动脉斑块组为(7.60±1.09)ng/ml,颈动脉斑块组 25羟维生素 D3浓度低于颈动脉增厚组,而颈动脉增厚组25羟维生素D3浓度低于颈动脉无异常组,差异均有统计学意义(P<0.05)。两个连续随机变量Pearson相关分析显示,颈动脉IMT与25(OH)D3呈显著负相关(r=-0.259,P<0.01)。以有无颈动脉斑块为因变量行多因素非条件Logistic逐步回归分析显示,血清25(OH)D3是预防颈动脉斑块的保护因素( OR=0.878,P<0.05);FBG、hs-CRP、LDL-C、HbA1C 是颈动脉斑块危险增加的独立危险因素 ( OR=1.115、1.130、1.786、1.556)。 结论 25羟维生素D3浓度与2型糖尿病患者颈动脉内膜中层厚度相关,通过测定25(OH)D3的浓度可以预测2型糖尿病患者全身动脉粥样硬化情况,适当补充可以预防糖尿病患者大血管并发症的发生。
糖尿病; 维生素D; 颈动脉斑块; 动脉粥样硬化
随着我国糖尿病患病率的增加,糖尿病各种慢性并发症也随之增多,而各种糖尿病并发症已成为糖尿病患者致残、致死的主要原因。75%~80%的糖尿病患者死于大血管病变,尤其是心脑血管疾病,其死亡率是非糖尿病人群的2~8倍[1],因此糖尿病被视为心脑血管疾病或冠心病的等危症。研究表明,心脑血管疾病的根本病因在于动脉粥样硬化,而动脉粥样硬化的危险因素很多,如血脂、血糖、血尿酸、CRP等。近年来人们把研究重点转移到影响钙磷代谢的维生素D。2型糖尿病(T2DM)患者合并心脑血管病比单有心脑血管病者的25羟维生素D3[25(OH)D3]浓度更低[2],因此推测 25(OH)D3浓度降低与糖尿病患者动脉粥样硬化形成有关。颈动脉内中层厚度(IMT)是全身动脉粥样硬化的标志,本研究旨在探讨T2DM患者25(OH)D3浓度同颈动脉IMT的关系。
1 对象与方法
1.1 研究对象 选择2012年11月至2013年12月在我院住院的2型糖尿病患者295例,所有入选患者均符合1999年WHO 2型糖尿病诊断标准。排除标准:①存在影响维生素D吸收及代谢的疾病,如慢性肾功能不全、胃肠道炎症、吸收不良综合征、骨质疏松、其他骨代谢异常疾病及酗酒者;②既往或正在服用可能影响补充维生素D代谢的药物(如维生素或矿物质补充剂、糖皮质激素等)者;③存在急性心脑血管疾病、糖尿病急性并发症、恶性肿瘤及其他应激状态者。④妊娠妇女。
1.2 检查方法 ①一般信息收集:记录患者年龄、性别、糖尿病病程、是否吸烟、有无糖尿病家族史和高血压家族史等,测量身高、体重、腰围、臀围和血压,计算体重指数(body mass index,BMI)和腰臀比(waist to hip ratio,WHR)。②生化指标检测:受检者晚餐后禁食10~14 h,次日空腹采静脉血,3 h内分离血清。采用葡萄糖氧化酶法测定血中葡萄糖,同时检测空腹血糖(FBG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、高敏 C反应蛋白(hs-CRP)、脂蛋白 a[LP(a)]、血尿酸(UA)等生化指标。收集晚8时至次日8时24 h全部尿液,测尿微量白蛋白排泄率(UAER)。
1.3 25(OH)D3的测定 采用ELISA法,试剂盒由英国Immunodiagnostic Systems Limited提供,正常健康成人参考范围为30~100 ng/ml。
1.4 颈动脉检测 应用HDI 5000彩色多普勒超声仪(荷兰Philips公司)测量颈动脉IMT,探头频率为10 MHz,由专人操作。患者取低枕仰卧位,肩部垫高,颈后仰,探头置于胸锁乳突肌前缘或后缘,横纵向观察颈总动脉,选取颈动脉膨大下1 cm,或以颈动脉壁IMT最厚处及近心1 cm、远心1 cm 3个点的厚度,左右两侧6个点的均值作为IMT。同时观察血管腔内有无斑块,将IMT≥1.2 mm或局限性回声结构突出管腔(回声可不均匀或伴声影)其高度超过周围IMT的50%定义为斑块;0.8 mm<IMT<1.2 mm为颈动脉内中膜增厚。
1.5 分组 按所测颈动脉斑块厚度将295例患者分为三组:A组96例,IMT≤0.8 mm,为颈动脉无异常组;B 组 110例,0.8 mm<IMT<1.2 mm,为颈动脉增厚组;C组89例,IMT≥1.2 mm或局限性回声结构突出管腔(回声可不均匀或伴声影)其高度超过周围IMT的50%,为颈动脉斑块组。分析25(OH)D3浓度同颈动脉IMT的关系。
1.6 统计学方法 采用SPSS 17.0软件进行分析。各计量资料经正态性检验,非正态分布数据转换后使其符合正态分布。计量资料采用±s表示,三组间均数比较用单因素方差分析(若方差齐采用LSD法,若方差不齐,采用Dunnetts C法);两个连续随机变量的相关采用Pearson相关分析;采用多元Logistic回归分析方法分析颈动脉有无斑块的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 不同IMT厚度的患者临床资料 三组患者性别、年龄、吸烟史、糖尿病家族史和高血压家族史、WHR、BMI、收缩压、UA、LP(a)、TG、HDL-C 比较差异均无统计学意义(P>0.05)。C组糖尿病病程、FBG、hs-CRP、UAER 明显高于 A、B 组(P<0.05),而A、B组间无明显差异;C组LDL-C、HbA1C高于B组,而B组两项均高于A组;A组25(OH)D3高于B、C组,而B组高于C组;C组胆固醇高于A组,而B、C及A、B组间无明显差异。见表1。
2.2 颈动脉IMT与各变量的Pearson相关分析结果 颈动脉IMT与糖尿病病程、FBS、TC、hs-CRP、LDL-C、HbA1C、UAER 呈正相关 (r=0.185、0.242、0.205、0.207、0.257、0.285、0.174,P<0.05), 与 25(OH)D3呈显著负相关(r=-0.259,P<0.01)。见表 2。
2.3 Logist回归分析方法分析颈动脉形成的危险因素 在总人群中,将25(OH)D3水平与年龄、糖尿病病程、高血压家族史和糖尿病家族史、吸烟史、BMI、WHR、收缩压、FBG、hs-CRP、TC、TG、HDL-C、LDL-C、HbA1C、UA、LP(a)和 UAER 同时放入回归方程,结果显示,血清25(OH)D3是预防颈动脉斑块的保护因素(OR=0.878,P<0.05),FBG、hs-CRP、LDL-C、HbA1C是颈动脉斑块的独立危险因素(OR=1.115、1.130、1.786、1.556)。见表 3。
表1 颈动脉无异常组、颈动脉增厚组、颈动脉斑块组基本资料(±s)
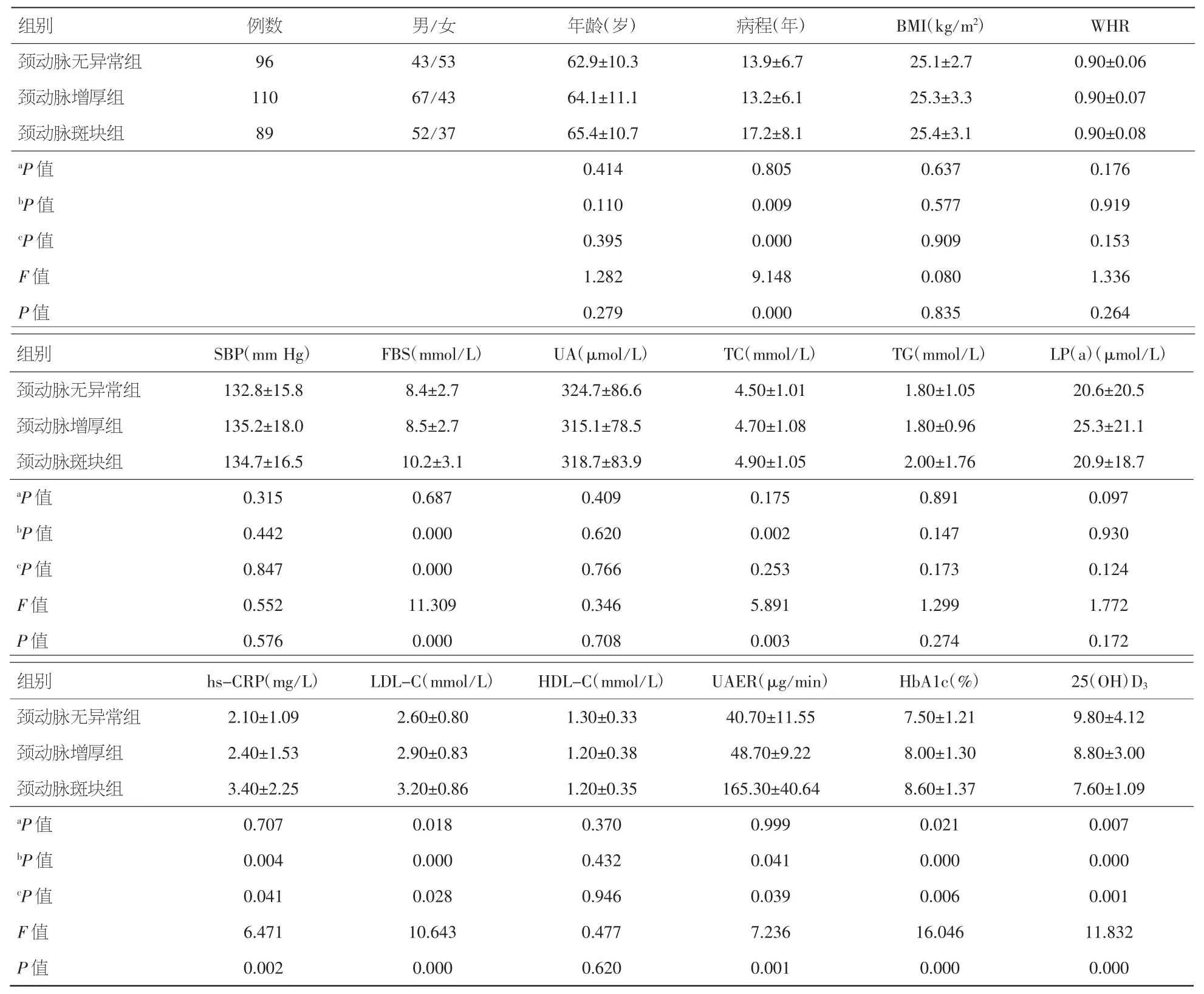
表1 颈动脉无异常组、颈动脉增厚组、颈动脉斑块组基本资料(±s)
注:aP:A组与B组比较;bP:A组与C组比较;cP:B组与C组比较。1 mm Hg=0.133 kPa
组别例数男/女年龄(岁)病程(年)BMI(kg/m2)WHR颈动脉无异常组 96 43/53 62.9±10.3 13.9±6.7 25.1±2.7 0.90±0.06颈动脉增厚组 110 67/43 64.1±11.1 13.2±6.1 25.3±3.3 0.90±0.07颈动脉斑块组 89 52/37 65.4±10.7 17.2±8.1 25.4±3.1 0.90±0.08aP值 0.414 0.805 0.637 0.176bP值 0.110 0.009 0.577 0.919cP值 0.395 0.000 0.909 0.153 F值 1.282 9.148 0.080 1.336 P值 0.279 0.000 0.835 0.264组别 SBP(mm Hg) FBS(mmol/L) UA(μmol/L) TC(mmol/L) TG(mmol/L) LP(a)(μmol/L)颈动脉无异常组 132.8±15.8 8.4±2.7 324.7±86.6 4.50±1.01 1.80±1.05 20.6±20.5颈动脉增厚组 135.2±18.0 8.5±2.7 315.1±78.5 4.70±1.08 1.80±0.96 25.3±21.1颈动脉斑块组 134.7±16.5 10.2±3.1 318.7±83.9 4.90±1.05 2.00±1.76 20.9±18.7aP值 0.315 0.687 0.409 0.175 0.891 0.097bP值 0.442 0.000 0.620 0.002 0.147 0.930cP值 0.847 0.000 0.766 0.253 0.173 0.124 F值 0.552 11.309 0.346 5.891 1.299 1.772 P值 0.576 0.000 0.708 0.003 0.274 0.172组别 hs-CRP(mg/L) LDL-C(mmol/L) HDL-C(mmol/L) UAER(μg/min) HbA1c(%) 25(OH)D3颈动脉无异常组 2.10±1.09 2.60±0.80 1.30±0.33 40.70±11.55 7.50±1.21 9.80±4.12颈动脉增厚组 2.40±1.53 2.90±0.83 1.20±0.38 48.70±9.22 8.00±1.30 8.80±3.00颈动脉斑块组 3.40±2.25 3.20±0.86 1.20±0.35 165.30±40.64 8.60±1.37 7.60±1.09aP值 0.707 0.018 0.370 0.999 0.021 0.007bP值 0.004 0.000 0.432 0.041 0.000 0.000cP值 0.041 0.028 0.946 0.039 0.006 0.001 F值 6.471 10.643 0.477 7.236 16.046 11.832 P值 0.002 0.000 0.620 0.001 0.000 0.000
3 讨论
根据2010年中国糖尿病患病率调查显示,我国大约有9240万成年人患有糖尿病。UKPDS已研究证实,2型糖尿病患者死亡原因中大血管病变占59%[1],高于微血管病变近70倍。因此,对于我国庞大的糖尿病人群来说,对糖尿病大血管并发症的早期预防至关重要,可明显提高糖尿病患者的生活质量与生存时间。针对此类疾病,除了现有的诊断与治疗手段外,新危险因素的发现与早期干预同样任重而道远。动脉内膜是动脉粥样硬化最早累及的部位,颈动脉位置表浅,易于超声检查,因此可作为反映全身动脉粥样硬化的窗口。
糖尿病致动脉粥样硬化的机制很多,包括血脂代谢异常、晚期糖基化终产物、氧化应激、内皮功能紊乱、高胰岛素血症和胰岛素抵抗等[1]。近年来发现25(OH)D3水平与2型糖尿病、心脑血管病等慢性疾病显著相关。有研究表明,补充足量维生素D及钙剂的人群与补充较少的人群相比,患糖尿病和心血管疾病的相对危险比显著降低,且单独补充维生素D比单独补充钙剂疗效更佳。此项干预随访研究说明,补充维生素D有可能成为预防糖尿病和心血管疾病的有效措施。一项15 088人参加的横断面研究显示,维生素D缺乏的患者高血压(风险比 1.30)、糖尿病(风险比 1.98)和高脂血症(风险比 1.47)的发生率明显升高(P<0.01)。Semba 等研究了1006例年龄在65岁以上的老年人血清中1,25(OH)D3与全因病死率和心血管疾病病死率的关系,经过6.5年的随访观察,证明老年人群血清中1,25(OH)2D3水平低者全因病死率和心血管疾病病死率都更高。维生素D抗动脉粥样硬化可能的主要生理学机制是:①抑制多种引起动脉粥样硬化的炎症反应[3];②经免疫细胞维生素D受体的介导而发挥免疫调节作用,抑制血管形成和血管平滑肌细胞的增殖,减少动脉钙化和动脉粥样硬化的发生[4,5];③动物研究发现,维生素D也是肾素血管紧张素系统的抑制因子[6];④1,25(OH)2D3通过减少糖尿病患者乙酰化及氧化的LDL-C摄取,能阻抑血管壁泡沫细胞(富含脂质的巨噬细胞)的形成,延缓动脉粥样硬化进程[7];⑤增加胰岛素分泌,减轻胰岛素抵抗,而胰岛素抵抗是动脉硬化症的病因之一[8]。虽然 1,25(OH)2D3在人体内具有较高的生物活性,但半衰期短,血液浓度不稳定。25(OH)D3则是人体肝内储存及血液中运输的主要形式,也是血液中浓度最高的维生素D代谢物,半衰期长,且不受钙、磷和甲状旁腺素的直接调节,因此本研究以检测25(OH)D3作为人体维生素D营养状态的有效指标[9]。
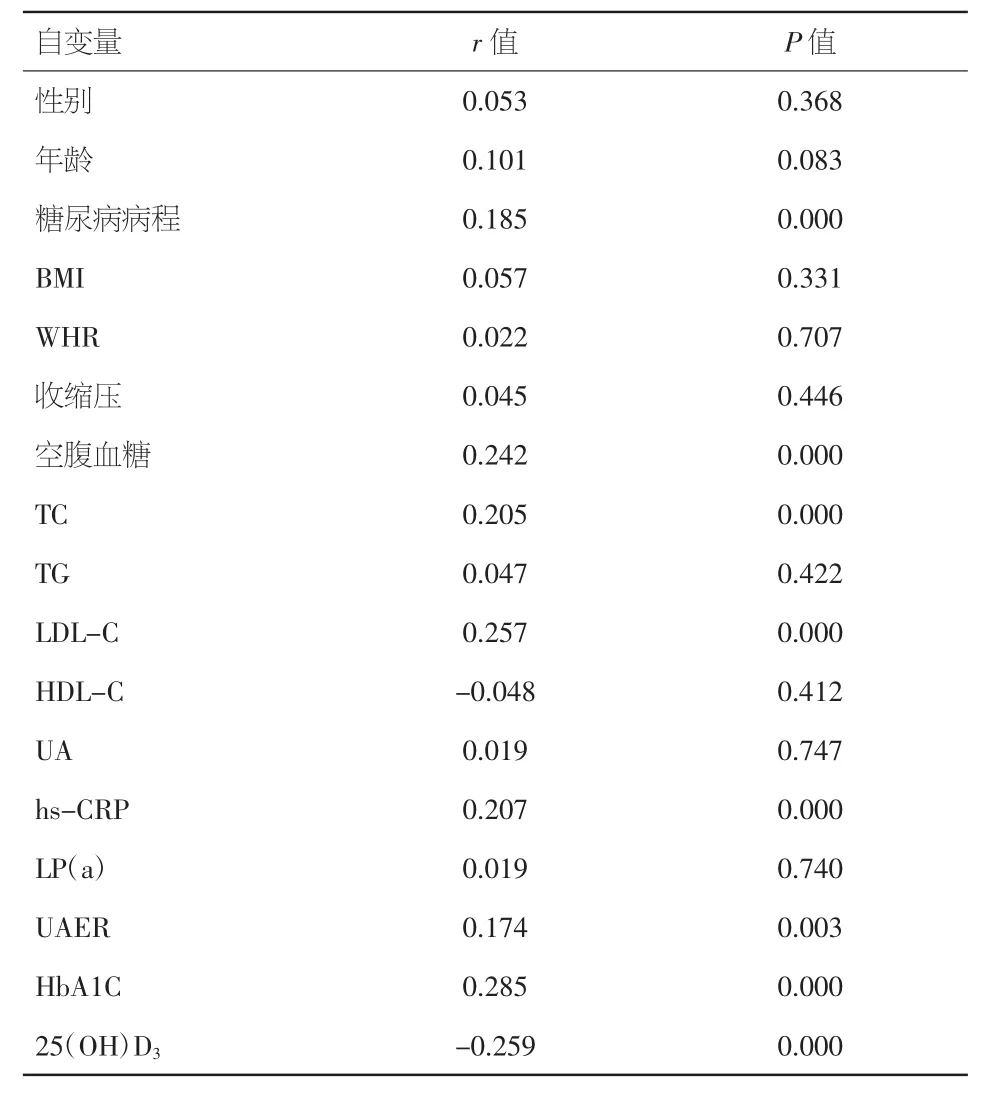
表2 Pearson相关性分析颈动脉IMT与各变量的相关性
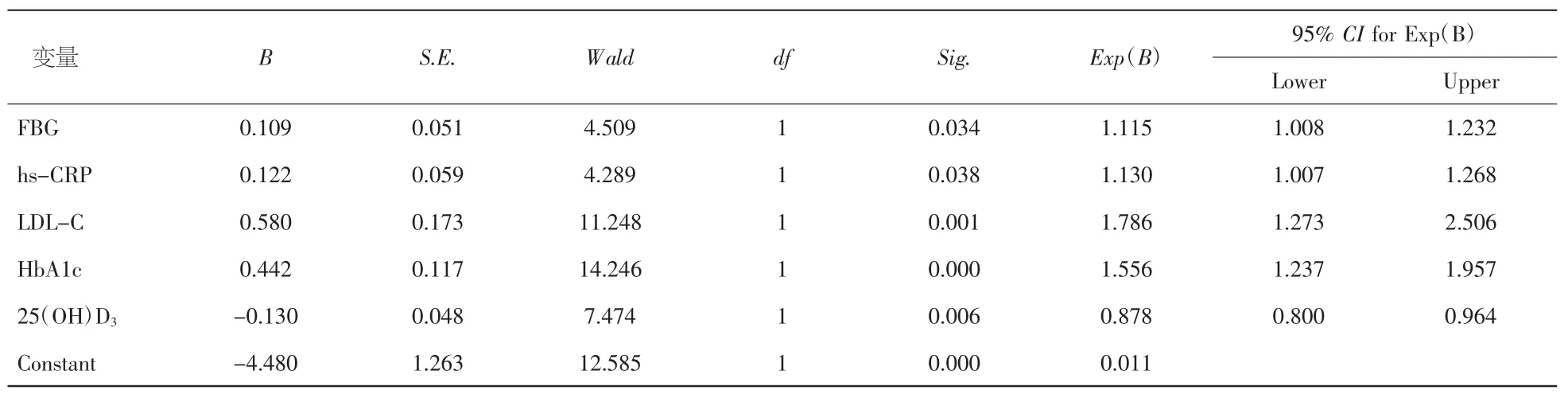
表3 颈动脉斑块形成危险因素Logistic回归分析
本研究显示,颈动脉斑块组糖尿病病程、FBG、TC、hs-CRP、UAER明显高于无颈动脉斑块及颈动脉增厚组。随着糖尿病患者25(OH)D3浓度的下降、低密度脂蛋白的降低及糖化血红蛋白的升高,颈动脉IMT厚度增加,斑块发生率越高。相关分析显示,颈动脉IMT与25(OH)D3呈负相关。Logistic回归分析显示,25(OH)D3是预防颈动脉斑块形成的保护性因素。这些数据表明,2型糖尿病患者血清25(OH)D3浓度降低与临床前期的动脉粥样硬化相关,通过测定25(OH)D3浓度可以预测2型糖尿病患者全身动脉粥样硬化情况,而动脉粥样硬化是心脑血管疾病的潜在危险因素。
综上所述,维生素D在多种疾病的发生发展过程中都扮演了重要的角色。通过本研究我们可以看到,适当补充维生素D可预防或减少2型糖尿病患者大血管并发症的发生发展。本研究正是通过评价颈动脉内中膜厚度与维生素D3的关系来证实维生素D对全身动脉硬化可能存在的预防作用。但维生素D缺乏究竟到何种程度才能开始维生素D治疗,各种维生素D类似物间的补充有何不同的临床效果,维生素D的补充剂量如何掌握,其补充剂量与动脉硬化程度是否呈剂量依赖关系,是需要我们进一步研究的课题。
[1]刘金霞,项洁,卜瑞芳,等.2型糖尿病患者血清25-羟维生素D浓度与颈动脉内膜中层厚度的关系.中华心血管病杂志,2012,40:115-119.
[2] Cigolini M, Iagulli MP, Mieoni V, et al.Serum 25-hydroxyvitamin D3concentrations and prevalence of cardiovascular disease among type 2 diabetic patients.Diabetes Care,2006,29:722-724.
[3] Wang L,Manson JE,Song Y,et al.Systematic review: vitamin D and calcium supplementation in prevention of cardiovascular events.Ann Intem Med,2010,152:315-323.
[4] Martins D, Wolf M, Pan D, et al.Prevalence of cardiovascular risk hctore and the sertlm levels of 25.hydroxyvitamin D in the United Slates:data from the third national health and nutrition exanfination survey.Arch Intern Med,2007,167:1159-1165.
[5] Semba RD, Houston DK, Bandinelli S, et al.Relationship of 25-hydroxyvitamin D witlh all-cause and cardiovascuIar disease mortality in older community-dwelling adults.Eur J clin Nutr,2010,64:203-209.
[6] Michos ED, Reis JP, Melamed ML.Vitamin D Status and CardiovascularHealth: A 2009 Update.The Open Clinical Chemistry Journal,2010,10:51-59.
[7] Mathieu C, Adorini L.The coming of age of 1,25-dihydroxyvitamin D(3) anarkigs as immunomodulalory agents.Trends Mol Med,2002,8:174-179.
[8] Li AC, Glass CK.The macrophage foam cell as a largel for therapeutic intervention.Na Med,2002,8:1235-1242.
[9] Li YC, Kong J,Wei M, et al.1,25-Dihydroxyvitamin D ( 3) is anegative endocrine regulator of the rennin-angiotensin system.J Clin Invest,2002,110:229-238.
The correlation study of 25 hydroxy Vitamin D concentration and carotid artery intima-media thickness in type 2 diabetic patients
LAI Jie.China the Medical Department of Cadres, Meitan General Hospital, Beijing 100028, China
Objective To explore the correlation between carotid artery intima-media thickness( IMT)and the 25 hydroxyl Vitamin D3concentration in type 2 diabetic patients.Methods According with the diagnostic criteria formulated by the WHO in 1999,295 patients with type 2 diabetes were enrolled.According to the fundus photography were divided into without carotid plaque group( 96 cases) , carotid artery thickening group( 110 cases)and carotid artery plaque group( 89 cases).Differences in patient 25 hydroxy Vitamin D3concentration between the three groups.Study on relationship between two continuous random variables by using Pearson correlation analysis,non conditional Logistic regression analysis of risk factors of atherosclerosis were analyzed by multi factor.Results Carotid artery 25 hydroxy Vitamin D3concentration and no abnormal group( 9.80±4.12)ng/ml, carotid artery thickening group( 8.80±3.00)ng/ml, carotid artery plaque group was( 7.60±1.09)ng/ml, carotid artery plaque group of 25 hydroxy Vitamin D3concentrations below the carotid artery thickening group,but lower than the carotid artery without exception carotid artery thickening group 25 hydroxyl Vitamin D3concentration, the differences were statistically significant( P<0.05).Two continuous random variable Pearson correlation analysis showed, the carotid artery IMT and 25( OH)D3showed a significant negative correlation( r=-0.259, P<0.01).With no plaque of carotidartery as the dependent variable for multiple factor non conditional Logistic regression analysis showed,serum 25( OH)D3were protective factors of carotid plaques( OR=0.878,P<0.05); FBG, hs-CRP, LDL-C, HbA1C are the independent risk factors of carotid artery plaque increased risk( OR=1.115, 1.130, 1.786, 1.556).Conclusion 25 hydroxy Vitamin D3concentration are correlate with thickness of carotid artery intima-media in type 2 diabetic patients,and may predict systemic atherosclerosis in type 2 diabetes.
Diabetes mellitus; Vitamin D; Carotid plaque; Atherosclerosis
LAI Jie, E-mail:laijie19790811@163.com
赖杰,E-mail:laijie19790811@163.com
10.3969/j.issn.1672-5301.2014.05.020
A
1672-5301(2014)05-0465-05
2014-02-13)

